有机化学 ›› 2022, Vol. 42 ›› Issue (9): 2832-2839.DOI: 10.6023/cjoc202203051 上一篇 下一篇
所属专题: 有机氟化学虚拟合辑
研究论文
李文娟a,*( ), 张睿a, 蔡志华a, 韩小强b,*(
), 张睿a, 蔡志华a, 韩小强b,*( ), 何林a, 代斌a
), 何林a, 代斌a
收稿日期:2022-03-24
修回日期:2022-05-13
发布日期:2022-06-22
通讯作者:
李文娟, 韩小强
基金资助:
Wenjuan Lia( ), Rui Zhanga, Zhihua Caia, Xiaoqiang Hanb(
), Rui Zhanga, Zhihua Caia, Xiaoqiang Hanb( ), Lin Hea, Bin Daia
), Lin Hea, Bin Daia
Received:2022-03-24
Revised:2022-05-13
Published:2022-06-22
Contact:
Wenjuan Li, Xiaoqiang Han
Supported by:文章分享
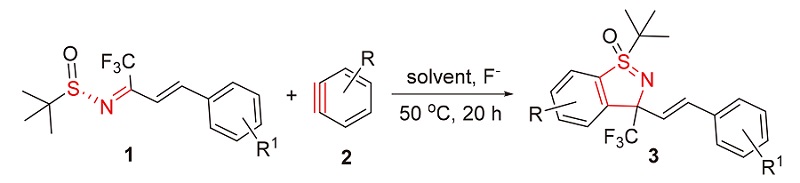
亚砜亚胺由于其抗疟、抗菌及除草等特性在农药和医药领域有广泛的应用. 以苯炔与三氟甲基取代的α,β-不饱和叔丁基亚磺酰胺通过[3+2]环加成反应构建了三氟甲基芳基取代的苯并环状亚砜亚胺骨架. 反应以氟化钾为氟试剂, 18-冠-6为添加剂, 乙腈/甲苯(V∶V=4∶1)为溶剂, 室温反应20 h, 条件温和, 收率低到中等(13%~57%). 采用浸渍法测定该类化合物对棉蚜的杀虫活性, 结果表明, (1R,3S)-1-(叔丁基)-3-((E)-4-甲基苯乙烯基)-3-(三氟甲基)苯并[d]异噻唑1-氧化物(3b)和(1R,3S)-1-(叔丁基)-3-(三氟甲基)-3-((E)-4-(三氟甲基)苯乙烯基)苯并[d]异噻唑1-氧化物(3h)的24 h LC50低于阳性对照吡虫啉(LC50 0.0800 mg/L)和啶虫脒(LC50 0.0532 mg/L), 可作为杀虫药物的先导化合物进行结构修饰研究.
李文娟, 张睿, 蔡志华, 韩小强, 何林, 代斌. 苯炔[3+2]环加成反应构建三氟甲基取代的苯并环状亚砜亚胺衍生物及其杀棉蚜活性研究[J]. 有机化学, 2022, 42(9): 2832-2839.
Wenjuan Li, Rui Zhang, Zhihua Cai, Xiaoqiang Han, Lin He, Bin Dai. Constrution and Insecticidal Activities of Trifluoromethylated Benzocyclicsulfoximine Derivatives by [3+2] Cycloaddition Reaction of Beznyne[J]. Chinese Journal of Organic Chemistry, 2022, 42(9): 2832-2839.
| Entry | F source | Solvent | Temp./℃ | Time/h | Yieldb/% of 3a |
|---|---|---|---|---|---|
| 1 | KF/18-C-6 | THF | 50 | 20 | 22 |
| 2 | KF/18-C-6 | CH3CN | 50 | 20 | 36 |
| 3 | KF/18-C-6 | Toluene | 50 | 20 | 11 |
| 4 | KF/18-C-6 | 1,4-Dioxane | 50 | 20 | 12 |
| 5 | KF/18-C-6 | 1,2-Dimethoxyethane | 50 | 20 | 25 |
| 6 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 50 | 20 | 50 |
| 7 | CsF | CH3CN/toluene (V∶V=4∶1) | 50 | 20 | 22 |
| 8 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 50 | 11 | 36 |
| 9 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 50 | 36 | 40 |
| 10 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 50 | 48 | 44 |
| 11 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 50 | 96 | 23 |
| 12 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 80 | 11 | 32 |
| 13 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 80 | 23 | 32 |
| 14 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 100 | 9 | 39 |
| 15c | TBAF | THF | 50 | 22 | Nr |
| 16 | CsF | CH2Cl2 | 50 | 12 | Nr |
| Entry | F source | Solvent | Temp./℃ | Time/h | Yieldb/% of 3a |
|---|---|---|---|---|---|
| 1 | KF/18-C-6 | THF | 50 | 20 | 22 |
| 2 | KF/18-C-6 | CH3CN | 50 | 20 | 36 |
| 3 | KF/18-C-6 | Toluene | 50 | 20 | 11 |
| 4 | KF/18-C-6 | 1,4-Dioxane | 50 | 20 | 12 |
| 5 | KF/18-C-6 | 1,2-Dimethoxyethane | 50 | 20 | 25 |
| 6 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 50 | 20 | 50 |
| 7 | CsF | CH3CN/toluene (V∶V=4∶1) | 50 | 20 | 22 |
| 8 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 50 | 11 | 36 |
| 9 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 50 | 36 | 40 |
| 10 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 50 | 48 | 44 |
| 11 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 50 | 96 | 23 |
| 12 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 80 | 11 | 32 |
| 13 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 80 | 23 | 32 |
| 14 | KF/18-C-6 | CH3CN/toluene (V∶V=4∶1) | 100 | 9 | 39 |
| 15c | TBAF | THF | 50 | 22 | Nr |
| 16 | CsF | CH2Cl2 | 50 | 12 | Nr |
| Compd. | LC50/(mg•L–1) | Compd. | LC50/(mg•L–1) |
|---|---|---|---|
| 3a | 1.5976 | 3g | 0.0860 |
| 3b | 0.0246 | 3h | 0.0077 |
| 3c | 0.6820 | 3i | 1.6558 |
| 3d | 0.8489 | Imidacolprid | 0.0800 |
| 3e | 0.3501 | Dinitraz | 0.0532 |
| 3f | 0.4055 |
| Compd. | LC50/(mg•L–1) | Compd. | LC50/(mg•L–1) |
|---|---|---|---|
| 3a | 1.5976 | 3g | 0.0860 |
| 3b | 0.0246 | 3h | 0.0077 |
| 3c | 0.6820 | 3i | 1.6558 |
| 3d | 0.8489 | Imidacolprid | 0.0800 |
| 3e | 0.3501 | Dinitraz | 0.0532 |
| 3f | 0.4055 |
| [1] |
(a) Himeshima, Y.; Sonoda, T.; Kobayashi, H. Chem. Lett. 1983, 12, 1211.
doi: 10.1246/cl.1983.1211 |
|
(b) For a facile two-step preparation of o-silylaryltriflates from the corresponding o-bromophenols, see: Peña, D.; Cobas, A.; Pérez, D.; Guitián, E. Synthesis 2002, 1454.
|
|
| [2] |
For selected examples of insertion-cyclization reaction of arynes, see: (a) Gilmore, C. D.; Allan, K. M.; Stoltz, B. M. J. Am. Chem. Soc. 2008, 130, 1558.
doi: 10.1021/ja0780582 |
|
(b) Li, Y. Y.; Qiu, D. C.; Gu, R. R.; Wang, J. L.; Shi, J. R.; Li, Y. J. Am. Chem. Soc. 2016, 138, 10814.
doi: 10.1021/jacs.6b06981 |
|
|
(c) Shi, J.; Qiu, D.; Wang, J.; Xu, H.; Li, Y. J. Am. Chem. Soc. 2015, 137, 5670.
doi: 10.1021/jacs.5b02566 |
|
|
(d) Rao, B.; Tang, J.; Wei, Y.; Zeng, X. Chem.-Asian J. 2016, 11, 991.
doi: 10.1002/asia.201600065 |
|
|
(e) Sundalam, S. K.; Nilova, A.; Seidl, T. L.; Stuart, D. R. Angew. Chem., nt. Ed. 2016, 55, 8431.
|
|
|
(f) Thangaraj, M.; Bhojgude, S. S.; Jain, S.; Gonnade, R. G.; Biju, A. T. J. Org. Chem. 2016, 81, 8604.
doi: 10.1021/acs.joc.6b01472 |
|
|
(g) Tao, Y.; Zhang, F.; Tang, C. Y.; Wu, X. Y.; Sha, F. Asian J. Org. Chem. 2014, 3, 1292.
doi: 10.1002/ajoc.201402152 |
|
| [3] |
For selected examples, see: (a) Shi, F.; Waldo, J. P.; Chen, Y.; Larock, R. C. Org. Lett. 2008, 10, 2409.
doi: 10.1021/ol800675u |
|
(b) Fang, Y.; Larock, R. C.; Shi, F. Asian J. Org. Chem. 2014, 3, 55.
doi: 10.1002/ajoc.201300221 |
|
|
(c) Ikawa, T.; Takagi, A.; Goto, M. J. Org. Chem. 2013, 78, 2965.
doi: 10.1021/jo302802b |
|
|
(d) Swain, S. P.; Shih, Y. C.; Tsay, S. C. Angew. Chem., nt. Ed. 2015, 54, 9926.
|
|
| [4] |
For selected examples of multicomponent reactions of arynes, see: (a) Suh, S. E.; Chenoweth, D. M. Org. Lett. 2016, 18, 4080.
doi: 10.1021/acs.orglett.6b01977 pmid: 26655335 |
|
(b) Bhojgude, S. S.; Baviskar, D. R.; Gonnade, R. G.; Biju, A. T. Org. Lett. 2015, 17, 6270.
doi: 10.1021/acs.orglett.5b03319 pmid: 26655335 |
|
|
(c) Zeng, Y. W.; Li, G. Y.; Hu, J. B. Angew. Chem., nt. Ed. 2015, 4, 10773.
pmid: 26655335 |
|
|
(d) Sha, F.; Huang, X. Angew. Chem., nt. Ed. 2009, 48, 3458.
pmid: 26655335 |
|
|
(e) Yoshida, H.; Asatsu, Y.; Mimura, Y.; Ito, Y.; Ohshita, J.; Takaki, K. Angew. Chem., nt. Ed. 2011, 50, 9676.
pmid: 26655335 |
|
| [5] |
(a) Goldberg, F. W.; Kettle, J. G.; Xiong, J.; Lin, D. Tetrahedron 2014, 70, 6613.
doi: 10.1016/j.tet.2014.06.120 pmid: 26083237 |
|
(b) Goldberg, F. W.; Kettle, J. G.; Kogej, T.; Perry, M. W. D.; Tomkinson, N. P. Drug Discovery Today 2015, 20, 11.
doi: 10.1016/j.drudis.2014.09.023 pmid: 26083237 |
|
|
(c) Nishimura, N.; Norman, M. H.; Liu, L.; Yang, K. C.; Ashton, K. S.; Bartberger, M. D.; Chmait, S.; Chen, J.; Cupples, R.; Fotsch, C.; Helmering, J.; Jordan, S. R.; Kunz, R. K.; Pennington, L. D.; Poon, S. F.; Siegmund, A.; Sivits, G.; Lloyd, D. J.; Hale, C.; St. Jean, D. J. J. Med. Chem. 2014, 57, 3094.
doi: 10.1021/jm5000497 pmid: 26083237 |
|
|
(d) Nugent, B. M.; Buysse, A. M.; Loso, M. R.; Babcock, J. M.; Johnson, T. C.; Oliver, M. P.; Martin, T. P.; Ober, M. S.; Breaux, N.; Robinson, A.; Adelfinskaya, Y. Pest Manage. Sci. 2015, 71, 928.
doi: 10.1002/ps.3865 pmid: 26083237 |
|
|
(e) von Nussbaum, F.; Li, V. M.-J.; Allerheiligen, S.; Anlauf, S.; Bärfacker, L.; Bechem, M.; Delbeck, M.; Fitzgerald, M. F.; Gerisch, M.; Gielen-Haertwig, H.; Haning, H.; Karthaus, D.; Lang, D.; Lustig, K.; Meibom, D.; Mittendorf, J.; Rosentreter, U.; Schäfer, M.; Schäfer, S.; Schamberger, J.; Telan, L. A.; Tersteegen, A. ChemMedChem 2015, 10, 1163.
doi: 10.1002/cmdc.201500131 pmid: 26083237 |
|
|
(f) Mendonça Matos, P.; Lewis, W.; Argent, S. P.; Moore, J. C.; Stockman, R. A. Org. Lett. 2020, 22, 2776.
doi: 10.1021/acs.orglett.0c00761 pmid: 26083237 |
|
|
(g) Bär, R.; Langer, L.; Nieger, M.; Bräse, S. Adv. Synth. Catal. 2020, 362, 1356.
doi: 10.1002/adsc.201901453 pmid: 26083237 |
|
| [6] |
Johnson, C. R.; Janiga, E. R. J. Am. Chem. Soc. 1973, 95, 7692.
doi: 10.1021/ja00804a025 |
| [7] |
Moragas, T.; Liffey, R. M.; Regentová, D.; Ward, J.-P. S.; Dutton, J.; Lewis, W.; Stockman, R. A. Angew. Chem., n. Ed. 2016, 55, 10047.
|
| [8] |
Cividino, P.; Verrier, C.; Philouze, C.; Carret, S.; Poisson, J.-F. Adv. Synth. Catal. 2019, 361, 1236.
doi: 10.1002/adsc.201801408 |
| [9] |
Lücking, U.; Boulard, E.; Zibulski, V.; Lienau, P.; Oertel, L.; Schaefer, M.; Ganzer, U. Chem.-Eur. J. 2020, 26, 4378.
doi: 10.1002/chem.201905461 pmid: 31961028 |
| [10] |
Aota, Y.; Maeda, Y.; Kano, T.; Maruoka, K. Chem.-Eur. J. 2019, 25, 15755.
doi: 10.1002/chem.201904501 |
| [11] |
Zhang, D.; Wang, H.; Cheng, H.; Hernández, J. G.; Bolm, C. Adv. Synth. Catal. 2017, 359, 4274.
doi: 10.1002/adsc.201701178 |
| [12] |
Ye, W.; Zhang, L.; Ni, C.; Rong, J.; Hu, J. Chem. Commun. 2014, 50, 10596.
doi: 10.1039/C4CC05042H |
| [13] |
Shen, X.; Hu, J. Eur. J. Org. Chem. 2014, 2014, 4437.
doi: 10.1002/ejoc.201402086 |
| [14] |
(a) He, L; Pian, J. X.; Shi, J. F.; Du, G. F.; Dai, B. Tetrahedron 2014, 70, 2400.
doi: 10.1016/j.tet.2014.02.028 |
|
(b) Pian, J. X.; He, L.; Du, G. F.; Guo, H.; Dai, B. J. Org. Chem. 2014, 79, 5820.
doi: 10.1021/jo5003399 |
|
|
(c) Liu, K.; Liu, L. L.; Gu, C. Z.; Dai, B.; He, L. RSC Adv. 2016, 6, 33606.
doi: 10.1039/C6RA02128J |
|
|
(d) He, L.; Pian, J. X.; Zhang, J.; Li, Y. Z. Chin. Chem. Lett. 2012, 23, 1359.
doi: 10.1016/j.cclet.2012.11.008 |
|
|
(e) Liu, L. L.; Li, Z. J.; Gu, C. Z.; He, L.; Dai, B. J. Saudi Chem. Soc. 2017, 21, 458.
doi: 10.1016/j.jscs.2016.09.002 |
|
|
(f) Jian, H.; Liu, K.; Wang, W. H.; Li, Z. J.; Dai, B.; He, L. Tetrahedron Lett. 2017, 58, 1137.
|
|
|
(g) Li, Z. J.; Jian, H.; Wang, W. H.; Wang, Q.; He, L. Chin. J. Org. Chem. 2018, 38, 2045. (in Chinese)
doi: 10.6023/cjoc201802003 |
|
|
(李志娟, 翦辉, 王伟华, 王强, 何林, 有机化学, 2018, 38, 2045.)
doi: 10.6023/cjoc201802003 |
|
|
(h) Li, W. J.; Luo, X. S.; Guo, L.; He, L.; Dai, B.; Guo, X. H. J. Shihezi Univ. (Nat. Sci.) 2017, 35, 273. (in Chinese)
|
|
|
(李文娟, 骆学松, 郭亮, 何林, 代斌, 郭旭红, 石河子大学学报, 2017, 35, 273.)
|
|
| [15] |
(a) Liu, Z. J.; Liu, J. T. Chem. Commun. 2008, 5233.
|
|
(b) Sanz-Marco, A.; Blay, G.; Muñoz, M. C.; Pedro, J. R. Chem. Commun. 2015, 51, 8958.
doi: 10.1039/C5CC01676B |
|
| [16] |
Guo, T. F.; Shi, X. Y.; Gao, X. W.; Liu, X. M. J. Environ. Entomol. 2014, 36, 388. (in Chinese)
|
|
(郭天凤, 史雪岩, 高希武, 刘晓宁, 环境昆虫学报, 2014, 36, 388.)
|
|
| [17] |
Zhou, Y. T. M.S. Thesis, Shihezi University, 2019. (in Chinese)
|
|
(周月婷, 硕士论文, 石河子大学, 2019.)
|
| [1] | 刘敏, 杨冬燕, 肖玉梅, 苏旺苍, 赵峰海, 覃兆海. 5-硝基亚氨基[1,4-2H]-1,2,4-三唑啉烯式吡虫啉类似物的合成及生物活性研究[J]. 有机化学, 2023, 43(8): 2790-2799. |
| [2] | 张紫婵, 孙洋, 华晟, 徐宝琳, 张敏, 赵勤, 郑丹丹, 王杨, 鞠剑峰, 石玉军, 戴红. 新型含异噁唑单元的吡唑酰胺类衍生物的合成及杀虫活性[J]. 有机化学, 2023, 43(4): 1435-1443. |
| [3] | 汪蕾, 于淑晶, 杨娜, 王宝雷. 新型含二氢喹唑啉酮的咖啡因衍生物的合成及生物活性研究[J]. 有机化学, 2023, 43(1): 299-307. |
| [4] | 王文鹏, 杨春红, 刘海超, 王喜存, 权正军. 温和条件下苯炔与2-羟基嘧啶加成合成2-芳氧基嘧啶类衍生物[J]. 有机化学, 2022, 42(11): 3835-3842. |
| [5] | 陈澍, 邵莹莹, 付欣豪, 陈庆悟, 杜晓华, 谭成侠. 吡啶联噻唑双酰胺类化合物的设计、合成及杀虫活性[J]. 有机化学, 2022, 42(11): 3870-3879. |
| [6] | 代阿丽, 张仁凤, 李传会, 余利娇, 王娅, 吴剑. 含三氟甲基吡啶酰胺结构的N-氰基磺酰亚胺衍生物的合成及生物活性[J]. 有机化学, 2021, 41(9): 3633-3642. |
| [7] | 何凤, 郭声鑫, 代阿丽, 张仁凤, 吴剑. 含三氟甲基吡啶结构的酰胺类衍生物的合成、表征及生物活性研究[J]. 有机化学, 2021, 41(8): 3303-3311. |
| [8] | 姚阳意, 任朝丽, 陈丽, 钟良坤, 许天明, 谭成侠. 含芳基三氮唑结构的3-乙砜基吡啶类化合物的合成及杀虫活性研究[J]. 有机化学, 2021, 41(5): 2055-2062. |
| [9] | 刘航, 张舒昀, 李欢, 张燕, 李正名, 王宝雷. 8-[(3,4,4-三氟丁-3-烯-1-基)硫基]取代的新型甲基黄嘌呤及其衍生物的合成和生物活性[J]. 有机化学, 2021, 41(5): 2091-2098. |
| [10] | 谢伟彬, 李焕功, 孟祥德, 李正名, 周莎. 新型含N-七氟异丙基苯基吡唑的邻甲酰氨基苯甲酰胺类化合物的设计合成以及生物活性研究[J]. 有机化学, 2021, 41(4): 1722-1727. |
| [11] | 闫强, 范荣, 刘斌斌, 苏帅松, 王勃, 姚团利, 谭嘉靖. 苯炔参与的去芳构化反应研究进展[J]. 有机化学, 2021, 41(2): 455-470. |
| [12] | 张舒昀, 刘航, 汪蕾, 李正名, 王宝雷. 新型含取代哌嗪的咖啡因衍生物的合成、结构表征及生物活性研究[J]. 有机化学, 2021, 41(10): 4075-4082. |
| [13] | 罗春艳, 马文静, 吕亮, 庞怀林, 相君成, 周丽琪, 尹笃林, 刘吉永. 新型含环丙基的间二酰胺类化合物的合成及其杀虫活性[J]. 有机化学, 2020, 40(9): 2963-2970. |
| [14] | 张景朋, 杨朝凯, 秦耀果, 杨新玲. 含1,2,3-噻二唑环(E)-β-farnesene类似物的设计、合成及生物活性研究[J]. 有机化学, 2020, 40(9): 2971-2979. |
| [15] | 赵宇, 刘鑫磊, 李益豪, 许磊川, 苏彦豪, 蒋家珍, 王明安. (E)-3-(1-亚胺基乙基)-5,5-二取代-4-甲氨基呋喃-2(5H)-酮的合成及其意外的杀虫活性[J]. 有机化学, 2020, 40(8): 2547-2554. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||