有机化学 ›› 2023, Vol. 43 ›› Issue (7): 2553-2560.DOI: 10.6023/cjoc202209009 上一篇 下一篇
研究论文
收稿日期:2022-09-09
修回日期:2022-12-14
发布日期:2023-02-06
通讯作者:
傅滨
基金资助:
Rongchao Lei, Wenjie Lan, Mengzhu Li, Bin Fu( )
)
Received:2022-09-09
Revised:2022-12-14
Published:2023-02-06
Contact:
Bin Fu
Supported by:文章分享
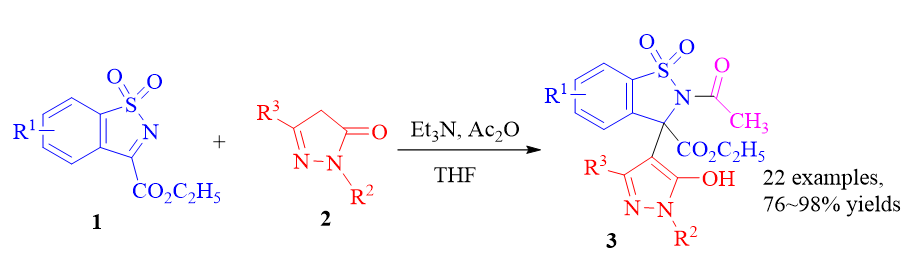
报道了一种碱调节的快速合成苯并磺内酰胺联吡唑化合物的方法. 在三乙胺和乙酸酐存在下, 苯并磺内酰亚胺与吡唑-5-酮能够顺利地进行Mannich反应, 并以高收率得到加成产物. 推测了可能的反应机理, 反应放大到克级规模, 同样能够以高收率获得产物.
雷容超, 兰文捷, 李梦竹, 傅滨. 苯并磺内酰胺联吡唑化合物的简便合成[J]. 有机化学, 2023, 43(7): 2553-2560.
Rongchao Lei, Wenjie Lan, Mengzhu Li, Bin Fu. A Convenient Approach to Benzosultam-Linked Pyrazole Compounds[J]. Chinese Journal of Organic Chemistry, 2023, 43(7): 2553-2560.
| Entry | Solvent | Base | T/℃ | Yield/% |
|---|---|---|---|---|
| 1 | CHCl3 | Et3N | r.t. | 52 |
| 2 | CH2Cl2 | Et3N | r.t. | 48 |
| 3 | Et2O | Et3N | r.t. | 65 |
| 4 | CH3CO2Et | Et3N | r.t. | 41 |
| 5 | Toluene | Et3N | r.t. | 44 |
| 6 | THF | Et3N | r.t. | 98 |
| 7 | THF | Na2CO3 | r.t. | 60 |
| 8 | THF | K2CO3 | r.t. | 40 |
| 9 | THF | Cs2CO3 | r.t. | 41 |
| 10 | THF | NaOH | r.t. | 30 |
| 11 | THF | MeONa | r.t. | 30 |
| 12 | THF | Pyridine | r.t. | 62 |
| 13 | THF | DIEPA | r.t. | 75 |
| 14 | THF | Et3N | 0 | 93 |
| 15 | THF | Et3N | 35 | 83 |
| Entry | Solvent | Base | T/℃ | Yield/% |
|---|---|---|---|---|
| 1 | CHCl3 | Et3N | r.t. | 52 |
| 2 | CH2Cl2 | Et3N | r.t. | 48 |
| 3 | Et2O | Et3N | r.t. | 65 |
| 4 | CH3CO2Et | Et3N | r.t. | 41 |
| 5 | Toluene | Et3N | r.t. | 44 |
| 6 | THF | Et3N | r.t. | 98 |
| 7 | THF | Na2CO3 | r.t. | 60 |
| 8 | THF | K2CO3 | r.t. | 40 |
| 9 | THF | Cs2CO3 | r.t. | 41 |
| 10 | THF | NaOH | r.t. | 30 |
| 11 | THF | MeONa | r.t. | 30 |
| 12 | THF | Pyridine | r.t. | 62 |
| 13 | THF | DIEPA | r.t. | 75 |
| 14 | THF | Et3N | 0 | 93 |
| 15 | THF | Et3N | 35 | 83 |
| Entry | R2 | R3 | Product | Yield/% |
|---|---|---|---|---|
| 1 | 2-MeC6H4 | Ph | 3ab | 94 |
| 2 | 2-CF3C6H4 | Ph | 3ac | 85 |
| 3 | 3-MeC6H4 | Ph | 3ad | 82 |
| 4 | 3-FC6H4 | Ph | 3ae | 98 |
| 5 | 4-MeOC6H4 | Ph | 3af | 96 |
| 6 | 4-BrC6H4 | Ph | 3ag | 91 |
| 7 | Naphthyl | Ph | 3ah | 87 |
| 8 | Ph | 4-MeC6H4 | 3ai | 98 |
| 9 | Ph | 4-ClC6H4 | 3aj | 87 |
| 10 | Ph | 3-MeOC6H4 | 3ak | 82 |
| 11 | Ph | 3-BrC6H4 | 3al | 82 |
| 12 | Ph | 2-FC6H4 | 3am | 92 |
| 13 | Ph | Cyclohexyl | 3an | 90 |
| 14 | Ph | H | 3ao | — |
| Entry | R2 | R3 | Product | Yield/% |
|---|---|---|---|---|
| 1 | 2-MeC6H4 | Ph | 3ab | 94 |
| 2 | 2-CF3C6H4 | Ph | 3ac | 85 |
| 3 | 3-MeC6H4 | Ph | 3ad | 82 |
| 4 | 3-FC6H4 | Ph | 3ae | 98 |
| 5 | 4-MeOC6H4 | Ph | 3af | 96 |
| 6 | 4-BrC6H4 | Ph | 3ag | 91 |
| 7 | Naphthyl | Ph | 3ah | 87 |
| 8 | Ph | 4-MeC6H4 | 3ai | 98 |
| 9 | Ph | 4-ClC6H4 | 3aj | 87 |
| 10 | Ph | 3-MeOC6H4 | 3ak | 82 |
| 11 | Ph | 3-BrC6H4 | 3al | 82 |
| 12 | Ph | 2-FC6H4 | 3am | 92 |
| 13 | Ph | Cyclohexyl | 3an | 90 |
| 14 | Ph | H | 3ao | — |
| [1] |
Takeuchi, Y.; Liu, Z. Heterocycles 2002, 56, 693.
doi: 10.3987/REV-01-SR(K)3 |
| [2] |
Mao, J.; Baker, D. C. US 6458962, 2003.
|
| [3] |
(a) Castro Pineiro, J. L.; Collins, I. J.; Harrison, T. US 20050014369, 2005.
|
|
(b) Supuran, C. T.; Casini, A.; Scozzafava, A. Med. Res. Rev. 2003, 23, 535
doi: 10.1002/(ISSN)1098-1128 |
|
| [4] |
(a) Zhang, H.; Sun, M.-C.; Yin, L.-M.; Wei, D. H.; Song, M.-P.; Yang, D. D.; Niu, J.-L. Org. Chem. Front. 2021, 8, 6888.
doi: 10.1039/D1QO01235E pmid: 21894896 |
|
(b) Li, R.-L.; Fang, Q.-Y.; Li, M.-Y.; Wang, X.-S.; Zhao, L.-M. Chem. Commun. 2021, 57, 11322.
doi: 10.1039/D1CC04179G pmid: 21894896 |
|
|
(c) Majumdar, K. C.; Shovan, M. Chem. Rev. 2011, 111, 7749.
doi: 10.1021/cr1003776 pmid: 21894896 |
|
| [5] |
(a) Sun, R.; Qiu, Z. X.; Cao, G. R.; Teng, D. W. Tetrahedron 2020, 76, 131201.
doi: 10.1016/j.tet.2020.131201 pmid: 23298148 |
|
(b) Nishimura, T.; Noishiki, A.; Tsui, G. C.; Hayashi, T. J. Am. Chem. Soc. 2012, 134, 5056.
doi: 10.1021/ja300697c pmid: 23298148 |
|
|
(c) Wang, H.; Jiang, T.; Xu, M.-H. J. Am. Chem. Soc. 2013, 135, 971.
doi: 10.1021/ja3110818 pmid: 23298148 |
|
|
(d) Qiao, B.; Huang, Y.-J.; Nie, J.; Ma, J.-A. Org. Lett. 2015, 17, 4608.
doi: 10.1021/acs.orglett.5b02351 pmid: 23298148 |
|
|
(e) Yu, J.-S.; Zhou, J. Org. Chem. Front. 2016, 3, 298.
doi: 10.1039/C5QO00407A pmid: 23298148 |
|
| [6] |
(a) Watanabe, T.; Yuki, S.; Egawa, M.; Nishi, H. J. Pharmacol. Exp. Ther. 1994, 268, 1597.
pmid: 9152402 |
|
(b) Kawai, H.; Nakai, H.; Suga, M.; Yuki, S.; Watanabe, T.; Saito, K. I. J. Pharmacol. Exp. Ther. 1997, 281, 921.
pmid: 9152402 |
|
| [7] |
Wu, T. W.; Zeng, L. H.; Wu, J.; Fung, K. P. Life Sci. 2002, 71, 2249.
doi: 10.1016/S0024-3205(02)01965-3 |
| [8] |
Shiohara, H.; Fujikura, H.; Fushimi, N.; Ito, F.; Isaji, M. WO 2002098893, 2002.
|
| [9] |
(a) Liu, S.; Bao, X.; Wang, B. Chem. Commun. 2018, 54, 11515.
doi: 10.1039/C8CC06196C pmid: 29699396 |
|
(b) Hack, D.; Chauhan, P.; Decker, S. K.; Mizutani, Y.; Raabe, G.; Enders, D. Chem. Commun. 2015, 51, 2266.
doi: 10.1039/C4CC09495F pmid: 29699396 |
|
|
(c) Yetra, S. R.; Mondal, S.; Suresh, E.; Biju, A. Org. Lett. 2015, 17, 1417.
doi: 10.1021/acs.orglett.5b00293 pmid: 29699396 |
|
|
(d) Zheng, Y.; Cui, L.; Wang, Y.; Zhou, Z. J. Org. Chem. 2016, 81, 4340.
doi: 10.1021/acs.joc.6b00196 pmid: 29699396 |
|
|
(e) Chauhan, P.; Mahajan, S.; Kaya, U.; Peuronen, A.; Rissanen, K.; Enders, D. J. Org. Chem. 2017, 82, 705.
pmid: 29699396 |
|
|
(f) Maity, R.; Gharui, C.; Sil, A. K.; Pan, S. C. Org. Lett. 2017, 19, 662.
doi: 10.1021/acs.orglett.6b03823 pmid: 29699396 |
|
|
(g) Cheng, C., Zhang, J.; Wang, X.; Miao, Z. J. Org. Chem. 2018, 83, 5450.
doi: 10.1021/acs.joc.8b00352 pmid: 29699396 |
|
|
(h) Vila, C.; Amr, F. I.; Blay, G.; Muňoz, M. C.; Pedro, J. R. Chem.- Asian J. 2016, 11, 1532.
doi: 10.1002/asia.201600325 pmid: 29699396 |
|
|
(i) Rao, K. S.; Ramesh, P.; Trivedi, R.; Kantam, M. L. Tetrahedron Lett. 2016, 57, 1227.
doi: 10.1016/j.tetlet.2016.02.008 pmid: 29699396 |
|
| [10] |
(a) Liao, Y. H.; Chen, W. B.; Wu, Z. J.; Du, X. L.; Cun, L. F.; Zhang, X. M.; Yuan, W. C. Adv. Synth. Catal. 2010, 352, 827.
doi: 10.1002/adsc.200900764 pmid: 27100356 |
|
(b) Meshram, H. M.; Kumar, N. S.; Nanubolu, J. B.; Rao, L. C.; Rao, N. N. Tetrahedron Lett. 2013, 54, 5941.
doi: 10.1016/j.tetlet.2013.08.042 pmid: 27100356 |
|
|
(c) Li, J. H.; Du, D. M. Org. Biomol. Chem. 2013, 11, 6215.
doi: 10.1039/c3ob41045e pmid: 27100356 |
|
|
(d) Wang, H.; Wang, Y.; Song, H.; Zhou, Z.; Tang, C. Eur. J. Org. Chem. 2013, 2013, 4844.
doi: 10.1002/ejoc.201300460 pmid: 27100356 |
|
|
(e) Zheng, Y.; Cui, L.; Wang, Y.; Zhou, Z. J. Org. Chem. 2016, 81, 4340.
doi: 10.1021/acs.joc.6b00196 pmid: 27100356 |
|
|
(f) Hack, D.; Dürr, A. B.; Deckers, K.; Chauhan, P.; Seling, N.; Rübenach, L.; Mertens, L.; Raabe, G.; Schoenebeck, F.; Enders, D. Angew. Chem.,Int. Ed. 2016, 55, 1797.
doi: 10.1002/anie.201510602 pmid: 27100356 |
|
|
(g) Rana, N. K.; Jha, R. K.; Joshi, H.; Singh, V. K. Tetrahedron Lett. 2017, 58, 2135.
doi: 10.1016/j.tetlet.2017.04.059 pmid: 27100356 |
|
|
(h) Xu, Y.; Sun, P.; Song, Q.; Lai, X.; Liu, W.; Xia, T.; Huang, Y. Y.; Shen, Y. Eur. J. Org. Chem. 2017, 2017, 2998.
pmid: 27100356 |
|
| [11] |
(a) Gogoi, S.; Zhao, C. G.; Ding, D. Org. Lett. 2009, 11, 2249.
doi: 10.1021/ol900538q pmid: 26942717 |
|
(b) Alba, A. N.; Zea, A.; Valero, G.; Calbet, T.; Font-Bardía, M.; Mazzanti, A.; Moyano, A.; Rios, R. Eur. J. Org. Chem. 2011, 2011, 1318.
doi: 10.1002/ejoc.v2011.7 pmid: 26942717 |
|
|
(c) Enders, D.; Grossmann, A.; Gieraths, B.; Düzdemir, M.; Merkens, C. Org. Lett. 2012, 14, 4254.
doi: 10.1021/ol301983f pmid: 26942717 |
|
|
(d) Li, J. H.; Du, D. M. RSC Adv. 2014, 4, 14538.
doi: 10.1039/c3ra45974h pmid: 26942717 |
|
|
(e) Yetra, S. R.; Mondal, S.; Suresh, E.; Biju, A. T. Org. Lett. 2015, 17, 1417.
doi: 10.1021/acs.orglett.5b00293 pmid: 26942717 |
|
|
(f) Kumarswamyreddy, N.; Kesavan, V. Org. Lett. 2016, 18, 1354.
doi: 10.1021/acs.orglett.6b00287 pmid: 26942717 |
|
| [12] |
Mazzanti, A.; Calbet, T.; Font-Bardia, M.; Moyano, A.; Rios, R. Org. Biomol. Chem. 2012, 10, 1645.
doi: 10.1039/c2ob06553c pmid: 22237869 |
| [13] |
(a) Gogoi, S.; Zhao, C. G. Tetrahedron Lett. 2009, 50, 2252.
doi: 10.1016/j.tetlet.2009.02.210 |
|
(b) Xie, J.; Xing, X. Y.; Sha, F.; Wu, Z. Y.; Wu, X. Y. Org. Biomol. Chem. 2016, 14, 8346.
doi: 10.1039/C6OB01256F |
|
| [14] |
(a) Keyume, A.; Esmayil, Z.; Wang, L. J.; Jun, F. Tetrahedron 2014, 70, 3976.
doi: 10.1016/j.tet.2014.04.088 |
|
(b) Fan, W.-T.; Yang, X.-P.; Yang, H.-P.; Lv, H.-P.; Wang, X.-W.; Wang, Z. Org. Lett. 2020, 22, 3936.
doi: 10.1021/acs.orglett.0c01221 |
|
|
(c) Bao, X. Z.; Wei, S.-Q.; Qu, J.-P.; Wang, B. M. Chem. Commun. 2018, 54, 2028.
doi: 10.1039/C8CC00154E |
|
|
(d) Li, L.; Liu, Z.-T.; Hu, X.-P. Chem. Commun. 2018, 54, 12033.
doi: 10.1039/C8CC05706K |
|
|
(e) Ni, C. J.; Tong, X. F. J. Am. Chem. Soc. 2016, 138, 7872.
doi: 10.1021/jacs.6b04935 |
|
| [15] |
(a) Feng, J.; Ablajan, K.; Sali, A. Tetrahedron 2014, 70, 484.
doi: 10.1016/j.tet.2013.11.019 |
|
(b) Tan, C.-Y.; Lu, H.; Zhang, J.-L.; Liu, J.-Y.; Xu, P.-F. J. Org. Chem. 2020, 85, 594.
doi: 10.1021/acs.joc.9b02684 |
|
|
(c) Xu, Y.-W.; Li, L.; Hu, X.-P. Org. Lett. 2020, 22, 9534.
doi: 10.1021/acs.orglett.0c03587 |
|
|
(d) Tang, C.-K.; Zhou, Z.-Y.; Xia, A.-B.; Bai, L.; Liu, J.; Xu, D.-Q.; Xu, Z.-Y. Org. Lett. 2018, 20, 5840.
doi: 10.1021/acs.orglett.8b02525 |
|
|
(e) Kale, S. B.; Jori, P. K.; Thatikonda, T.; Gonnade, R. G.; Das, U. Org. Lett. 2019, 21, 7736.
doi: 10.1021/acs.orglett.9b02641 |
|
|
(f) Hack, D.; Dürr, A. B.; Deckers, K.; Chauhan, P.; Seling, N.; Rüenach, L.; Mertens, L.; Raabe, G.; Schoenebeck, F.; Enders, D. Angew. Chem., nt. Ed. 2016, 55, 1797.
|
|
| [16] |
(a) Lan, W. J.; Lei, R. C.; Luo, J. Y.; Qin, Z. H.; Fu, B.; Xie, L. ChemistrySelect 2022, 7, 3670.
|
|
(b) Xie, L.; Ma, H.-L; Li, J.-Q.; Yu, X.; Qin, Z. H.; Fu, B. Org. Chem. Front. 2017, 4, 1858.
doi: 10.1039/C7QO00370F |
|
| [17] |
(a) Li, S.-W.; Wan, Q.; Kang, Q. Org. Lett. 2018, 20, 1312.
doi: 10.1021/acs.orglett.8b00040 pmid: 31657819 |
|
(b) Sharma, A.; Sharma, V.; Chimni, S. S. Org. Biomol. Chem. 2019, 17, 9514.
doi: 10.1039/c9ob01700c pmid: 31657819 |
|
| [18] |
Yan, Z.; Wu, B.; Gao, X.; Chen, M. W.; Zhou, Y. G. Org. Lett. 2016, 18, 692.
doi: 10.1021/acs.orglett.5b03664 |
| [19] |
(a) Branä, M. F.; Gradillas, A.; Ovalles, A. G.; Lopez, B.; Acero, N.; Llinares, F.; Mingarro, D. M. Bioorg. Med. Chem. 2006, 14, 9.
doi: 10.1016/j.bmc.2005.09.059 |
|
(b) Wang, X.-j.; Tan, J.; Grozinger, K. Tetrahedron Lett. 2000, 41, 4713.
|
| [1] | 马虎, 黄丹凤, 王克虎, 唐朵朵, 冯杨, 任园园, 王君娇, 胡雨来. 3-(三氟甲基)吡唑类化合物的合成[J]. 有机化学, 2023, 43(9): 3257-3267. |
| [2] | 许晓萍, 张翼飞, 莫小渝, 江俊. 铑催化3-重氮吲哚-2-亚胺与吡唑啉酮的C—H官能团化反应制备3-吡唑基吲哚[J]. 有机化学, 2023, 43(7): 2519-2527. |
| [3] | 孙洋, 王杨, 张紫婵, 钱烨, 骆桂成, 周贝贝, 缪丽沙, 陈雨蝶, 戴红, 徐宝琳, 吴正光. 新型含1,3,4-噁二唑基团的吡唑肟衍生物的合成与生物活性[J]. 有机化学, 2023, 43(4): 1584-1590. |
| [4] | 张紫婵, 孙洋, 华晟, 徐宝琳, 张敏, 赵勤, 郑丹丹, 王杨, 鞠剑峰, 石玉军, 戴红. 新型含异噁唑单元的吡唑酰胺类衍生物的合成及杀虫活性[J]. 有机化学, 2023, 43(4): 1435-1443. |
| [5] | 桑田, 贾帆, 何静, 李春天, 刘岩, 刘平. I2催化β-酮腈与1H-吡唑-5-胺的环化反应[J]. 有机化学, 2023, 43(1): 195-201. |
| [6] | 马豪杰, 周风院, 刘金磊, 韩波, 杨华, 张玉琦, 王记江. 无催化剂和无添加剂条件下分子间环化构建取代N-苯基吡唑[J]. 有机化学, 2022, 42(6): 1843-1848. |
| [7] | 王长凯, 孙腾达, 张学博, 杨新玲, 路星星, 徐欢, 石发胜, 张莉, 凌云. 新型含氟吡唑酰肼类化合物的设计合成与生物活性研究[J]. 有机化学, 2022, 42(5): 1527-1536. |
| [8] | 王伟, 武复冉, 马一丹, 徐丹, 徐功. 含取代吡唑新型苯甲酰胺类化合物的合成及抗真菌活性研究[J]. 有机化学, 2022, 42(2): 607-618. |
| [9] | 穆思宇, 李红霞, 伍智林, 彭俊梅, 陈锦杨, 何卫民. 电催化肼、丙二酮和2-溴丙二酸二乙酯三组分合成4-溴吡唑[J]. 有机化学, 2022, 42(12): 4292-4299. |
| [10] | 冯易浇, 何静, 韦玥婷, 汤婷, 李春天, 刘平. 一锅两步策略高效合成3-芳基-4-(芳硫基)-1H-吡唑-5-胺衍生物[J]. 有机化学, 2022, 42(1): 226-234. |
| [11] | 刘云姝, 赵国栋, 武文菊, 王云泽, 喻艳超, 由君, 刘波. 镁-双噁唑啉络合物催化3,5-二甲基-N-α,β-不饱和酰基吡唑的不对称共轭氰化反应研究[J]. 有机化学, 2022, 42(1): 208-217. |
| [12] | 马豪杰, 周小强, 韩波, 李然, 侯雪艳, 姬星月, 张玉琦, 黄国生, 王记江. 无催化剂一锅法构建取代磺酰吡唑[J]. 有机化学, 2021, 41(9): 3710-3716. |
| [13] | 苏子琦, 张奇, 赵界强, 赵涛, 刘文艺, 王慧萍, 徐娟, 李加荣. 水介质中1H-吡唑并[3,4-d]嘧啶-4(5H)-酮的快捷高效合成[J]. 有机化学, 2021, 41(9): 3701-3709. |
| [14] | 马姣丽, 郭鹏虎, 李静, 廖新成, 程辉成. 含1,3,4-噻二唑和吡唑的酰胺衍生物的合成和抗肿瘤活性研究[J]. 有机化学, 2021, 41(8): 3214-3222. |
| [15] | 许萌, 高燊原, 曾源煦, 高安慧, 高立信, 许磊, 周宇波, 高建荣, 叶青, 李佳. 3-(吲哚-3-基)-4-(吡唑并[3,4-c]哒嗪-3-基)马来酰亚胺脱氢类异柠檬酸酶-1突变体高效抑制剂的合成与评价[J]. 有机化学, 2021, 41(5): 1991-2000. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||