有机化学 ›› 2024, Vol. 44 ›› Issue (4): 1327-1336.DOI: 10.6023/cjoc202307015 上一篇 下一篇
研究论文
收稿日期:2023-07-15
修回日期:2023-09-12
发布日期:2023-11-23
基金资助:
Guodong Jua, Guangyu Zhoua, Yingsheng Zhaoa,b( )
)
Received:2023-07-15
Revised:2023-09-12
Published:2023-11-23
Contact:
E-mail: Supported by:文章分享

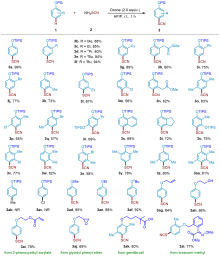
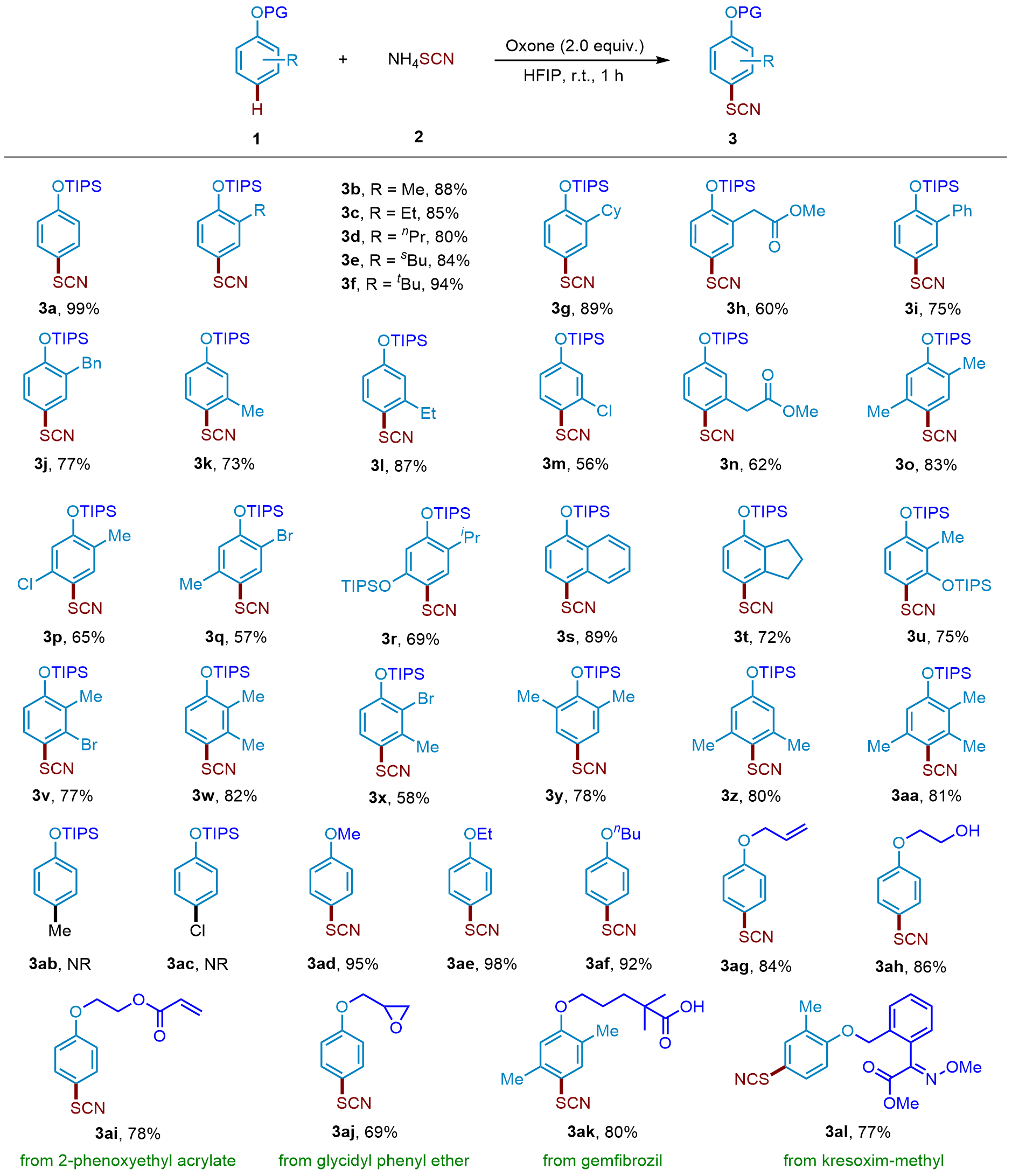
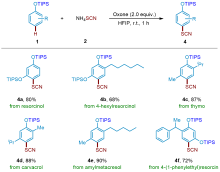
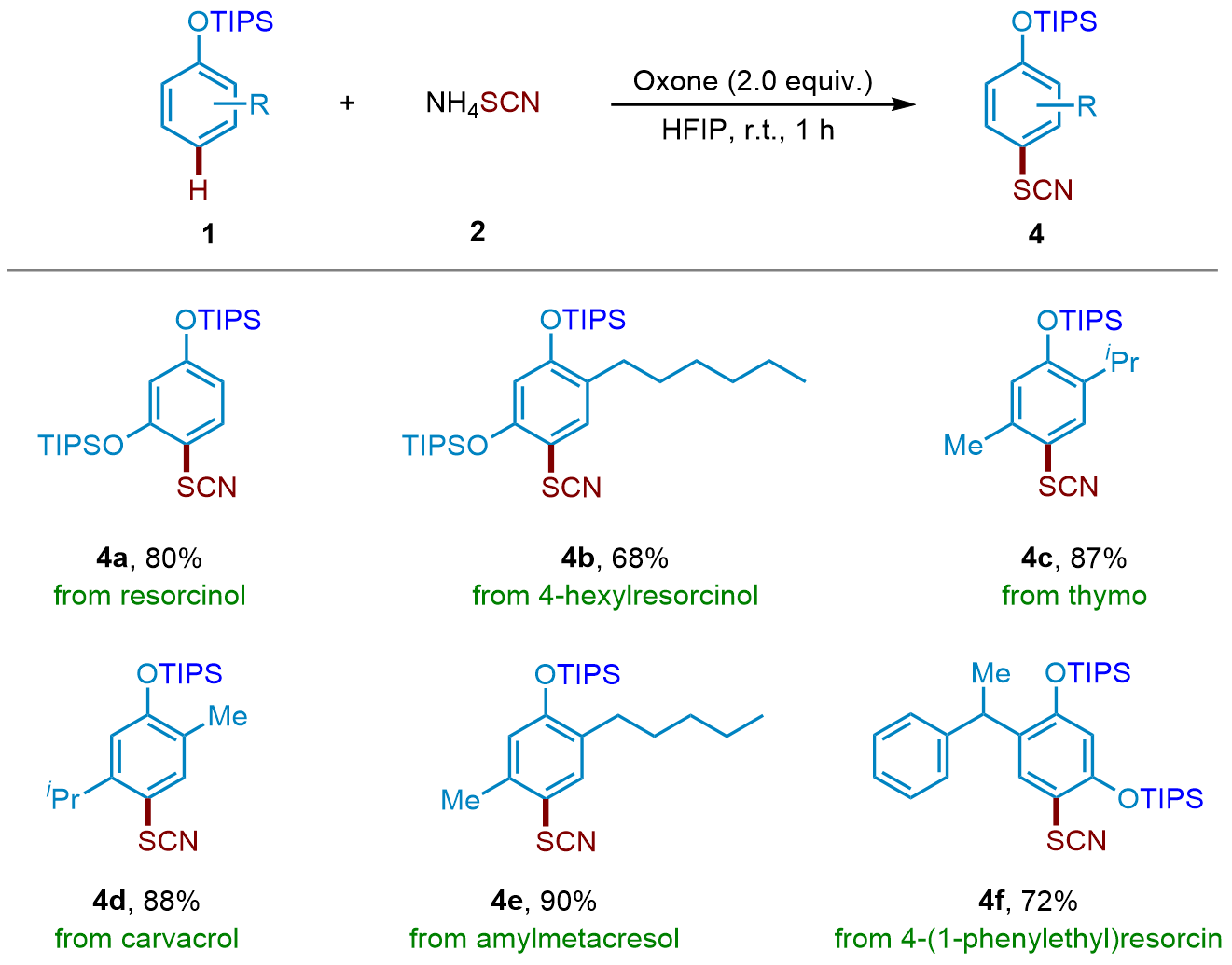
芳基硫氰酸酯化合物在有机化学中非常重要, 广泛存在于农用化学品、药品和材料中. 以NH4SCN为硫氰化试剂, 过氧单磺酸钾/(2KHSO5•KHSO4•K2SO4, oxone)为氧化剂, 实现了三异丙基硅烷(TIPS)保护的苯酚衍生物无过渡金属催化区域选择性硫氰化反应. 在温和的反应条件下, 以良好至优异的收率实现了转化, 并且多种官能团对反应条件都有良好的耐受性. 该方法的实用性在麝香草酚、戊甲酚和苯乙基间苯二酚等生物活性分子的硫氰化反应中得到了很好的体现.
鞠国栋, 周冠宇, 赵应声. 三异丙基硅烷(TIPS)保护苯酚的无过渡金属催化区域选择性硫氰化反应[J]. 有机化学, 2024, 44(4): 1327-1336.
Guodong Ju, Guangyu Zhou, Yingsheng Zhao. Transition-Metal-Free Regioselective Thiocyanation of Triisopropylsilane (TIPS)-Protected Phenols[J]. Chinese Journal of Organic Chemistry, 2024, 44(4): 1327-1336.
| Entry | Oxidant | Solvent | [SCN] source | Yield/% |
|---|---|---|---|---|
| 1 | Oxone | HFIP | KSCN | 92 |
| 2 | Oxone | HFIP | AgSCN | NR |
| 3 | Oxone | HFIP | NH4SCN | 99 |
| 4 | K2S2O8 | HFIP | NH4SCN | 86 |
| 5 | H2O2 | HFIP | NH4SCN | 83 |
| 6 | O2 | HFIP | NH4SCN | Trace |
| 7 | TBHP | HFIP | NH4SCN | NR |
| 8 | Oxone | H2O | NH4SCN | NR |
| 9 | Oxone | DCE | NH4SCN | NR |
| 10 | Oxone | EtOH | NH4SCN | NR |
| 11 | Oxone | DMSO | NH4SCN | NR |
| 12 | Oxone | DMF | NH4SCN | NR |
| 13 | Oxone | Dioxane | NH4SCN | NR |
| 14 | Oxone | THF | NH4SCN | NR |
| 15 | Oxone | CH3CN | NH4SCN | NR |
| 16 | — | HFIP | NH4SCN | NR |
| Entry | Oxidant | Solvent | [SCN] source | Yield/% |
|---|---|---|---|---|
| 1 | Oxone | HFIP | KSCN | 92 |
| 2 | Oxone | HFIP | AgSCN | NR |
| 3 | Oxone | HFIP | NH4SCN | 99 |
| 4 | K2S2O8 | HFIP | NH4SCN | 86 |
| 5 | H2O2 | HFIP | NH4SCN | 83 |
| 6 | O2 | HFIP | NH4SCN | Trace |
| 7 | TBHP | HFIP | NH4SCN | NR |
| 8 | Oxone | H2O | NH4SCN | NR |
| 9 | Oxone | DCE | NH4SCN | NR |
| 10 | Oxone | EtOH | NH4SCN | NR |
| 11 | Oxone | DMSO | NH4SCN | NR |
| 12 | Oxone | DMF | NH4SCN | NR |
| 13 | Oxone | Dioxane | NH4SCN | NR |
| 14 | Oxone | THF | NH4SCN | NR |
| 15 | Oxone | CH3CN | NH4SCN | NR |
| 16 | — | HFIP | NH4SCN | NR |
| [1] |
(a) Popoff I. C.; Engle A. R.; Whitaker R. L.; Shinghal G. H. J. Med. Chem. 1971, 14, 1166.
pmid: 25775431 |
|
(b) De Martino G.; Edler M. C.; La Regina G.; Coluccia A.; Barbera M. C.; Barrow D.; Nicholson R. I.; Chiosis G.; Brancale A.; Hamel E.; Artico M.; Silvestri R. J. Med. Chem. 2006, 49, 947.
doi: 10.1021/jm050809s pmid: 25775431 |
|
|
(c) Bagley M. C.; Davis T.; Dix M. C.; Fusillo V.; Pigeaux M.; Rokicki M. J.; Kipling D. J. Org. Chem. 2009, 74, 8336.
doi: 10.1021/jo9017155 pmid: 25775431 |
|
|
(d) Pawliczek M.; Garve L. K. B.; Werz D. B. Org. Lett. 2015, 17, 1716.
doi: 10.1021/acs.orglett.5b00494 pmid: 25775431 |
|
| [2] |
(a) Castanheiro T.; Suffert J.; Donnard M.; Gulea M. Chem. Soc. Rev. 2016, 45, 494.
doi: 10.1039/c5cs00532a pmid: 26658383 |
|
(b) Piña I. C.; Gautschi J. T.; Wang G.-Y.; Sanders M. L.; Schmitz F. J.; France D.; Cornell-Kennon S.; Sambucetti L. C.; Remiszewski S. W.; Perez L. B.; Bair K. W.; Crews P. J. Org. Chem. 2003, 68, 3866.
doi: 10.1021/jo034248t pmid: 26658383 |
|
| [3] |
Vaghasiya B. K.; Satasia S. P.; Thummar R. P.; Kamani R. D.; Avalani J. R.; Sapariya N. H.; Raval D. K. J. Sulfur Chem. 2018, 39, 507.
doi: 10.1080/17415993.2018.1469632 |
| [4] |
Danoun G.; Bayarmagnai B.; Gruenberg M. F.; Goossen L. J. J. Chem. Sci. 2014, 5, 1312.
|
| [5] |
Chen J.; Wang T.; Wang T.; Lin A.; Yao H.; Xu J. Org. Chem. Front. 2017, 4, 130.
doi: 10.1039/C6QO00590J |
| [6] |
Zhang T.; Deng G.; Li H.; Liu B.; Tan Q.; Xu B. Org. Lett. 2018, 20, 5439.
doi: 10.1021/acs.orglett.8b02347 pmid: 30106302 |
| [7] |
Yang L.; Tian Z.-Y.; Zhang C.-P. ChemistrySelect 2019, 4, 311.
doi: 10.1002/slct.v4.1 |
| [8] |
Segalovich-Gerendash G.; Rozenberg I.; Alassad N.; Nechmad N. B.; Goldberg I.; Kozuch S.; Lemcoff N. G. ACS Catal. 2020, 10, 4827.
doi: 10.1021/acscatal.0c00676 |
| [9] |
Grieco P. A.; Yokoyama Y.; Williams E. J. Org. Chem. 1978, 43, 12835.
|
| [10] |
Graßl S.; Hamze C.; Koller T. J.; Knochel P. Chem.-Eur. J. 2019, 25, 3752.
doi: 10.1002/chem.v25.15 |
| [11] |
Exner B.; Bayarmagnai B.; Matheis C.; Goossen L. J. J. Fluorine Chem. 2017, 198, 89.
doi: 10.1016/j.jfluchem.2016.12.006 |
| [12] |
Sun N.; H. Zhang, W.; Mo, B.; Hu, X. Synlett 2013, 24, 1443.
doi: 10.1055/s-00000083 |
| [13] |
Uemura S.; Onoe A, Okazaki H.; Okano M. Bull. Chem. Soc. Jpn. 1975, 48, 619.
doi: 10.1246/bcsj.48.619 |
| [14] |
Bacon R. G. R.; Guy R. G. J. Chem. Soc. 1960, 318.
|
| [15] |
Pan X.-Q.; Lei M.-Y.; Zou J.-P.; Zhang W. Tetrahedron Lett. 2009, 50, 347.
|
| [16] |
Kaufmann H. P.; Küchler K. Eur. J. Inorg. Chem. 1934, 67, 944.
|
| [17] |
(a) Fan W.; Yang Q.; Xu F.; Li P. J. Org. Chem. 2014, 79, 10588.
doi: 10.1021/jo5015799 |
|
(b) Mitra S.; Ghosh M.; Mishra S.; Hajra A. J. Org. Chem. 2015, 80, 8275.
doi: 10.1021/acs.joc.5b01369 |
|
|
(c) Zhang Z. G.; Liu X. X.; Zong X. L.; Yuan Y. L.; Liu S. L.; Zhang T.; Wu Z. S.; Yang J. Y. Chin. J. Org. Chem. 2021, 41, 52. (in Chinese)
doi: 10.6023/cjoc202008003 |
|
|
(张振国, 刘笑笑, 宗鑫龙, 苑亚林, 刘双磊, 张婷, 吴子尚, 杨静莹, 有机化学, 2021, 41, 52.)
doi: 10.6023/cjoc202008003 |
|
| [18] |
(a) Lin J.-P.; Zhang F.-H.; Long Y.-Q. Org. Lett. 2014, 16, 2822.
doi: 10.1021/ol500864r |
|
(b) Yang D.; Yan K.; Wei W.; Li G.; Lu S.; Zhao C.; Tian L.; Wang H. J. Org. Chem. 2015, 80, 11073.
|
|
|
(c) Fu Z. J.; Yang Z. J.; Z Sun L.; Yin J.; Yi X. Z.; Cai H.; Lei A. W. Chin. J. Org. Chem. 2022, 42, 600. (in Chinese)
doi: 10.6023/cjoc202107060 |
|
|
(付拯江, 杨振江, 孙丽, 尹健, 伊学政, 蔡琥, 雷爱文, 有机化学, 2022, 42, 600.)
doi: 10.6023/cjoc202107060 |
|
| [19] |
(a) Grant M. S.; Snyder H. R. J. Am. Chem. Soc. 1960, 82, 2742.
doi: 10.1021/ja01496a023 |
|
(b) Nair V.; George T. G.; Nair L. G.; Panicker S. B. Tetrahedron Lett. 1999, 40, 1195.
|
|
|
(c) Yadav J. S.; Reddy B. V. S.; Murali Krishna B. B. Synthesis 2008, 3779.
|
|
|
(d) Toste F. D.; Stefano V. D.; Still I. W. J. Synth. Commun. 1995, 25, 1277.
doi: 10.1080/00397919508012691 |
|
|
(e) Khazaei A.; Zolfigol M. A.; Mokhlesi M.; Pirveysian M. Can. J. Chem. 2012, 90, 427.
doi: 10.1139/v2012-013 |
|
|
(f) Zhang X.; Wang C.; Jiang H.; Sun L. RSC Adv. 2018, 8, 22042.
doi: 10.1039/C8RA04407D |
|
|
(g) Wu D.; Qiu J.; Karmaker P. G.; Yin H.; Chen F.-X. J. Org. Chem. 2018, 83, 1576.
doi: 10.1021/acs.joc.7b02850 |
|
|
(h) Wang Z.; Wang L.; Chen Q.; He M.-Y. Synth. Commun. 2018, 48, 76.
doi: 10.1080/00397911.2017.1390139 |
|
|
(i) Jiang H.; Yu W.; Tang X.; Li J.; Wu W. J. Org. Chem. 2017, 82, 9312.
doi: 10.1021/acs.joc.7b01122 |
|
| [20] |
(a) Mete T. B.; Khopade T. M.; Bhat R. G. T. Tetrahedron Lett. 2017, 58, 415.
doi: 10.1016/j.tetlet.2016.12.043 |
|
(b) Khalili D. New J. Chem. 2016, 40, 2547.
doi: 10.1039/C5NJ02314A |
|
|
(c) Murthy Y. L. N.; Govindh B.; Diwakar B. S.; Nagalakshmi K.; Venu R. J. Iran. Chem. Soc. 2011, 8, 292.
doi: 10.1007/BF03246227 |
|
|
(g) Khalili D. Chin. Chem. Lett. 2015, 26, 547.
doi: 10.1016/j.cclet.2015.01.007 |
|
|
(h) Wu G.; Liu Q.; Shen Y.; Wu W.; Wu L. Tetrahedron Lett. 2005, 46, 5831.
doi: 10.1016/j.tetlet.2005.06.132 |
|
|
(i) Yadav J. S.; Reddy B. V. S.; Shubashree S.; Sadashiv K. Tetrahedron Lett. 2004, 45, 2951.
doi: 10.1016/j.tetlet.2004.02.073 |
|
| [21] |
(a) Prakash O.; Kaur H.; Pundeer R.; Dhillon R. S.; Singh S. P. Synth. Commun. 2003, 33, 4037.
doi: 10.1081/SCC-120026343 pmid: 33403295 |
|
(b) de Oliveira Lima Filho E.; Malvestiti I. ACS Omega 2020, 5, 33329.
doi: 10.1021/acsomega.0c05131 pmid: 33403295 |
|
|
(c) Wang Z.; Wang L.; Chen Q.; He M.-Y. Synth. Commun. 2018, 48, 76.
doi: 10.1080/00397911.2017.1390139 pmid: 33403295 |
|
|
(d) Weng Z.; Wang H.; Wang L. Mendeleev Commun. 2023, 33, 118.
doi: 10.1016/j.mencom.2023.01.037 pmid: 33403295 |
|
| [22] |
(a) Geng J.; Fang Z.; Tu G.; Zhao Y. Chin. Chem. Lett. 2023, 34, 107609.
doi: 10.1016/j.cclet.2022.06.032 |
|
(b) Liu L. L.; Yang S.; Han Y.; Dai C. Y.; Shi D. Q.; Zhao Y. S. Chin. J. Org. Chem. 2020, 40, 2394. (in Chinese)
doi: 10.6023/cjoc202004019 |
|
|
(刘玲玲, 杨闪, 韩昳, 戴晨阳, 史达清, 黄志斌赵应声, 有机化学, 2020, 40, 2394.)
|
|
| [23] |
(a) Gao M.; Vuagnat M.; Chen M.-Y.; Pannecoucke X.; Jubault P.; Besset T. Chem.-Eur. J. 2021, 27, 6145.
doi: 10.1002/chem.v27.20 |
|
(b) Waddell L. J. N.; Senkans M. R.; Sutherland A. J. Org. Chem. 2023, 88, 7208.
doi: 10.1021/acs.joc.3c00454 |
|
| [24] |
Cernak T.; Dykstra K. D.; Tyagarajan S.; Vachal P.; Krska S. W. Chem. Soc. Rev. 2016, 45, 546.
doi: 10.1039/c5cs00628g pmid: 26507237 |
| [25] |
Munusamy S.; Muralidharan V. P.; Iyer S. K. Tetrahedron Lett. 2017, 58, 520.
doi: 10.1016/j.tetlet.2016.12.072 |
| [26] |
(a) Minisci F.; Citterio A.; Giordano C. Acc. Chem. Res. 1983, 16, 27.
doi: 10.1021/ar00085a005 |
|
(b) Hey D. H.; Jones G. H.; Perkins M. J. Chem. Soc., Perkin Trans. 1 1972, 118.
|
|
| [27] |
(a) Wu G.; Liu Q.; Shen Y.; Wu W.; Wu L. Tetrahedron Lett. 2005, 46, 5831.
doi: 10.1016/j.tetlet.2005.06.132 |
|
(b) Ali M.; Zarchi K.; Banihashemi R. Phosphorus, Sulfur Silicon Relat. Elem. 2014, 189, 1378.
doi: 10.1080/10426507.2013.865123 |
|
|
(c) Chen Y.; Chen C.; Liu Y.; Yu L. Chin. Chem. Lett. 2023, 34, 108489.
doi: 10.1016/j.cclet.2023.108489 |
| [1] | 沈都益, 李玲慧, 靳鸽, 梁雨佳, 张欣慧, 公培伟, 张范军, 晁绵冉. 基于单电子转移的黄素仿生光催化氧化研究进展[J]. 有机化学, 2024, 44(4): 1069-1093. |
| [2] | 万云辉, 杨福美, 陈明瀚, 孙德立, 叶丹锋. 无过渡金属催化的N-苄基-N-叔丁氧羰基酰胺与不饱和醇的酯化反应[J]. 有机化学, 2024, 44(4): 1293-1300. |
| [3] | 徐忠荣, 万结平, 刘云云. 基于热、光以及电化学过程的无过渡金属碳-氢键硫氰化和硒氰化反应[J]. 有机化学, 2023, 43(7): 2425-2446. |
| [4] | 孙婧, 张萌萌, 锅小龙, 王琪, 王陆瑶. 无过渡金属条件下二芳基硒化合物的合成[J]. 有机化学, 2023, 43(12): 4251-4260. |
| [5] | 郑煜, 钱沈城, 徐鹏程, 郑斌南, 黄申林. 电化学氧化芳基端炔的硫氰化磺化反应[J]. 有机化学, 2022, 42(12): 4275-4281. |
| [6] | 程辉成, 郭鹏虎, 陈冰, 姚嘉伟, 马姣丽, 胡炜杰, 纪红兵. 二苯并噻吩的合成研究进展[J]. 有机化学, 2021, 41(1): 94-104. |
| [7] | 张龙菲, 牛聪, 杨晓婷, 秦宏云, 杨建静, 文江伟, 王桦. 光、电催化硫氰基化反应研究进展[J]. 有机化学, 2020, 40(5): 1117-1128. |
| [8] | 韩秋燕, 赵成龙, 张成潘. 基于芳基(三氟乙基)三价碘盐的三氟乙基化反应研究进展[J]. 有机化学, 2019, 39(1): 84-94. |
| [9] | 李伟, 杨超, 高国林, 夏吾炯. Na2S2O8促进硫醇的直接硫氰化:一个合成硫氰化合物的实用方法[J]. 有机化学, 2017, 37(2): 480-484. |
| [10] | 于敬阳, 彭进松, 岳亦霞, 赵宇卓, 陈春霞. 无过渡金属催化条件下咪唑衍生物与炔基溴的炔基化反应研究[J]. 有机化学, 2014, 34(7): 1352-1357. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||