有机化学 ›› 2023, Vol. 43 ›› Issue (10): 3623-3634.DOI: 10.6023/cjoc202304034 上一篇 下一篇
所属专题: 有机氟化学虚拟合辑; 有机硅化学专辑-2023
研究论文
收稿日期:2023-05-02
修回日期:2023-06-30
发布日期:2023-07-19
基金资助:
Jiajie Zhu, Yi Wan, Qiyang Yuan, Jinlian Wei( ), Yongqiang Zhang(
), Yongqiang Zhang( )
)
Received:2023-05-02
Revised:2023-06-30
Published:2023-07-19
Contact:
*E-mail: Supported by:文章分享
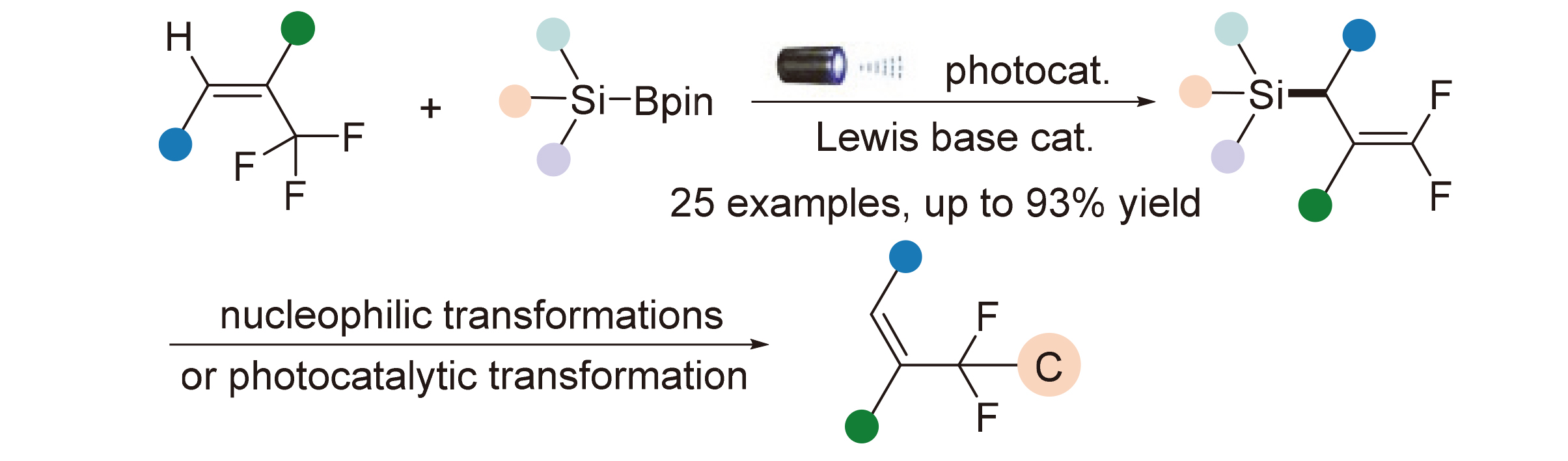
以三氟甲基取代烯烃为底物, 使用硅硼烷为硅自由基供体, 开发了一项可见光/路易斯碱协同催化的脱氟硅化反应新技术, 实现了多样性偕二氟烯丙基硅砌块的绿色高效合成. 新反应以奎宁环为路易斯碱催化剂, 通过其对硅硼键的辅助活化促进硅自由基生成, 表现出绿色温和、体系简单、易于放大、底物适用范围广和官能团兼容性强等优势. 此外, 本研究还初步展示了该类合成砌块在多类型含偕二氟甲基结构单元构建中的应用.
朱佳洁, 万义, 袁启洋, 魏金莲, 张永强. 可见光/路易斯碱协同催化的三氟甲基取代烯烃脱氟硅化反应研究[J]. 有机化学, 2023, 43(10): 3623-3634.
Jiajie Zhu, Yi Wan, Qiyang Yuan, Jinlian Wei, Yongqiang Zhang. Research of Visible Light/Lewis Base Dual Catalytic Defluorinative Silylation of Trifluoromethyl-Substituted Alkenes[J]. Chinese Journal of Organic Chemistry, 2023, 43(10): 3623-3634.

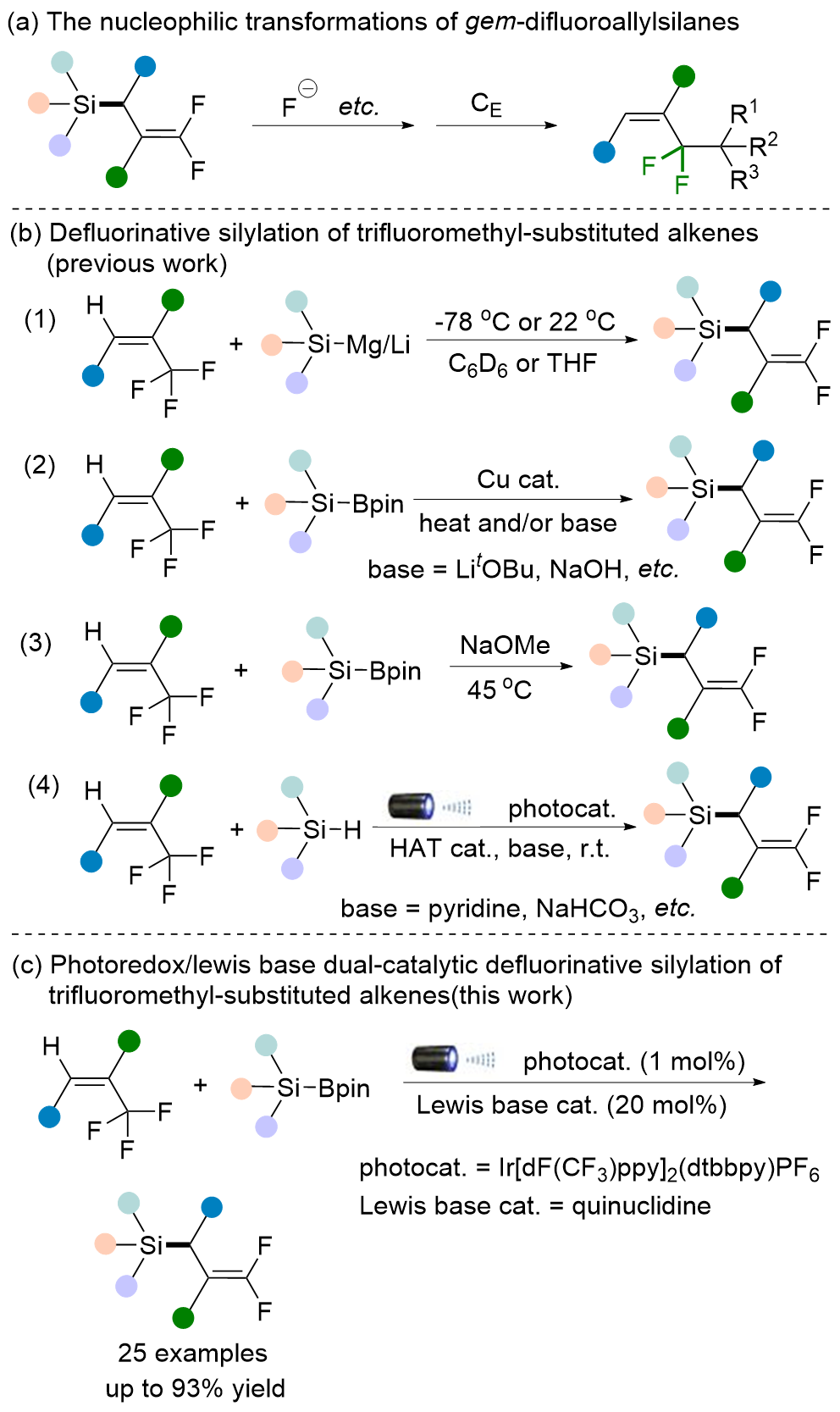
| Entry | Photocat. | Lewis base cat. | Yieldb/% of 3a | 3a/3a' c |
|---|---|---|---|---|
| 1 | P1 | Quinuclidine | 60d | 10∶1 |
| 2 | P1 | Quinuclidine | 90 | >50∶1 |
| 3 | P1 | DMAP | 80 | >50∶1 |
| 4 | P1 | Triphenylphosphine | 54 | >50∶1 |
| 5 | P1 | Quinuclidine | 66e | >50∶1 |
| 6 | P1 | — | 11 | — |
| 7 | P2 | Quinuclidine | 34 | 20∶1 |
| 8 | P3 | Quinuclidine | N.d.f,g | — |
| 9 | P4 | Quinuclidine | 86 | >50∶1 |
| 10 | P5 | Quinuclidine | 86g | >50∶1 |
| 11 | — | Quinuclidine | Trace | — |
| 12 | P1 | Quinuclidine | Traceh | — |
| 13 | P1 | Quinuclidine | 53i | >50∶1 |
| 14 | P1 | Quinuclidine | Tracej | — |
| Entry | Photocat. | Lewis base cat. | Yieldb/% of 3a | 3a/3a' c |
|---|---|---|---|---|
| 1 | P1 | Quinuclidine | 60d | 10∶1 |
| 2 | P1 | Quinuclidine | 90 | >50∶1 |
| 3 | P1 | DMAP | 80 | >50∶1 |
| 4 | P1 | Triphenylphosphine | 54 | >50∶1 |
| 5 | P1 | Quinuclidine | 66e | >50∶1 |
| 6 | P1 | — | 11 | — |
| 7 | P2 | Quinuclidine | 34 | 20∶1 |
| 8 | P3 | Quinuclidine | N.d.f,g | — |
| 9 | P4 | Quinuclidine | 86 | >50∶1 |
| 10 | P5 | Quinuclidine | 86g | >50∶1 |
| 11 | — | Quinuclidine | Trace | — |
| 12 | P1 | Quinuclidine | Traceh | — |
| 13 | P1 | Quinuclidine | 53i | >50∶1 |
| 14 | P1 | Quinuclidine | Tracej | — |
| [1] |
Meanwell N. A. J. Med. Chem. 2011, 54, 2529.
doi: 10.1021/jm1013693 |
| [2] |
Han J.-L.; Remete A. M.; Hagan D.; Dobson L. S.; Kiss L.; Izawa K.; Moriwaki H.; Soloshonok V. A. J. Fluorine Chem. 2020, 239, 109639.
doi: 10.1016/j.jfluchem.2020.109639 |
| [3] |
Inoue M.; Sumii Y.; Shibata N. ACS Omega 2020, 5, 10633.
doi: 10.1021/acsomega.0c00830 |
| [4] |
Zafrani Y.; Moriah G. S.; Yeffet D.; Berliner A.; Amir D.; Marciano D.; Elias S.; Katalan S.; Ashkenazi N.; Madmon M.; Gershonov E.; Saphier S. J. Med. Chem. 2019, 62, 5628.
doi: 10.1021/acs.jmedchem.9b00604 pmid: 31091098 |
| [5] |
Fujita M.; Obayashi M.; Hiyama T. Tetrahedron 1998, 44, 4135.
doi: 10.1016/S0040-4020(01)86661-8 |
| [6] |
Shan C.-C.; Dai K.-Y.; Zhao M.; Xu Y.-H. Eur. J. Org. Chem. 2021, 4054.
|
| [7] |
Gao P.; Wang G.-Q.; Xi L.-L.; Wang M.-Y.; Li S.-H.; Shi Z.-Z. Chin. J. Chem. 2019, 37, 1009.
doi: 10.1002/cjoc.v37.10 |
| [8] |
Coates G.; Tan H.-Y.; Kalff C.; White A. J. P.; Crimmin M. R. Angew. Chem., Int. Ed. 2019, 58, 12514.
doi: 10.1002/anie.v58.36 |
| [9] |
Paioti P.; Mikus M. S.; Lee J.; Koh M. J.; Romiti F.; Torker S.; Pozo J. D.; Hoveyda A. H. J. Am. Chem. Soc. 2019, 141, 19917.
doi: 10.1021/jacs.9b11382 pmid: 31809041 |
| [10] |
Gao P.; Gao L.-Z.; Xi L.-L.; Zhang Z.-D.; Li S.-H.; Shi Z.-Z. Org. Chem. Front. 2020, 7, 2618.
doi: 10.1039/D0QO00773K |
| [11] |
Yang X.-N.; Guo H.-Y.; Zhou R. Chin. J. Org. Chem. 2023, 43, 2720 (in Chinese).
doi: 10.6023/cjoc202212017 |
|
(杨晓娜, 郭宏宇, 周荣, 有机化学, 2023, 43, 2720.)
doi: 10.6023/cjoc202212017 |
|
| [12] |
Yang X.-H.; Gao H.-W.; Yan J.-L.; Shi L. Chin. J. Org. Chem. 2022, 42, 4122 (in Chinese).
doi: 10.6023/cjoc202207047 |
|
(杨惜晖, 高皓炜, 闫甲乐, 史雷, 有机化学, 2022, 42, 4122.)
doi: 10.6023/cjoc202207047 |
|
| [13] |
Ren L.-Q.; Li N.; Ke J.; He C. Org. Chem. Front. 2022, 9, 6400.
doi: 10.1039/D2QO01387H |
| [14] |
Ghosh S.; Lai D.; Hajra A. Org. Biomol. Chem. 2021, 19, 2399.
doi: 10.1039/D1OB00082A |
| [15] |
Yue F.-Y.; Liu J.-H.; Ma H.-N.; Liu Y.-X.; Dong J.-Y.; Wang Q.-M. Org. Lett. 2022, 24, 4019.
doi: 10.1021/acs.orglett.2c01448 |
| [16] |
Luo C.; Zhou Y.; Chen H.; Wang T.; Zhang Z.-B.; Han P.; Jing L.-H. Org. Lett. 2022, 24, 4286.
doi: 10.1021/acs.orglett.2c01690 |
| [17] |
Xu W.-G.; Xia C.-J.; Shao Q.; Zhang Q.; Liu M.-R.; Zhan H.-W.; Wu M.-B. Org. Chem. Front. 2022, 9, 4949.
doi: 10.1039/D2QO00894G |
| [18] |
Takemura N.; Sumida Y.; Ohmiya H. ACS Catal. 2022, 12, 7804.
doi: 10.1021/acscatal.2c01964 |
| [19] |
Liu S.-H.; Pan P.; Fan H.-Q.; Li P.; Wang W.; Zhang Y.-Q. Chem. Sci. 2019, 10, 3817.
doi: 10.1039/C9SC00046A |
| [20] |
Wan Y.; Zhu J.-J.; Yuan Q.-Y.; Liu S.-H.; Zhao J.-H.; Zhang Y.-Q. Org. Lett. 2021, 23, 1406.
doi: 10.1021/acs.orglett.1c00065 pmid: 33502205 |
| [21] |
Pan P.; Yuan Q.-Y.; Liu S. H.; Zhao J. H.; Zhang Y.-Q. Chin. J. Org. Chem. 2022, 42, 1136 (in Chinese).
doi: 10.6023/cjoc202110003 |
|
(潘鹏, 袁启洋, 刘石惠, 赵建宏, 张永强, 有机化学, 2022, 42, 1136.)
doi: 10.6023/cjoc202110003 |
|
| [22] |
Zhao Y.-M.; Wan Y.; Yuan Q.-Y.; Wei J.-L.; Zhang Y.-Q. Org. Lett. 2023, 25, 1386.
doi: 10.1021/acs.orglett.3c00096 |
| [23] |
Wan Y.; Zhao Y.-M.; Zhu J.-J.; Yuan Q.-Y.; Wang W.; Zhang Y.-Q. Green Chem. 2023, 25, 256.
doi: 10.1039/D2GC03577D |
| [24] |
Lima F.; Sharma U. K.; Grunenberg L.; Saha D.; Johannsen S.; Sedelmeier J.; Eycken E. V.; Ley S. V. Angew. Chem., Int. Ed. 2017, 56, 15136.
doi: 10.1002/anie.v56.47 |
| [25] |
Zhong M.-B.; Pannecoucke X.; Jubault P.; Poisson T. Chem.-Eur. J. 2021, 27, 11818.
doi: 10.1002/chem.v27.46 |
| [26] |
Choi G. J.; Zhu Q.-L.; Miller D. C.; Gu C.-J.; Robert R. Nature 2016, 539, 268.
doi: 10.1038/nature19811 |
| [27] |
Luo J.; Zhang J. ACS Catal. 2016, 6, 873.
doi: 10.1021/acscatal.5b02204 |
| [28] |
Jeffrey J. L.; Terrett J. A.; MacMillan D. W. C. Science 2015, 349, 1532.
doi: 10.1126/science.aac8555 pmid: 26316601 |
| [29] |
Lang S. B.; Wiles R. J.; Kelly C. B.; Molander G. A. Angew. Chem., Int. Ed. 2017, 56, 15073.
doi: 10.1002/anie.v56.47 |
| [30] |
Hu Q.-P.; Cheng J.; Wang Y.; Shi J.; Wang B.-Q.; Hu P.; Zhao K.-Q.; Pan F. Org. Lett. 2021, 23, 4457.
doi: 10.1021/acs.orglett.1c01385 |
| [31] |
Aelterman M.; Biremond T.; Jubault P.; Poisson T. Chem.-Eur. J. 2022, 28, e202202194.
|
| [32] |
Shishido R.; Uesugi M.; Takahashi R.; Mita T.; Ishiyama T.; Kubota K.; Ito H. J. Am. Chem. Soc. 2020, 142, 14125.
doi: 10.1021/jacs.0c03011 pmid: 32697080 |
| [33] |
Carminati D. M.; Decaens J.; Bonnaire S.; Jubaul P.; Fasan R. Angew. Chem., Int. Ed. 2021, 60, 7072.
doi: 10.1002/anie.v60.13 |
| [34] |
Fujita T.; Morioka R.; Arita T.; Ichikawa J. Chem. Commun. 2018, 54, 12938.
doi: 10.1039/C8CC04643C |
| [1] | 朱彦硕, 王红言, 舒朋华, 张克娜, 王琪琳. 烷氧自由基引发1,5-氢原子转移实现C(sp3)—H键官能团化的研究进展[J]. 有机化学, 2024, 44(1): 1-17. |
| [2] | 童红恩, 郭宏宇, 周荣. 可见光促进惰性碳-氢键对羰基的加成反应进展[J]. 有机化学, 2024, 44(1): 54-69. |
| [3] | 杨晓娜, 郭宏宇, 周荣. 可见光促进有机硅化合物参与的化学转化[J]. 有机化学, 2023, 43(8): 2720-2742. |
| [4] | 高艳华, 张银潘, 张妍, 宋涛, 杨勇. 可见光驱动表面富含氧空位Nb2O5催化醇氧化反应[J]. 有机化学, 2023, 43(7): 2572-2579. |
| [5] | 赵金晓, 魏彤辉, 柯森, 李毅. 可见光催化合成二氟烷基取代的多环吲哚化合物[J]. 有机化学, 2023, 43(3): 1102-1114. |
| [6] | 赵瑜, 段玉荣, 史时辉, 白育斌, 黄亮珠, 杨晓军, 张琰图, 冯彬, 张建波, 张秋禹. 可见光促进高价碘(III)试剂参与反应的研究进展[J]. 有机化学, 2023, 43(12): 4106-4140. |
| [7] | 陈凤娟, 刘罗, 张子露, 曾伟. 可见光催化有机硅的合成研究进展[J]. 有机化学, 2023, 43(10): 3454-3469. |
| [8] | 潘振涛, 刘彤, 马永敏, 颜剑波, 王亚军. 布朗斯特酸/可见光氧化还原接力催化构建喹唑啉(硫)酮[J]. 有机化学, 2022, 42(9): 2823-2831. |
| [9] | 李亚东, 吴鹏举, 杨志勇. 可见光催化苯并噁唑与α-酮酸合成芳基苯并噁唑[J]. 有机化学, 2022, 42(6): 1770-1777. |
| [10] | 孙天义, 张依凡, 孟远倢, 王怡, 朱琦峰, 姜玉新, 刘石惠. 可见光-铜共催化的糖类区域选择性氧烷基化反应[J]. 有机化学, 2022, 42(5): 1414-1422. |
| [11] | 赵成军, 白治琴, 何建, 刘强. 吡唑化提高喹喔啉酮敏化效率: 氮杂环丁烷的合成及进一步开环反应[J]. 有机化学, 2022, 42(12): 4300-4314. |
| [12] | 季晓霜, 付荣, 王树良, 郝文娟, 姜波. 可见光驱动酚/芳胺联-1,6-烯炔与全卤代甲烷的Kharasch反应[J]. 有机化学, 2022, 42(12): 4282-4291. |
| [13] | 何燕, 黄天姿, 史小琴, 陈艳, 吴琼. 异腈参与的光催化反应研究进展[J]. 有机化学, 2022, 42(12): 4220-4246. |
| [14] | 杨惜晖, 高皓炜, 闫甲乐, 史雷. 自由基介导的硅烷Si—H键官能团化研究进展: 一种合成含C—Si键有机硅化合物的有效策略[J]. 有机化学, 2022, 42(12): 4122-4151. |
| [15] | 李猛, 赵冬阳, 孙凯. 可见光驱动基团迁移引发的烯烃双官能团化反应[J]. 有机化学, 2022, 42(12): 4152-4168. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||