有机化学 ›› 2021, Vol. 41 ›› Issue (2): 757-765.DOI: 10.6023/cjoc202007055 上一篇 下一篇
研究论文
王文博1, 韩华彬1, 王乐乐1, 王琪琳1,*( ), 卜站伟1,*(
), 卜站伟1,*( )
)
收稿日期:2020-07-23
修回日期:2020-08-21
发布日期:2020-09-22
通讯作者:
王琪琳, 卜站伟
作者简介:基金资助:
Wenbo Wang1, Huabin Han1, Lele Wang1, Qilin Wang1,*( ), Zhanwei Bu1,*(
), Zhanwei Bu1,*( )
)
Received:2020-07-23
Revised:2020-08-21
Published:2020-09-22
Contact:
Qilin Wang, Zhanwei Bu
Supported by:文章分享
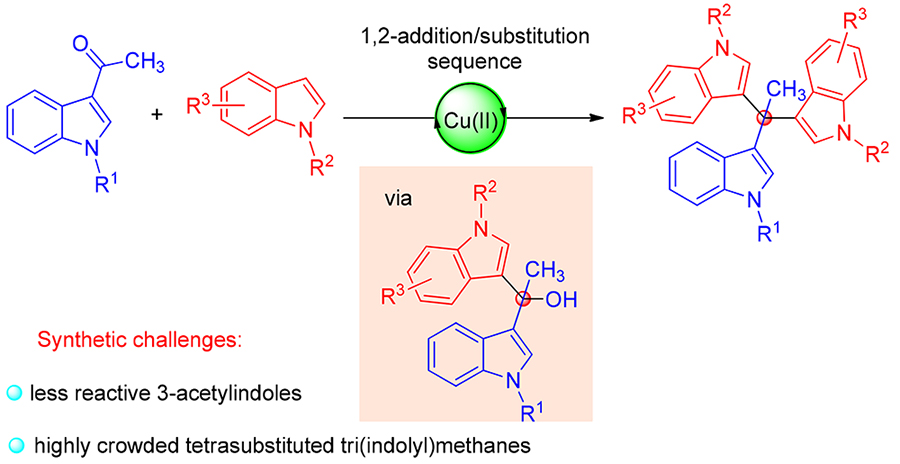
在温和的条件下, 利用3-乙酰基吲哚与吲哚的加成/取代串联反应, 高效地合成了一系列高度拥挤的四取代三吲哚甲烷. 该方法通过在3-乙酰基吲哚的氮原子上引入吸电子基团, 提高了3-乙酰基吲哚的反应活性, 具有原料廉价易得、底物适用性广、操作简便等优点.
王文博, 韩华彬, 王乐乐, 王琪琳, 卜站伟. 铜催化加成/取代串联反应构建四取代的三吲哚甲烷[J]. 有机化学, 2021, 41(2): 757-765.
Wenbo Wang, Huabin Han, Lele Wang, Qilin Wang, Zhanwei Bu. Access to Tetrasubstituted Tri(indolyl)methanes through Copper-Catalyzed Addition/Substitution Sequence[J]. Chinese Journal of Organic Chemistry, 2021, 41(2): 757-765.
| Entry | Cat. | Solvent | Yieldb/% |
|---|---|---|---|
| 1 | FeCl3?6H2O | MeCN | 46 |
| 2 | Fe2(SO4)3 | MeCN | 82 |
| 3 | Fe(OTf)3 | MeCN | 72 |
| 4 | CuCl2?2H2O | MeCN | 77 |
| 5 | CuBr2 | MeCN | 98 |
| 6 | Cu(OTf)2 | MeCN | 82 |
| 7 | p-TSA | MeCN | 95 |
| 8 | TFA | MeCN | — |
| 9 | CuBr2 | CHCl3 | 72 |
| 10 | CuBr2 | THF | 34 |
| 11 | CuBr2 | MeOH | 77 |
| 12c | CuBr2 | MeCN | 77d |
| 13e | CuBr2 | MeCN | 75d |
| Entry | Cat. | Solvent | Yieldb/% |
|---|---|---|---|
| 1 | FeCl3?6H2O | MeCN | 46 |
| 2 | Fe2(SO4)3 | MeCN | 82 |
| 3 | Fe(OTf)3 | MeCN | 72 |
| 4 | CuCl2?2H2O | MeCN | 77 |
| 5 | CuBr2 | MeCN | 98 |
| 6 | Cu(OTf)2 | MeCN | 82 |
| 7 | p-TSA | MeCN | 95 |
| 8 | TFA | MeCN | — |
| 9 | CuBr2 | CHCl3 | 72 |
| 10 | CuBr2 | THF | 34 |
| 11 | CuBr2 | MeOH | 77 |
| 12c | CuBr2 | MeCN | 77d |
| 13e | CuBr2 | MeCN | 75d |
| Entry | R1 | 1 | R2 | R3 | 2 | 3 | Yieldb/% |
|---|---|---|---|---|---|---|---|
| 1 | Ts | 1a | Bn | H | 2a | 3a | 98 |
| 2 | Ns | 1b | Bn | H | 2a | 3b | 41 |
| 3 | Ac | 1c | Bn | H | 2a | 3c | 52 |
| 4 | Bz | 1d | Bn | H | 2a | 3d | 64 |
| 5 | Boc | 1e | Bn | H | 2a | 3e | 44 |
| 6 | Cbz | 1f | Bn | H | 2a | 3f | 63 |
| 7 | CO2Et | 1g | Bn | H | 2a | 3g | 43 |
| 8 | Ts | 1a | Me | H | 2b | 3h | 75 |
| 9 | Ts | 1a | Et | H | 2c | 3i | 57 |
| 10 | Ts | 1a | n-Pr | H | 2d | 3j | 79 |
| 11 | Ts | 1a | i-Pr | H | 2e | 3k | 80 |
| 12 | Ts | 1a | n-Bu | H | 2f | 3l | 88 |
| 13 | Ts | 1a | Allyl | H | 2g | 3m | 68 |
| 14 | Ts | 1a | Bn | 5-CH3 | 2h | 3n | 70 |
| 15 | Ts | 1a | Bn | 6-CH3 | 2i | 3o | 64 |
| 16 | Ts | 1a | Bn | 5-OBn | 2j | 3p | 71 |
| 17 | Ts | 1a | Bn | 5-Cl | 2k | 3q | 34 |
| 18 | Ts | 1a | Bn | 5-Br | 2l | 3r | 69 |
| 19 | Ts | 1a | Bn | 6-Br | 2m | 3s | 74 |
| 20 | Ts | 1a | Bn | 5-CO2Me | 2n | 3t | 53 |
| 21 | Ts | 1a | Bn | 5-NO2 | 2o | 3u | 32 |
| Entry | R1 | 1 | R2 | R3 | 2 | 3 | Yieldb/% |
|---|---|---|---|---|---|---|---|
| 1 | Ts | 1a | Bn | H | 2a | 3a | 98 |
| 2 | Ns | 1b | Bn | H | 2a | 3b | 41 |
| 3 | Ac | 1c | Bn | H | 2a | 3c | 52 |
| 4 | Bz | 1d | Bn | H | 2a | 3d | 64 |
| 5 | Boc | 1e | Bn | H | 2a | 3e | 44 |
| 6 | Cbz | 1f | Bn | H | 2a | 3f | 63 |
| 7 | CO2Et | 1g | Bn | H | 2a | 3g | 43 |
| 8 | Ts | 1a | Me | H | 2b | 3h | 75 |
| 9 | Ts | 1a | Et | H | 2c | 3i | 57 |
| 10 | Ts | 1a | n-Pr | H | 2d | 3j | 79 |
| 11 | Ts | 1a | i-Pr | H | 2e | 3k | 80 |
| 12 | Ts | 1a | n-Bu | H | 2f | 3l | 88 |
| 13 | Ts | 1a | Allyl | H | 2g | 3m | 68 |
| 14 | Ts | 1a | Bn | 5-CH3 | 2h | 3n | 70 |
| 15 | Ts | 1a | Bn | 6-CH3 | 2i | 3o | 64 |
| 16 | Ts | 1a | Bn | 5-OBn | 2j | 3p | 71 |
| 17 | Ts | 1a | Bn | 5-Cl | 2k | 3q | 34 |
| 18 | Ts | 1a | Bn | 5-Br | 2l | 3r | 69 |
| 19 | Ts | 1a | Bn | 6-Br | 2m | 3s | 74 |
| 20 | Ts | 1a | Bn | 5-CO2Me | 2n | 3t | 53 |
| 21 | Ts | 1a | Bn | 5-NO2 | 2o | 3u | 32 |
| [1] |
For selected reviews, see: a Somei, M.; Yamada, F.Nat. Prod. Rep. 2005, 22, 73.
doi: 10.1039/b316241a pmid: 16836303 |
|
(b) Cacchi S.; Fabrizi G. Chem. Rev. 2005, 105, 2873.
doi: 10.1021/cr040639b pmid: 16836303 |
|
|
(c) Chen F.E.; Huang J. Chem. Rev. 2005, 105, 4671.
doi: 10.1021/cr050521a pmid: 16836303 |
|
|
(d) Humphrey G.R.; Kuethe J.T. Chem. Rev. 2006, 106, 2875.
pmid: 16836303 |
|
|
(e) Zhang Y.C.; Jiang F.; Shi F. Acc. Chem. Res. 2020, 53, 425.
doi: 10.1021/acs.accounts.9b00549 pmid: 16836303 |
|
| [2] |
For selected examples, see: a Jiang, F.; Chen, K. W.; Wu, P.; Zhang, Y. C.; Jiao, Y. C.; Shi, F.Angew. Chem., Int. Ed. 2019, 58, 15104.
doi: 10.1002/anie.v58.42 pmid: 0e4049ef-4a39-4ff7-ba5c-77d5eb3e2960 |
|
(b) Sun M.; Ma C.; Zhou S.J.; Lou S.F.; Xiao J.; Jiao Y.C.; Shi F. Angew. Chem., Int. Ed. 2019, 58, 8703.
doi: 10.1002/anie.v58.26 pmid: 0e4049ef-4a39-4ff7-ba5c-77d5eb3e2960 |
|
|
(c) Wang H.Q.; Xu M.M.; Wan Y.; Mao Y.J.; Mei G.J.; Shi F. Adv. Synth. Catal. 2018, 360, 1850.
doi: 10.1002/adsc.v360.9 pmid: 0e4049ef-4a39-4ff7-ba5c-77d5eb3e2960 |
|
|
(d) Bai G.X.; Dong F.Y.; Xu L.B.; Liu Y.J.; Wang L.; Li S.S. Org. Lett. 2019, 21, 6225.
doi: 10.1021/acs.orglett.9b02051 pmid: 0e4049ef-4a39-4ff7-ba5c-77d5eb3e2960 |
|
|
(e) Liu X.L.; Zhou G.; Gong Y.; Yao Z.; Zuo X.; Zhang W.H.; Zhou Y. Org. Lett. 2019, 21, 2528.
doi: 10.1021/acs.orglett.9b00139 pmid: 0e4049ef-4a39-4ff7-ba5c-77d5eb3e2960 |
|
|
(f) Xu S.W.; Liu X.W.; Zuo X.; Zhou G.; Gong Y.; Liu X.L.; Zhou Y. Adv. Synth. Catal. 2019, 361, 5328.
doi: 10.1002/adsc.v361.23 pmid: 0e4049ef-4a39-4ff7-ba5c-77d5eb3e2960 |
|
|
(g) Zhu Z.Q.; Yin L.; Wang Y.; Shen Y.; Li C.; Mei G.J.; Shi F. Org. Chem. Front. 2017, 4, 57.
doi: 10.1039/C6QO00446F pmid: 0e4049ef-4a39-4ff7-ba5c-77d5eb3e2960 |
|
|
(h) Wang X.; Li G.F.; Sun K.; Zhang B. Chin. J. Org. Chem. 2020, 40, 913. (in Chinese)
doi: 10.6023/cjoc202002040 pmid: 0e4049ef-4a39-4ff7-ba5c-77d5eb3e2960 |
|
|
王薪, 李国锋, 孙凯, 张冰, 有机化学, 2020, 40, 913.).
doi: 10.6023/cjoc202002040 pmid: 0e4049ef-4a39-4ff7-ba5c-77d5eb3e2960 |
|
|
(i) Sun K.; Li Y.L.; Feng R.R.; Mu S.Q.; Wang X.; Zhang B. J. Org. Chem. 2020, 85, 1001.
doi: 10.1021/acs.joc.9b02941 pmid: 0e4049ef-4a39-4ff7-ba5c-77d5eb3e2960 |
|
|
(j) Wang X.; Wang Q.L.; Xue Y.R.; Sun K.; Wu L.L.; Zhang B. Chem. Commun. 2020, 56, 4436.
doi: 10.1039/D0CC01079K pmid: 0e4049ef-4a39-4ff7-ba5c-77d5eb3e2960 |
|
|
(k) Sun K.; Li G.F.; Li Y.Y.; Yu J.; Zhao Q.; Zhang Z.G.; Zhang G.S. Adv. Synth. Catal. 2020, 362, 1947.
doi: 10.1002/adsc.v362.10 pmid: 0e4049ef-4a39-4ff7-ba5c-77d5eb3e2960 |
|
| [3] |
(a) Giuseppe B.; Ines B.; Raffaele R.; Jacques L.; Gevenieve B. J. Nat. Prod. 1995, 58, 1254.
doi: 10.1021/np50122a017 pmid: 10449193 |
|
(b) Chang Y.C.; Riby J.; Chang G. H. F.; Peng B.C.; Firestone G.; Bjeldanes L.F. Biochem. Pharmacol. 1999, 58, 825.
pmid: 10449193 |
|
|
(c) Lee C.H.; Yao C.F.; Huang S.M.; Ko S.K.; Tan Y.H.; Lee-Chen G.J.; Wang Y.C. Cancer 2008, 113, 815.
doi: 10.1002/cncr.v113:4 pmid: 10449193 |
|
|
(d) Kamal A.; Srikanth Y. V. V.; Khan M. N. A.; Shaik T.B.; Ashraf M. Bioorg. Med. Chem. Lett. 2010, 20, 5229.
pmid: 10449193 |
|
| [4] |
(a) Garbe T.R.; Kobayashi M.; Shimizu M.; Takesue N.; Ozawa M.; Yukawa H. J. Nat. Prod. 2000, 63, 596.
pmid: 10843566 |
|
(b) Mason M.R.; Barnard T.S.; Segla M.F.; Xie B.H.; Kirschbaum K. J. Chem. Crystallogr. 2003, 33, 531.
doi: 10.1023/A:1024234618248 pmid: 10843566 |
|
| [5] |
(a) Zeng X.F.; Ji S.J.; Su X.M. Chin. J. Chem. 2008, 26, 413.
doi: 10.1002/(ISSN)1614-7065 |
|
(b) Chakrabarty M.; Sarkar S.; Linden A.; Stein B.K. Synth. Commun. 2004, 34, 1801.
doi: 10.1081/SCC-120034161 |
|
|
(c) Zhang Z.H.; Lin J. Synth. Commun. 2007, 37, 209.
doi: 10.1080/00397910601031652 |
|
|
(d) Akgün E.; Pindur U.; Müller J. J. Heterocycl. Chem. 1983, 20, 1303.
doi: 10.1002/jhet.5570200530 |
|
| [6] |
Bergman J. J. Heterocycl. Chem. 1971, 8, 329.
doi: 10.1002/(ISSN)1943-5193 |
| [7] |
Selič L.; Stanovnik B. Tetrahedron 2001, 57, 3159.
doi: 10.1016/S0040-4020(01)00174-0 |
| [8] |
(a) El Sayed, M.T.; Ahmed, K.M.; Mahmoud, K.; Hilgeroth, A. Eur. J. Med. Chem. 2015, 90, 845.
doi: 10.1016/j.ejmech.2014.12.008 |
|
(b) Noland W.E.; Kumar H.V.; Flick G.C.; Aapros C.L.; Yoon J.H.; Wilt A.C.; Dehkordi N.; Thao S.; Schneered A.K.; Gao S.M.; Tritch K.J. Tetrahedron 2017, 73, 3913.
doi: 10.1016/j.tet.2017.05.061 |
|
|
(c) Chakrabarty M.; Sarkar S. Tetrahedron Lett. 2002, 43, 1351.
doi: 10.1016/S0040-4039(01)02380-2 |
|
|
(d) Veisi H.; Maleki B.; Eshbala F.H.; Veisi H.; Masti R.; Ashrafi S.S.; Baghayeri M. RSC Adv. 2014, 4, 30683.
doi: 10.1039/C4RA03194F |
|
|
(e) Gu D.G.; Ji S.J. Chin. J. Chem. 2008, 26, 578.
doi: 10.1002/(ISSN)1614-7065 |
|
| [9] |
Xiang J.C.; Wang J.G.; Wang M.; Meng X.G.; Wu A.X. Org. Biomol. Chem. 2015, 13, 4240.
doi: 10.1039/C5OB00025D |
| [10] |
(a) El Sayed, M.T.; Mahmoud, K.; Hilgeroth, A.; Fakhr, I. M. I. J. Heterocycl. Chem. 2016, 53, 188.
doi: 10.1002/jhet.v53.1 |
|
(b) Khaksar S.; Vahdat S.M.; Gholizadeh M.; Talesh S.M. J. Fluorine Chem. 2012, 136, 8.
doi: 10.1016/j.jfluchem.2012.01.002 |
|
| [11] |
Wang W.B.; Zhu Y.S.; Guo S.Q.; Wang Q.L.; Bu Z.W. Org. Biomol. Chem. 2016, 14, 4420.
doi: 10.1039/C6OB00515B |
| [12] |
(a) Zhu Y.S.; Zhou J.; Jin S.J.; Dong H.H.; Guo J.M.; Bai X.G.; Wang Q.L.; Bu Z.W. Chem. Commun. 2017, 53, 11201.
doi: 10.1039/C7CC05813F pmid: WOS:000496533500007 |
|
(b) Wang W.B.; Bai X.G.; Jin S.J.; Guo J.M.; Zhao Y.; Miao H.J.; Zhu Y.S.; Wang Q.L.; Bu Z.W. Org. Lett. 2018, 20, 3451.
doi: 10.1021/acs.orglett.8b01107 pmid: WOS:000496533500007 |
|
|
(c) Guo J.M.; Miao H.J.; Zhao Y.; Bai X.G.; Zhu Y.S.; Wang Q.L.; Bu Z.W. Chem. Commun. 2019, 55, 5207.
doi: 10.1039/C9CC02170A pmid: WOS:000496533500007 |
|
|
(d) Zhang K.; Han H.B.; Wang L.L.; Zhang Z.Y.; Wang Q.L.; Zhang W.J.; Bu Z.W. Chem. Commun. 2019, 55, 13681.
doi: 10.1039/c9cc07114h pmid: WOS:000496533500007 |
|
|
(e) Wang L.L.; Han H.B.; Cui Z.H.; Zhao J.W.; Bu Z.W.; Wang Q.L. Org. Lett. 2020, 22, 873.
doi: 10.1021/acs.orglett.9b04398 pmid: WOS:000496533500007 |
|
|
(f) Miao H.J.; Wang L.L.; Han H.B.; Zhao Y.D.; Wang Q.L.; Bu Z.W. Chem. Sci. 2020, 11, 1418.
doi: 10.1039/C9SC04880D pmid: WOS:000496533500007 |
|
|
(g) Bai X.G.; Miao H.J.; Zhao Y.; Wang Q.L.; Bu Z.W. Org. Lett. 2020, 22, 5068.
doi: 10.1021/acs.orglett.0c01648 pmid: WOS:000496533500007 |
|
| [13] |
Mo L.P.; Ma Z.C.; Zhang Z.H. Synth. Commun. 2005, 35, 1997.
doi: 10.1081/SCC-200066653 |
| [1] | 梅青刚, 李清寒. 可见光促进C(3)(杂)芳硫基吲哚化合物的合成研究进展[J]. 有机化学, 2024, 44(2): 398-408. |
| [2] | 岁丹丹, 岑南楠, 龚若蕖, 陈阳, 陈文博. 无支持电解质条件下连续流电化学合成三氟甲基化氧化吲哚[J]. 有机化学, 2023, 43(9): 3239-3245. |
| [3] | 贝文峰, 潘健, 冉冬梅, 刘伊琳, 杨震, 冯若昆. 基于钴催化吲哚酰胺与二炔和单炔的[4+2]环化反应合成γ-咔啉酮[J]. 有机化学, 2023, 43(9): 3226-3238. |
| [4] | 冯莹珂, 王贺, 崔梦行, 孙然, 王欣, 陈阳, 李蕾. 可见光诱导的新型官能化芳基异腈化合物的二氟烷基化环化反应[J]. 有机化学, 2023, 43(8): 2913-2925. |
| [5] | 张彦波, 孙萌. 铑催化碳酸亚乙烯酯与吲哚啉C(7)位C—H甲酰甲基化反应[J]. 有机化学, 2023, 43(8): 2905-2912. |
| [6] | 王熠, 张键, 刘飏子, 罗晓燕, 邓卫平. 钯催化不对称[3+4]环加成构建吲哚并环庚烷[J]. 有机化学, 2023, 43(8): 2864-2877. |
| [7] | 孙李星, 孙婷婷, 王海清, 吴淑芳, 王小烨, 刘天雅, 张宇辰. Lewis酸催化下3-烷基-2-吲哚烯与α,β-不饱和N-磺酰基亚胺的[2+4]环化反应[J]. 有机化学, 2023, 43(6): 2178-2188. |
| [8] | 任志军, 罗维纬, 周俊. 银介导的N-芳基丙烯酰胺串联环化反应研究进展[J]. 有机化学, 2023, 43(6): 2026-2039. |
| [9] | 孙泽人, 翟冰新, 何光超, 沈慧, 陈琳雅, 张杉, 邹毅, 朱启华, 徐云根. 新型1,2,3-三氮唑类衍生物的合成及抗炎活性研究[J]. 有机化学, 2023, 43(6): 2143-2155. |
| [10] | 庞明杨, 常宏宏, 冯璋, 张娟. 过渡金属催化吲哚的串联去芳构化反应研究进展[J]. 有机化学, 2023, 43(4): 1271-1291. |
| [11] | 黄华, 李鑫, 苏建科, 宋秋玲. 二氟卡宾参与下从邻乙烯基苯胺出发构建3-取代吲哚酮类化合物[J]. 有机化学, 2023, 43(3): 1146-1156. |
| [12] | 曾成富, 何媛, 李清, 董琳. Ir(III)催化新型三组分串联三氟乙氧基化反应并一锅法构建复杂酰胺化合物[J]. 有机化学, 2023, 43(3): 1115-1123. |
| [13] | 赵金晓, 魏彤辉, 柯森, 李毅. 可见光催化合成二氟烷基取代的多环吲哚化合物[J]. 有机化学, 2023, 43(3): 1102-1114. |
| [14] | 杜昌远, 唐裕才, 段京林, 杨碧玉, 何宇鹏, 周谦, 刘学文. 可见光促进有机染料催化2-芳基吲哚自由基烷氧羰基化反应研究[J]. 有机化学, 2023, 43(12): 4268-4276. |
| [15] | 刘甜甜, 段新红. 不对称傅-克反应在构建手性3-取代吲哚中的研究进展[J]. 有机化学, 2023, 43(11): 3695-3712. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||