有机化学 ›› 2022, Vol. 42 ›› Issue (4): 1085-1100.DOI: 10.6023/cjoc202109006 上一篇 下一篇
综述与进展
收稿日期:2021-09-03
修回日期:2021-11-07
发布日期:2021-11-25
通讯作者:
成江
基金资助:
Tingting Gong, Zhibin Chen, Miaochang Liu, Jiang Cheng( )
)
Received:2021-09-03
Revised:2021-11-07
Published:2021-11-25
Contact:
Jiang Cheng
Supported by:文章分享
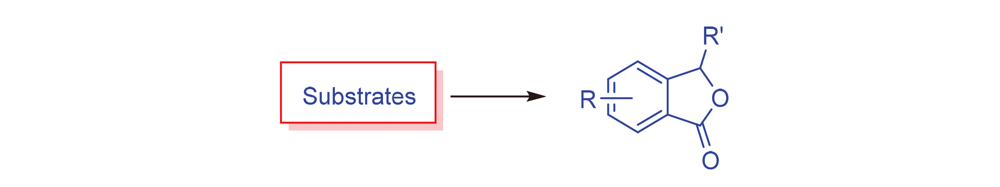
2-苯并呋喃-1(3H)-酮(异苯并呋喃酮)是合成多种环状化合物的前体, 许多天然产物中含有异苯并呋喃酮结构. 由于其广泛的生物活性, 及其在药学方面的广泛应用, 该类化合物的制备引起了极大关注. 将从过渡金属催化合成、 酸碱催化合成以及其它合成方法等三方面总结了我们及其他课题组近十年在合成异苯并呋喃酮方面的工作.
龚婷婷, 陈智斌, 刘妙昌, 成江. 2-苯并呋喃-1(3H)-酮的合成研究进展[J]. 有机化学, 2022, 42(4): 1085-1100.
Tingting Gong, Zhibin Chen, Miaochang Liu, Jiang Cheng. Recent Progress in the Synthesis of 2-Benzofuran-1(3H)-one[J]. Chinese Journal of Organic Chemistry, 2022, 42(4): 1085-1100.


| [1] |
Karmakar, R.; Pahari, P.; Mal, D. Chem. Rev. 2014, 114, 6213.
doi: 10.1021/cr400524q pmid: 24823231 |
| [2] |
Ray, S.-K.; Sadhu, M.-M.; Biswas, R.-G.; Unhale, R.-A.; Singh, V.-K. Org. Lett. 2019, 21, 417.
doi: 10.1021/acs.orglett.8b03597 |
| [3] |
Pan, Y.-L.; Zheng, H.-L.; Wang, J.; Yang, C.; Li, X.; Cheng, J.-P. ACS Catal. 2020, 10, 8069
doi: 10.1021/acscatal.0c02585 |
| [4] |
Huang, L.-J.; Wang, S.; Ma, F.; Zhang, Y.; Peng, Y.-C.; Xing, C.-H.; Feng, Y.-P.; Wang, X.-L.; Peng, Y. Pharmacol. Res. 2018, 135, 201.
doi: 10.1016/j.phrs.2018.08.007 |
| [5] |
Huang, X.-Z.; Yun, Z.; Guan, X.-L.; Kai, T.; Guo, J.-M.; Wang, H.-B.; Fu, G.-M. Molecules 2012, 17, 4219.
doi: 10.3390/molecules17044219 |
| [6] |
Lan, W.-J.; Liu, W.; Liang, W.-L.; Xu, Z.; Le, X.; Xu, J.; Lam, C.-K.; Wang, L.-Y. Mar. Drugs 2014, 12, 4188.
doi: 10.3390/md12074188 |
| [7] |
Yue, J.-M.; Xu, J.; Zhao, Y.; Sun, H.-D.; Lin, Z.-W. J. Nat. Prod. 1997, 60, 1031.
doi: 10.1021/np970044u |
| [8] |
Rahman, M.-M.; Gray, A.-I. Phytochemistry 2005, 66, 1601.
doi: 10.1016/j.phytochem.2005.05.001 |
| [9] |
Ma, F.-F.; Yuan, G.; Qiao, H.-L.; Hu, X.-J.; Chang, J.-B. J. Thromb. Thrombolysis 2012, 33, 64.
doi: 10.1007/s11239-011-0647-9 |
| [10] |
Tanaka, K.; Nishida, G.; Wada, A.; Noguchi, K. Angew. Chem., Int. Ed. 2004, 43, 6510.
doi: 10.1002/anie.200461533 |
| [11] |
Kitamura, M.; Ohkuma, T.; Inoue, S.; Sayo, N.; Kumobayashi, H. J. Am. Chem. Soc. 1988, 110, 629.
doi: 10.1021/ja00210a070 |
| [12] |
Phan, D.-H.-T.; Kim, B.; Dong, V.-M. J. Am. Chem. Soc. 2009, 131, 15608.
doi: 10.1021/ja907711a |
| [13] |
Zhang, B.; Xu, M.-H.; Lin, G.-Q. Org. Lett. 2009, 11, 4712.
doi: 10.1021/ol901674k pmid: 19810768 |
| [14] |
Miyaura, N.; Suzuki, A. Chem. Rev. 1995, 95, 2457.
doi: 10.1021/cr00039a007 |
| [15] |
Ye, Z.; Lü, G.; Wang, W.; Zhang, M.; Cheng, J. Angew. Chem., Int. Ed. 2010, 49, 3671.
doi: 10.1002/anie.201000302 |
| [16] |
Wei, Y.; Hu, P.; Zhang, M.; Su, W.-P. Chem. Rev. 2017, 117, 8864.
doi: 10.1021/acs.chemrev.6b00516 pmid: 28266216 |
| [17] |
Renzetti, A.; Nakazawa, H.; Li, C.-J. RSC Adv. 2016, 6, 40626.
doi: 10.1039/C6RA07671H |
| [18] |
Zhu, Y.-Q.; Li, J.-X.; Han, T.-F.; He, J.-L.; Zhu, K. Eur. J. Org. Chem. 2017, 2017, 806.
doi: 10.1002/ejoc.201601320 |
| [19] |
Danoun, G.; Mamone, P.; Gooßen, L.-J. Chem.-Eur. J. 2013, 19, 17287.
doi: 10.1002/chem.201303426 |
| [20] |
Liu, Y.; Yang, Y.-D.; Shi, Y.; Wang, X.-J.; Zhang, L.-Q.; Cheng, Y.-Y.; You, J.-S. Organometallics 2016, 35, 1350.
doi: 10.1021/acs.organomet.6b00107 |
| [21] |
Han, W.-J.; Pu, F.; Fan, J.; Liu, Z.-W.; Shi, X.-Y. Adv. Synth. Catal. 2017, 359, 3520.
doi: 10.1002/adsc.201700603 |
| [22] |
Qiu, Y.; Kong, W.-J.; Struwe, J.; Sauermann, N.; Rogge, T.; Scheremetjew, A.; Ackermann, L. Angew. Chem., Int. Ed. 2018, 57, 5828.
doi: 10.1002/anie.201803342 |
| [23] |
Lin, S.-H.; Lu, X.-Y. J. Org. Chem. 2007, 72, 9757.
doi: 10.1021/jo071232k |
| [24] |
Yamamoto, T.; Ohta, T.; Ito, Y. Org. Lett. 2005, 7, 4153.
pmid: 16146375 |
| [25] |
Ye, Z.-S.; Qian, P.-C.; Lü, G.-L.; Luo, F.; Cheng, J. J. Org. Chem. 2010, 75, 6043.
doi: 10.1021/jo101203b |
| [26] |
Luo, F.; Pan, S.; Pan, C.-D.; Qian, P.-C.; Cheng, J. Adv. Synth. Catal. 2011, 353, 320.
doi: 10.1002/adsc.201000741 |
| [27] |
Lin, H.; Sun, X.-W. Tetrahedron Lett. 2008, 49, 5343.
doi: 10.1016/j.tetlet.2008.06.055 |
| [28] |
Yuan, S.; Zhang, D.-Q.; Zhang, J.-Y.; Yu, B.; Liu, H.-M. Org. Lett. 2020, 22, 814.
doi: 10.1021/acs.orglett.9b04241 |
| [29] |
Chuc, L.-T.-N.; Nguyen, T.-A.-H.; Hou, D.-R. Org. Biomol. Chem. 2020, 18, 2758.
doi: 10.1039/D0OB00303D |
| [30] |
Liang, X.; Xiong, M.-T.; Zhu, H.-P.; Shi, K.-Q.; Zhou, Y.-F.; Pan, Y.-J. Org. Lett. 2020, 22, 9568.
doi: 10.1021/acs.orglett.0c03627 pmid: 33284633 |
| [31] |
Nandi, D.; Ghosh, D.; Chen, S.-J.; Kuo, B.-C.; Lee, H.-M. J. Org. Chem. 2013, 78, 3445.
doi: 10.1021/jo400174w |
| [32] |
Shi, S.; Chen, C.-H.; Chai, Y.; Zhang, L.-T.; Li, J.-W.; Liu, B.; Liu, Y.-J.; Zeng, M.-H. J. Org. Chem. 2019, 84, 9161.
doi: 10.1021/acs.joc.9b01102 |
| [33] |
Fan, J.; Wang, P.-M.; Wang, J.-N.; Zhao, X.; Liu, Z.-W.; Wei, J.-F.; Shi, X.-Y. Sci. China Chem. 2018, 61, 153.
doi: 10.1007/s11426-017-9046-7 |
| [34] |
Fardpour, M.; Darvish, A.; Kianmehr, E.; Kharat, A.-N. Tetrahedron Lett. 2018, 60, 699.
doi: 10.1016/j.tetlet.2018.12.005 |
| [35] |
Ackermann, L.; Pospech, J. Org. Lett. 2011, 13, 4153.
doi: 10.1021/ol201563r pmid: 21749083 |
| [36] |
Miura, H.; Tsutsui, K.; Wada, K.; Shishido, T. Chem. Commun. 2015, 51, 1654.
doi: 10.1039/C4CC08461F |
| [37] |
Yang, Y.; Rioux, R.-M. Chem. Commun. 2011, 47, 6557.
doi: 10.1039/c1cc11605c |
| [38] |
Zhao, H.; Zhang, T.; Yan, T.; Cai, M.-Z. J. Org. Chem. 2015, 80, 8849.
doi: 10.1021/acs.joc.5b01388 |
| [39] |
Bechtoldt, A.; Baumert, M.-E.; Vaccaro, L.; Ackermann, L. Green Chem. 2018, 20, 398.
doi: 10.1039/C7GC03353B |
| [40] |
Dana, S.; Dey, P.; Patil, S.-A.; Baidya, M. Chem.-Asian J. 2020, 15, 564.
doi: 10.1002/asia.201901718 |
| [41] |
Mandal, A.; Garai, B.; Dana, S.; Bera, R.; Baidya, M. Chem.-Asian J. 2020, 15, 4009.
doi: 10.1002/asia.202001087 |
| [42] |
Cabrera, J.-M.; Tauber, J.; Krische, M.-J. Angew. Chem., Int. Ed. 2018, 57, 1390.
doi: 10.1002/anie.201712015 |
| [43] |
Qiu, Y.; Stangier, M.; Ackermann, L. Angew. Chem., Int. Ed. 2018, 57, 14179.
doi: 10.1002/anie.201809611 |
| [44] |
Xiong, Y.-S.; Zhang, B.; Yu, Y.; Weng, J.; Lu, G. J. Org. Chem. 2019, 84, 13465.
doi: 10.1021/acs.joc.9b01646 |
| [45] |
Domínguez, G.; Pérez-Castells, J. Chem. Soc. Rev. 2011, 40, 3430.
doi: 10.1039/c1cs15029d pmid: 21431173 |
| [46] |
Amatore, M.; Aubert, C. Eur. J. Org. Chem. 2015, 2015, 265.
doi: 10.1002/ejoc.201403012 |
| [47] |
Lledó, A.; Pla-Quintana, A.; Roglans, A. Chem. Soc. Rev. 2016, 45, 2010.
doi: 10.1039/c5cs00535c pmid: 26838763 |
| [48] |
Méndez-Gálvez, C.; Böhme, M.; Leino, R.; Savela, R. Eur. J. Org. Chem. 2020, 2020, 1708.
doi: 10.1002/ejoc.202000046 |
| [49] |
Gandhi, S.; Baire, B. Adv. Synth. Catal. 2020, 362, 2651.
doi: 10.1002/adsc.202000313 |
| [50] |
Jia, B.; Yang, Y.-H.; Jin, X.-Q.; Mao, G.-L.; Wang, C.-Y. Org. Lett. 2019, 21, 6259.
doi: 10.1021/acs.orglett.9b02142 |
| [51] |
Maia, A.; Siqueira, R.-P.; Oliveira, F.; Ferreira, J.-G.; Teixeira, R.-R. Bioorg. Med. Chem. Lett. 2016, 26, 2810.
doi: 10.1016/j.bmcl.2016.04.065 |
| [52] |
Mola, A.-D.; Filosa, R.; Massa, A. Molbank 2020, 2020, M1124.
doi: 10.3390/M1124 |
| [53] |
Singha, M.; Maji, M.; Gupta, M.; Majhi, S.; Basak, A. Tetrahedron Lett. 2019, 60, 945.
doi: 10.1016/j.tetlet.2019.02.029 |
| [54] |
Limaye, R.-A.; Kumbhar, V.-B.; Natu, A.-D.; Paradkar, M.-V.; Honmore, V.-S.; Chauhan, R.-R.; Gample, S.-P.; Sarkar, D. Bioorg. Med. Chem. Lett. 2013, 23, 711.
doi: 10.1016/j.bmcl.2012.11.097 pmid: 23265877 |
| [55] |
Li, J.; Chin, E.; Lui, A.-S.; Chen, L.-J. Tetrahedron Lett. 2010, 51, 5937.
doi: 10.1016/j.tetlet.2010.09.023 |
| [56] |
Yang, X.-Y.; Xu, X.-Q.; Wang, X.-K.; Zheng, Z.-B.; Zhao, G.-M.; Li, S. Synth. Commun 2014, 44, 1780.
doi: 10.1080/00397911.2013.871735 |
| [57] |
Fan, L.-L.; Luo, B.-L.; Luo, Z.-F.; Zhang, L.; Fan, J.-D.; Xue, W.; Tang, L.; Li, Y. Z. Naturforsch., B 2019, 74, 811.
|
| [58] |
Guo, T.; Wang, H.-J.; Cao, C.-C.; Chen, K.-H.; Liu, Y.; Zhang, P.-K.; Zhao, Y.-H.; Ma, Y.-C. Eur. J. Org. Chem. 2020, 24, 3613.
|
| [59] |
Du, Z.-H.; Xu, Q.-J.; Gu, G.-X. J. Saudi Chem. Soc. 2020, 24, 545.
doi: 10.1016/j.jscs.2020.05.001 |
| [60] |
Nakamura, Y.; Yoshida, S.; Hosoya, T. Chem. Lett. 2017, 46, 858.
doi: 10.1246/cl.170211 |
| [1] | 杨维清, 葛宴兵, 陈元元, 刘萍, 付海燕, 马梦林. 1,8-萘酰亚胺衍生物的设计、合成及其对半胱氨酸的识别研究[J]. 有机化学, 2024, 44(1): 180-194. |
| [2] | 徐利军, 李宗军, 韩福社, 高翔. N,N-二甲基甲酰胺促进的富勒烯稠合噁唑啉衍生物的合成[J]. 有机化学, 2024, 44(1): 242-250. |
| [3] | 张晓轲, 郑相如, 王朝永. 偶氮次甲基亚胺与氮杂二烯前体的[4+3]环加成反应构建功能化四氮杂䓬衍生物[J]. 有机化学, 2023, 43(9): 3180-3187. |
| [4] | 关丽, 周艳艳, 毛永爆, 付恺森, 关文惠, 付义乐. 甲川链修饰菁染料的合成研究进展[J]. 有机化学, 2023, 43(8): 2682-2698. |
| [5] | 刘长俊, 胡慧玲, 刘宬宏, 朱超杰, 唐天地. 介孔ETS-10沸石担载Pd高效催化内炔氧化制备1,2-二酮[J]. 有机化学, 2023, 43(8): 2953-2960. |
| [6] | 武学丹, 徐瑞祥, 方霄龙, 张克华, 金杰. 青藤碱N-四氮唑和N-噁二唑杂环衍生物的设计与合成[J]. 有机化学, 2023, 43(7): 2506-2518. |
| [7] | 孙李星, 孙婷婷, 王海清, 吴淑芳, 王小烨, 刘天雅, 张宇辰. Lewis酸催化下3-烷基-2-吲哚烯与α,β-不饱和N-磺酰基亚胺的[2+4]环化反应[J]. 有机化学, 2023, 43(6): 2178-2188. |
| [8] | 王启帆, 张源泉, 幸丽, 周远香, 龚晨裕, 何帮灿, 张念, 吴拥军, 薛伟. 含1,2,4-三唑并[3,4-b]-1,3,4-噻二唑杨梅素衍生物的设计、合成及生物活性研究[J]. 有机化学, 2023, 43(4): 1525-1536. |
| [9] | 潘永周, 蒙秀金, 王迎春, 何慕雪. 电化学固定CO2构建羧酸衍生物的研究进展[J]. 有机化学, 2023, 43(4): 1416-1434. |
| [10] | 陈深豪, 邹松, 席婵娟. 光催化苯乙烯与BrCF2CO2Me的2∶2偶联反应: 双-二氟乙酸酯己雌酚衍生物的合成[J]. 有机化学, 2023, 43(3): 1157-1167. |
| [11] | 宋树勇, 徐森苗. 三氟甲基烯烃的选择性C-F键活化最新进展[J]. 有机化学, 2023, 43(2): 411-425. |
| [12] | 刘鹏, 钟富明, 廖礼豪, 谭伟强, 赵晓丹. 炔烃参与的去芳构化反应构建螺环己二烯酮类化合物的研究进展[J]. 有机化学, 2023, 43(12): 4019-4035. |
| [13] | 王永玲, 张铁欣, 张栩铭, 孙晗扬, 冷津瑶, 李亚明. 可见光催化N-芳基乙醛酸亚胺脱羧烷基化合成非天然氨基酸衍生物[J]. 有机化学, 2023, 43(12): 4284-4293. |
| [14] | 周鹏, 朱伟明, 张建涛, 肖朵朵, 郭祥峰, 刘卫兵. 钴催化芳基烯烃氧烷基化反应: 快速获得α-烷基取代苯乙酮衍生物[J]. 有机化学, 2023, 43(11): 3939-3944. |
| [15] | 孙美娇, 谭晶, 谭玉, 彭进松, 陈春霞. 钯催化3-(2-氨基嘧啶-4-基)吲哚2位C—H键芳基化反应的研究[J]. 有机化学, 2023, 43(11): 3945-3959. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||