有机化学 ›› 2022, Vol. 42 ›› Issue (8): 2342-2354.DOI: 10.6023/cjoc202203038 上一篇 下一篇
综述与进展
白瑞a, 刘旭娟a, 罗文钰a, 刘珊珊b,*( ), 焦林郁a,*(
), 焦林郁a,*( )
)
收稿日期:2022-03-21
修回日期:2022-04-22
发布日期:2022-05-17
通讯作者:
刘珊珊, 焦林郁
作者简介:基金资助:
Rui Baia, Xujuan Liua, Wenyu Luoa, Shanshan Liub( ), Linyu Jiaoa(
), Linyu Jiaoa( )
)
Received:2022-03-21
Revised:2022-04-22
Published:2022-05-17
Contact:
Shanshan Liu, Linyu Jiao
About author:Supported by:文章分享
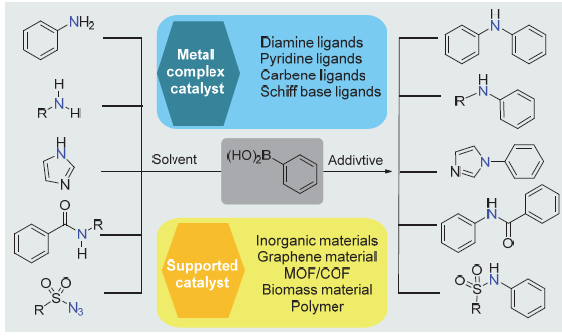
作为C—N键的经典构筑方式, 最近Chan-Lam偶联反应的研究取得了长足发展, 反应体系更加温和绿色, 特别是多相催化体系相关研究, 为催化剂的性能提升、回收和重复使用奠定了基础. 从催化剂载体和有机配体的设计、合成及性能研究出发, 综述了近年来负载型和配位型多相催化剂在Chan-Lam偶联反应中的应用.
白瑞, 刘旭娟, 罗文钰, 刘珊珊, 焦林郁. 多相催化体系下Chan-Lam偶联反应的研究进展[J]. 有机化学, 2022, 42(8): 2342-2354.
Rui Bai, Xujuan Liu, Wenyu Luo, Shanshan Liu, Linyu Jiao. Research Progress of Chan-Lam Coupling Reaction in Heterogeneous Catalysis[J]. Chinese Journal of Organic Chemistry, 2022, 42(8): 2342-2354.
| [1] |
Ullmann, F. Ber. Dtsch. Chem. Ges. 1903, 36, 2382.
doi: 10.1002/cber.190303602174 |
| [2] |
Goldberg, I. Ber. Dtsch. Chem. Ges. 1906, 39, 1691.
doi: 10.1002/cber.19060390298 |
| [3] |
Paul, F.; Patt, J.; Hartwig, J. F. J. Am. Chem. Soc. 1994, 116, 5969.
doi: 10.1021/ja00092a058 |
| [4] |
Guram, A. S.; Buchwald, S. L. J. Am. Chem. Soc. 1994, 116, 7901.
doi: 10.1021/ja00096a059 |
| [5] |
Chan, D. M. T.; Monaco, K. L.; Wang, R. P. Tetrahedron Lett. 1998, 39, 2933.
doi: 10.1016/S0040-4039(98)00503-6 |
| [6] |
Lam, P.; Clark, C. G.; Saubern, S.; Adams, J.; Combs, A. J. Tetrahedron Lett. 1998, 39, 2941.
|
| [7] |
Evans, D. A.; Katz, J. L.; West, T. R. Tetrahedron Lett. 1998, 39, 2937.
doi: 10.1016/S0040-4039(98)00502-4 |
| [8] |
Cheng, G.; Luo, M. Eur. J. Org. Chem. 2011, 2519.
|
| [9] |
Ma, X.; Liu, F.; Mo, D. Chin. J. Org. Chem. 2017, 37, 1069. (in Chinese)
doi: 10.6023/cjoc201702001 |
|
(马小盼, 刘凤萍, 莫冬亮, 有机化学, 2017, 37, 1069.)
doi: 10.6023/cjoc201702001 |
|
| [10] |
Duan, X.; Liu, N.; Wang, J.; Ma, J. Chin. J. Org. Chem. 2019, 39, 661. (in Chinese)
|
|
(段希焱, 刘宁, 王佳, 马军营, 有机化学, 2019, 39, 661.)
doi: 10.6023/cjoc201808015 |
|
| [11] |
Zhang, Y.; Zhang, M.; Yang, J; Ding, L.; Xu, J.; Xiong, S. Nanoscale 2016, 8, 15978.
doi: 10.1039/C6NR05078F |
| [12] |
Tian, Z.; Li, Q.; Yan, L.; Ai, S. Catal. Commun. 2015, 61, 97.
doi: 10.1016/j.catcom.2014.12.019 |
| [13] |
Jain, S. L.; Rana, B. S.; Singh, B.; Sinha, A. K.; Bhaumik, A.; Nandi, M.; Sain, B. Green Chem. 2010, 12, 374.
doi: 10.1039/b917382j |
| [14] |
Ganai, A. K.; Bhardwaj, R.; Hotha, S. New J. Chem. 2010, 34, 2662.
doi: 10.1039/c0nj00292e |
| [15] |
Sharma, H.; Mahajan, H.; Jamwal, B.; Paul, S. Catal. Commun. 2018, 107, 68.
doi: 10.1016/j.catcom.2018.01.016 |
| [16] |
Jamwal, B.; Kaur, M.; Sharma, H.; Khajuria, C.; Paul, S.; Clark, J. H. New J. Chem. 2019, 43, 4919.
doi: 10.1039/C8NJ05050C |
| [17] |
Sandip, P.; Vibhute, P. M.; Mhaldar, D. S.; Gaikwad, R. V.; Shejwal, D. M. Monatsh. Chem. 2020, 151, 87.
doi: 10.1007/s00706-019-02529-w |
| [18] |
Sharma, C.; Sharma, N.; Sharma, S.; Sharma, S.; Paul, S. Curr. Res. Green Sustainable Chem. 2021, 4, 100133.
doi: 10.1016/j.crgsc.2021.100133 |
| [19] |
Garnier, T.; Sakly, R.; Danel, M.; Chassaing, S.; Pale, P. Synthesis 2016, 48, 1223.
|
| [20] |
You, C.R.; Yao, F.; Yan, T.; Cai, M. Z. RSC Adv. 2016, 6, 43605.
doi: 10.1039/C6RA04298H |
| [21] |
Kantam, M. L.; Gopaldasu, T.; Venkanna, C. S. J. Org. Chem. 2006, 71, 9522.
doi: 10.1021/jo0614036 |
| [22] |
Sarmah, M.; Dewan, A.; Boruah, P. K.; Das, M. R.; Bora, U. Appl. Organomet. Chem. 2020, 34, 1.
|
| [23] |
Lee, C.; Wei, X.; Kysar, J. W. Science 2008, 321, 385.
doi: 10.1126/science.1157996 |
| [24] |
Georgakilas, V.; Otyepka, M.; Bourlinos, A. B. Chem. Rev. 2012, 112, 6156.
doi: 10.1021/cr3000412 pmid: 23009634 |
| [25] |
Mittal, A.; Kumari, S.; Parmanand; Yadav, D.; Sharma, S. K. Appl. Organomet. Chem. 2019, 34, 1.
|
| [26] |
Seyedi, N.; Nejad, M. S.; Saidi, K.; Sheibani, H. Appl. Organomet. Chem. 2019, 23, 527.
doi: 10.1002/aoc.1565 |
| [27] |
Sharma, N.; Choudhary, A.; Kaur, M.; Sharma, C.; Paul, S.; Gupta, M. RSC Adv. 2020, 10, 30048.
doi: 10.1039/D0RA01540G |
| [28] |
Di, J. Q.; Zhang, M.; Chen, Y. X.; Wang, J. X.; Geng, S. S.; Tang, J. Q.; Zhang, Z. H. Green Chem. 2021, 23, 1041.
doi: 10.1039/D0GC03400B |
| [29] |
Yaghi, O. M.; Li, G.; Li, H. Nature 1995, 378, 703.
doi: 10.1038/378703a0 |
| [30] |
Côté, A. P.; Benin, A. I.; Ockwig, N. W.; O'Keeffe, M.; Matzger, A. J.; Yaghi, O. M. Science 2005, 310, 1166.
doi: 10.1126/science.1120411 |
| [31] |
Dinga, S. Y.; Wang, W. Chem. Soc. Rev. 2013, 42, 548.
doi: 10.1039/C2CS35072F |
| [32] |
Asiri, A. M.; Garcia, H. Chem. Soc. Rev. 2015, 44, 1922.
doi: 10.1039/C4CS00254G |
| [33] |
Antonietti, M.; Thomas, A.; Fernando, M.; Guillermo, C. Angew. Chem., Int. Ed. 2008, 47, 3450.
doi: 10.1002/anie.200705710 |
| [34] |
Campbell, N. L.; Clowes, R.; Ritchie, L. K. Chem. Mater. 2009, 21, 204.
doi: 10.1021/cm802981m |
| [35] |
Khosravi, A.; Mokhtari, J.; Naimi-Jamal, M. R.; Tahmasebi, S.; Panahi, L. RSC Adv. 2017, 7, 46022.
doi: 10.1039/C7RA09772G |
| [36] |
Han, Y.; Zhang, M.; Zhang, Y. Q.; Zhang, Z. H. Green Chem. 2018, 20, 4891.
doi: 10.1039/C8GC02611D |
| [37] |
Muoz, A.; Leo, P.; Orcajo, G.,; Martínez, F.; Calleja, G. ChemCatChem. 2019, 11, 3376.
doi: 10.1002/cctc.201900906 |
| [38] |
Qian,. W. Z.; He,. Y. F.; Wang,. J. F.; Chen,. J.; Wang,. R. M. Chin. Poly. Bull. 2017, 4, 1. (in Chinese)
|
|
(钱文珍, 何玉凤, 王建凤, 陈静, 王荣民, 高分子通报, 2017, 4, 1.)
|
|
| [39] |
Chen, X.; Chen, C. X.; Peng, J. S. Chin. J. Org. Chem. 2021, 41, 1319 (in Chinses).
doi: 10.6023/cjoc202007063 |
|
(陈鑫, 陈春霞, 彭进松, 有机化学, 2021, 41, 1319.)
doi: 10.6023/cjoc202007063 |
|
| [40] |
Choi, C. Y.; Nam, J. P.; Nah, J. W. J. Ind. Eng. Chem. 2016, 33, 1.
|
| [41] |
Jeremic, S.; Djokic, L.; Ajdai, V.; Boinovi, N.; Nikodinovic-Runic, J.; Opsenica, L. Int. J. Biol. Macromol. 2019, 129, 351.
doi: S0141-8130(18)34921-3 pmid: 30710586 |
| [42] |
Sharma, S.; Kaur, M., Sharma, C.; Choudhary, A.; Paul, S. ACS Omega. 2021, 6, 19529.
doi: 10.1021/acsomega.1c01830 |
| [43] |
Seyedi, N.; Zahedifar, M. Appl. Organomet. Chem. 2021, 35, e6364.
|
| [44] |
Mugemana, C.; Fustin, C. A.; Gohy, J. F. Macromol. Rapid. Commun. 2013, 34, 962.
doi: 10.1002/marc.201300214 |
| [45] |
Schmidt, J.; Weber, J.; Epping, J. D. Adv. Mater. 2009, 21, 702.
doi: 10.1002/adma.200802692 |
| [46] |
Gary, C. H.; Chiang; Thomas, O. Org. Lett. 2004, 6, 3079.
pmid: 15330592 |
| [47] |
Islam, M.; Mondal, S.; Mondal, P.; Roy, A. S.; Tuhina, K.; Mobarok, M. Catal. Lett. 2011, 141, 1171.
doi: 10.1007/s10562-011-0606-2 |
| [48] |
Zhang, C.; Zhu, H.; Gang, K.; Tao, M.; Zhang, W.; Ma, N. React. Funct. Polym. 2021, 160, 104831.
doi: 10.1016/j.reactfunctpolym.2021.104831 |
| [49] |
Collman, J. P.; Zhong, M. Org. Lett. 2000, 2, 1233.
pmid: 10810715 |
| [50] |
Hay, A. S. J. Org. Chem. 1962, 27, 3320.
doi: 10.1021/jo01056a511 |
| [51] |
Onaka, T.; Umemoto, H.; Miki, Y.; Nakamura, A.; Maegawa, T. J. Org. Chem. 2014, 79, 6703.
doi: 10.1021/jo500862t |
| [52] |
Subhasish, R.; Manas, J. S.; Bishwapran, K.; Phukan, P. Chem. Commun. 2016, 52, 1170.
doi: 10.1039/C5CC04619J |
| [53] |
Jia, X. F.; Peng, P.; Cui, J.; Xin, N. N.; Huang, X. Q. Asian J. Org. Chem. 2018, 7, 1093.
doi: 10.1002/ajoc.201800153 |
| [54] |
Correa, A.; Martin, R. Angew. Chem., Int. Ed. 2009, 48, 6201.
doi: 10.1002/anie.200900667 |
| [55] |
Ohishi, T.; Nishiura, M.; Hou, Z. Angew. Chem.,Int. Ed. 2008, 47, 5792.
doi: 10.1002/anie.200801857 |
| [56] |
Liu, J.; Zhang, R.; Wang, S.; Sun, W.; Xia, C. Org. Lett. 2009, 11, 1321.
doi: 10.1021/ol9001027 |
| [57] |
Martin, D.; Kehrli, S.; Augustin, M.; Clavier, H.; Mauduit, M.; Alexakis, A. J. Am. Chem. Soc. 2006, 128, 8416.
pmid: 16802804 |
| [58] |
Gajare, S.; Jagadale, M.; Naikwade, A.; Bansode, P.,; Rashinkar, G. Appl. Organometal Chem. 2019, 33, e4915.
doi: 10.1002/aoc.4915 |
| [59] |
Cope, J. D.; Sheridan, P. E.; Galloway, C. J.; Awoyemi, R. F.; Emerson, J. P. Organometallics 2020, 39, 4457.
doi: 10.1021/acs.organomet.0c00552 |
| [60] |
Zhang, M. Y.; Xu, Z. B.; Shi, D. B. Tetrahedron 2021, 79, 131861.
doi: 10.1016/j.tet.2020.131861 |
| [61] |
Hie, L.; Fine, N. N. F.; Shah, T. K.; Baker, E. L.; Hong, X.; Yang, Y. F.; Liu, P.; Houk, K. N.; Garg, N. K. Nature 2015, 524, 79.
doi: 10.1038/nature14615 |
| [62] |
Sergeev, A. G.; Hartwig, J. F. Science 2011, 332, 439.
doi: 10.1126/science.1200437 pmid: 21512027 |
| [63] |
Ando, S.; Hirota, Y.; Matsunaga, H.; Ishizuka, T.M. Tetrahedron Lett. 2019, 60, 1277.
doi: 10.1016/j.tetlet.2019.04.004 |
| [64] |
Velusamy, S.; Punniyamurthy, T. Eur. J. Org. Chem. 2003, 3913.
|
| [65] |
Kaboudin, B.; Abedi, Y.; Yokomatsu, T. Eur. J. Org. Chem. 2011, 6656.
|
| [66] |
Sarmah, G.; Dewan, A.; Bora, U. Tetrahedron Lett. 2014, 55, 31.
doi: 10.1016/j.tetlet.2013.10.084 |
| [67] |
Sun, W.; Xia, C. G.; Wang, H. W. New J. Chem. 2002, 226, 755.
|
| [68] |
Xue, L.; Zhou, D. J.; Tang, L. React. Funct. Polym. 2004, 58, 117.
doi: 10.1016/j.reactfunctpolym.2003.10.003 |
| [69] |
Hu, D. D.; Cui, Y. L.; Dong, X. L. React. Funct. Polym. 2001, 48, 201.
doi: 10.1016/S1381-5148(01)00053-0 |
| [70] |
Shweta, K.; Devendra, D. P. Tetrahedron Lett. 2015, 56, 4135.
doi: 10.1016/j.tetlet.2015.05.049 |
| [71] |
Kumar, A.; Layek, S.; Agrahari, B.; Kujur, S.; Pathak, D. D. ChemistrySelect 2019, 4, 1337.
doi: 10.1002/slct.201803113 |
| [72] |
Akatyev, N.; Kudryavtsev, K.; Belokon, Y. ChemCatChem. 2020, 12, 3010.
doi: 10.1002/cctc.202000212 |
| [1] | 刘继宇, 李圣玉, 陈款, 朱茵, 张元. 三苯胺功能化有序介孔聚合物作为无金属光催化剂用于二硫化物合成[J]. 有机化学, 2024, 44(2): 605-612. |
| [2] | 黄志友, 杨平, 何波, 欧文霞, 袁思雨. 吗啉磺酰胺化合物的设计、合成及其抑制大豆萌芽活性的研究[J]. 有机化学, 2024, 44(1): 309-315. |
| [3] | 吴文倩, 陈春霞, 彭进松, 李占宇. 羰基α-位胺化反应研究进展[J]. 有机化学, 2023, 43(8): 2743-2763. |
| [4] | 丁俊, 史啸坤, 郝宇, 白贺元, 张书宇. 银催化的β,γ-不饱和酰胺的不对称γ-胺化反应[J]. 有机化学, 2023, 43(8): 2946-2952. |
| [5] | 欧世国, 柴瑞瑞, 李家豪, 王大伟, 桑欣欣. 金属-有机框架衍生的植酸铁催化氢转移高效制备2-芳基苯并噁唑[J]. 有机化学, 2023, 43(8): 2934-2945. |
| [6] | 范威. O2促进下五元环烯胺的C—H亚胺化[J]. 有机化学, 2023, 43(7): 2492-2498. |
| [7] | 黄丽珠, 刘云云, 万结平. 烯胺酮平台构建转化生物质产品Cyrene为增值化合物[J]. 有机化学, 2023, 43(6): 2096-2103. |
| [8] | 吴江龙, 王中杰, 王晨宇, 王彦, 李红俊, 罗辉, 李昊, 王富强, 李典军, 杨金会. 以氨基氰为原料合成含氮化合物的研究进展[J]. 有机化学, 2023, 43(2): 436-454. |
| [9] | 王川川, 马志伟, 侯学会, 杨龙华, 陈亚静. N-Ts氰胺在有机合成中的研究与应用[J]. 有机化学, 2023, 43(1): 74-93. |
| [10] | 张文生, 李焱, 崔海燕, 苏小莉, 徐素鹏. 邻甲酰基苯甲酸甲酯还原胺化/内酰胺化一锅法合成N-取代异吲哚-1-酮[J]. 有机化学, 2022, 42(8): 2456-2461. |
| [11] | 代增进, 张绪穆, 殷勤. 铵盐为胺源的不对称还原胺化反应研究进展[J]. 有机化学, 2022, 42(8): 2261-2274. |
| [12] | 喻晓哓, 柏汪恒, 朱建业, 张雨婷, 张梦茹, 吴际伟. 碘化铵催化sp3 C—H双胺化反应合成喹唑啉-4(3H)-酮[J]. 有机化学, 2022, 42(8): 2449-2455. |
| [13] | 肖朵朵, 刘海灵, 周鹏, 张建涛, 刘卫兵. I2/叔丁基过氧化氢(TBHP)促进烯烃和N,N-二甲基甲酰胺的氧化-酰胺化反应: 一种制备芳基-α-酮酰胺衍生物的简易方法[J]. 有机化学, 2022, 42(5): 1438-1442. |
| [14] | 肖剑, 武志英, 陈姿依, 赵朋飞, 刘春艳. 四乙烯五胺功能化酚醛树脂作为Knoevenagel缩合反应的高活性酸碱双功能催化剂[J]. 有机化学, 2022, 42(4): 1179-1187. |
| [15] | 韩高旭, 许红涛, 侯卫. 铑(III)催化的C(sp3)—H官能团化[J]. 有机化学, 2022, 42(2): 391-423. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||