有机化学 ›› 2023, Vol. 43 ›› Issue (7): 2519-2527.DOI: 10.6023/cjoc202211008 上一篇 下一篇
研究论文
收稿日期:2022-11-08
修回日期:2023-01-17
发布日期:2023-02-14
通讯作者:
江俊
基金资助:
Xiaoping Xu, Yifei Zhang, Xiaoyu Mo, Jun Jiang( )
)
Received:2022-11-08
Revised:2023-01-17
Published:2023-02-14
Contact:
Jun Jiang
Supported by:文章分享
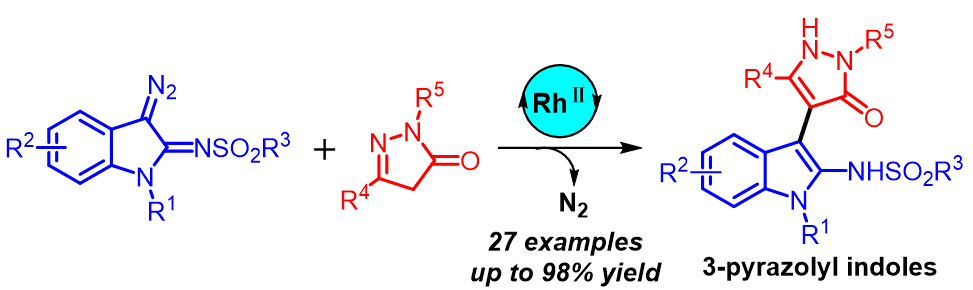
报道了一种在Rh2(OAc)4存在下α-亚胺卡宾和吡唑啉酮的高效C—H官能团化反应. 该方法通过C—C键的形成为构建结构多样的3-吡唑基吲哚化合物提供了一种快速、直接的途径, 反应具有中等至优异的产率和良好的官能团耐受性.
许晓萍, 张翼飞, 莫小渝, 江俊. 铑催化3-重氮吲哚-2-亚胺与吡唑啉酮的C—H官能团化反应制备3-吡唑基吲哚[J]. 有机化学, 2023, 43(7): 2519-2527.
Xiaoping Xu, Yifei Zhang, Xiaoyu Mo, Jun Jiang. Rh-Catalyzed C—H Functionalization Reaction between 3-Diazoindolin-2-imines and Pyrazolones for the Construction of 3-Pyrazolyl Indoles[J]. Chinese Journal of Organic Chemistry, 2023, 43(7): 2519-2527.
| Entry | Catalyst | Solvent | Temp./℃ | Yieldb/% |
|---|---|---|---|---|
| 1 | Pd2(OAc)4 | DCE | 70 | 0 |
| 2 | AgNO3 | DCE | 70 | 0 |
| 3 | Cu2O | DCE | 70 | 70 |
| 4 | Rh2(Oct)4 | DCE | 70 | 86 |
| 5 | Rh2(OAc)4 | DCE | 70 | 92 |
| 6 | Rh2(OAc)4 | CHCl3 | 70 | 56 |
| 7 | Rh2(OAc)4 | EA | 70 | 55 |
| 8 | Rh2(OAc)4 | Toluene | 70 | 49 |
| 9 | Rh2(OAc)4 | DCE | rt | Trace |
| 10 | — | DCE | 70 | 0 |
| 11c | Rh2(OAc)4 | DCE | 70 | 98 |
| Entry | Catalyst | Solvent | Temp./℃ | Yieldb/% |
|---|---|---|---|---|
| 1 | Pd2(OAc)4 | DCE | 70 | 0 |
| 2 | AgNO3 | DCE | 70 | 0 |
| 3 | Cu2O | DCE | 70 | 70 |
| 4 | Rh2(Oct)4 | DCE | 70 | 86 |
| 5 | Rh2(OAc)4 | DCE | 70 | 92 |
| 6 | Rh2(OAc)4 | CHCl3 | 70 | 56 |
| 7 | Rh2(OAc)4 | EA | 70 | 55 |
| 8 | Rh2(OAc)4 | Toluene | 70 | 49 |
| 9 | Rh2(OAc)4 | DCE | rt | Trace |
| 10 | — | DCE | 70 | 0 |
| 11c | Rh2(OAc)4 | DCE | 70 | 98 |
| [1] |
(a) Kumar, D.; Kumar, N. M.; Chang, K.-H.; Shah, K. Eur. J. Med. Chem. 2010, 45, 4664.
doi: 10.1016/j.ejmech.2010.07.023 |
|
(b) Kumar, D.; Kumar, N. M.; Noel, B.; Shah, K. Eur. J. Med. Chem. 2012, 55, 432.
doi: 10.1016/j.ejmech.2012.06.047 |
|
|
(c) Shi, Z.-C.; Zhao, Z.-G.; Huang, M.-W.; Fu, X.-L. C. R. Chim. 2015, 18, 1320.
doi: 10.1016/j.crci.2015.09.005 |
|
|
(d) El-Sayed, W. A.; Abbas, H. S.; Mageid, R. E. A.; Magdziarz, T. Med. Chem. Res. 2016, 25, 339.
doi: 10.1007/s00044-015-1488-4 |
|
| [2] |
Pulla, R. S.; Ummadi, N.; Gudi, Y.; Venkatapuram, P.; Adivireddy, P. J. Heterocycl. Chem. 2018, 55, 115.
doi: 10.1002/jhet.3012 |
| [3] |
Reddy, M. V. R.; Billa, V. K.; Pallela, V. R.; Mallireddigari, M. R.; Boominathan, R.; Gabriel, J. L.; Reddy, E. P. Bioorg. Med. Chem. 2008, 16, 3907.
doi: 10.1016/j.bmc.2008.01.047 |
| [4] |
Esvan, Y. J.; Giraud, F.; Pereira, E.; Suchaud, V.; Nauton, L.; Théry, V.; Dezhenkova, L. G.; Kaluzhny, D. N.; Mazov, V. N.; Shtil, A. A.; Anizon, F.; Moreau, P. Bioorg. Med. Chem. 2016, 24, 3116.
doi: 10.1016/j.bmc.2016.05.032 |
| [5] |
(a) Jakše, R.; Svete, J.; Stanovnik, B.; Golobič, A. Tetrahedron 2004, 60, 4601.
doi: 10.1016/j.tet.2004.03.075 pmid: 23894213 |
|
(b) Braña, M. F.; Gradillas, A.; Ovalles, A. G.; López, B.; Acero, N.; Llinares, F.; Mingarro, D. M. Bioorg. Med. Chem. 2006, 14, 9.
doi: 10.1016/j.bmc.2005.09.059 pmid: 23894213 |
|
|
(c) Conchon, E.; Aboab, B.; Golsteyn, R. M.; Cruzalegui, F.; Edmonds, T.; Léonce, S.; Pfeiffer, B.; Prudhomme, M. Eur. J. Med. Chem. 2006, 41, 1470.
doi: 10.1016/j.ejmech.2006.06.012 pmid: 23894213 |
|
|
(d) Gupton, J. T.; Telang, N.; Gazzo, D. F.; Barelli, P. J.; Lescalleet, K. E.; Fagan, J. W.; Mills, B. J.; Finzel, K. L.; Kanters, R. P. F.; Crocker, K. R.; Dudek, S. T.; Lariviere, C. M.; Smith, S. Q.; Keertikar, K. M. Tetrahedron 2013, 69, 5829.
pmid: 23894213 |
|
|
(e) Suchaud, V.; Gavara, L.; Saugues, E.; Nauton, L.; Théry, V.; Anizon, F.; Moreau, P. Bioorg. Med. Chem. 2013, 21, 4102.
doi: 10.1016/j.bmc.2013.05.011 pmid: 23894213 |
|
| [6] |
Fabitha, K.; Chandrakanth, M.; Pramod, R. N.; Arya, C. G.; Li, Y.-P.; Banoth, J. ChemistrySelect 2022, 7, 2.
|
| [7] |
(a) Davies, H. M. L.; Manning, J. R. Nature 2008, 451, 417.
doi: 10.1038/nature06485 |
|
(b) Ran, R.-Q.; He, J.; Xiu, S.-D.; Wang, K.-B.; Li, C.-Y. Org. Lett. 2014, 16, 3704.
doi: 10.1021/ol501514b |
|
|
(c) Li, X.-X.; Li, H.; Song, W.-Z.; Tseng, P. S.; Liu, L.-Y.; Guzei, I. A.; Tang, W.-P. Angew. Chem., Int. Ed. 2015, 54, 12905.
doi: 10.1002/anie.v54.44 |
|
|
(d) Jia, M.-Q.; Ma, S.-M. Angew. Chem., Int. Ed. 2016, 55, 9134.
doi: 10.1002/anie.v55.32 |
|
|
(e) Ko, G. H.; Son, J.-Y.; Kim, H.; Maeng, C.; Baek, Y.; Seo, B.; Um, K.; Lee, P. H. Adv. Synth. Catal. 2017, 359, 3362.
doi: 10.1002/adsc.v359.19 |
|
|
(f) Lang, B.; Suleman, M.; Lu, P.; Wang, Y.-G. Chin. J. Org. Chem. 2020, 40, 3300 (in Chinese).
doi: 10.6023/cjoc202005011 |
|
|
(郎勃, Muhanmmad, Suleman, 吕萍, 王彦广, 有机化学, 2020, 40, 3300.)
doi: 10.6023/cjoc202005011 |
|
|
(g) He, Y.; Huang, Z.-L.; Wu, K.-K.; Ma, J.; Zhou, Y.-G.; Yu, Z.-K. Chem. Soc. Rev. 2022, 51, 2759.
doi: 10.1039/D1CS00895A |
|
| [8] |
(a) Luo, H.-Q.; Wu, G.-J.; Zhang., Y.; Wang, J.-B. Angew. Chem., nt. Ed. 2015, 54, 14503.
|
|
(b) Wei, F.; Song, C.-L.; Ma, Y.-D.; Zhou, L.; Tung, C.-H.; Xu, Z.-H. Sci. Bull. 2015, 60, 1479.
doi: 10.1007/s11434-015-0874-0 |
|
|
(c) Ding, H.-L.; Bai, S.-L.; Lu, P.; Wang, Y.-G. Org. Lett. 2017, 19, 4604.
doi: 10.1021/acs.orglett.7b02211 |
|
|
(d) Solé, D.; Janer, F. P.; Bennasar, M. L.; Fernández, I. Eur. J. Org. Chem. 2018, 2018, 4446.
doi: 10.1002/ejoc.201800666 |
|
|
(e) Zhou, Y.-X.; Li, Z.-M.; Ma, F.-H.; Zhao, C.; Lu, P.; Wang, Y.-G. J. Org. Chem. 2019, 84, 6655.
doi: 10.1021/acs.joc.9b00191 |
|
|
(f) Laha, D.; Bhat, R. G. Asian J. Org. Chem. 2020, 9, 918.
doi: 10.1002/ajoc.v9.6 |
|
|
(g) Batista, V. F.; Pinto, D. C. G. A.; Silva, A. M. S. ACS Catal. 2020, 10, 10096.
doi: 10.1021/acscatal.0c02776 |
|
|
(h) He, F.-F.; Empel, C.; Koenigs, R. M. Org. Lett. 2021, 23, 6719.
doi: 10.1021/acs.orglett.1c02289 |
|
|
(i) Liu, B.; Xu, M.-H. Chin. J. Chem. 2021, 39, 1911.
doi: 10.1002/cjoc.v39.7 |
|
|
(j) Wang, Y.-M.; Wang, H.-W.; Liu, Z.-H. Acta Chim. Sinica 2021, 79, 1085 (in Chinese).
doi: 10.6023/A21040179 |
|
|
(王也铭, 王宏伟, 刘兆洪, 化学学报, 2021, 79, 1085.)
doi: 10.6023/A21040179 |
|
|
(k) Zou, Y.; Wang, P.-Y.; Kong, L.-H.; Li, X.-W. Org. Lett. 2022, 24, 3189.
doi: 10.1021/acs.orglett.2c00968 |
|
| [9] |
(a) Pal, K.; Volla, C. M. R. Chem. Rec. 2021, 21, 4032.
doi: 10.1002/tcr.v21.12 |
|
(b) Suleman, M.; Lu, P.; Wang, Y.-G. Org. Chem. Front. 2021, 8, 2059.
doi: 10.1039/D0QO01515F |
|
|
(c) Akter, M.; Rupa, K.; Anbarasan, P. Chem. Rev. 2022, 122, 13108.
doi: 10.1021/acs.chemrev.1c00991 |
|
| [10] |
(a) Du, Z.; Xing, Y.-P.; Lu, P.; Wang, Y.-G. Org. Lett. 2015, 17, 1192.
doi: 10.1021/acs.orglett.5b00089 |
|
(b) Li, Z.-M.; Zhou, X.-R.; Lu, P.; Wang, Y.-G. J. Org. Chem. 2016, 81, 9433.
doi: 10.1021/acs.joc.6b01678 |
|
|
(c) Li, Z.-M.; Xie, J.-W.; Wu, L.; Suleman, M.; Lu, P.; Wang, Y.-G. Tetrahedron 2020, 76, 131371.
doi: 10.1016/j.tet.2020.131371 |
|
| [11] |
Xing, Y.-P.; Sheng, G.-R.; Wang, J.; Lu, P.; Wang, Y.-G. Org. Lett. 2014, 16, 1244.
doi: 10.1021/ol5002347 |
| [12] |
Qi, J.; Wang, Z. B.; Lang, B.; Lu, P.; Wang, Y.-G. J. Org. Chem. 2017, 82, 12640.
doi: 10.1021/acs.joc.7b02423 |
| [13] |
Qian, J.; Lin, Z.-W.; Wang, Z.-B.; Peng, Z.-X.; Wu, L.; Lu, P.; Wang, Y.-G. J. Org. Chem. 2019, 84, 6395.
doi: 10.1021/acs.joc.9b00755 |
| [14] |
Liu, S.-Y.; Bao, X.-Z.; Wang, B.-M. Chem. Commun. 2018, 54, 11515.
doi: 10.1039/C8CC06196C |
| [15] |
(a) Wang, L.-S.; Wu, Y.; Liu, Y.; Yang, H.; Liu, X.; Wang, J.-Y.; Li, X.-X.; Jiang, J. Org. Lett. 2017, 19, 782.
doi: 10.1021/acs.orglett.6b03752 |
|
(b) Liu, S.-Y.; Jiang, J.; Chen, J.-H.; Wei, Q.-H.; Yao, W.-F.; Xia, F.; Hu, W.-H. Chem. Sci. 2017, 8, 4312.
doi: 10.1039/C7SC00257B |
|
|
(c) Liu, Y.; Xie, P.; Li, J.-G.; Bai, W.-J.; Jiang, J. Org. Lett. 2019, 21, 4944.
doi: 10.1021/acs.orglett.9b01288 |
|
|
(d) Zhou, X.-C.; Xiong, T.; Jiang, J. Chem. Commun. 2022, 58, 8568.
doi: 10.1039/D2CC02774G |
|
| [16] |
(a) Ding, H.-L.; Wang, Z.-B.; Bai, S.-L.; Lu, P.; Wang, Y.-G. Org. Lett. 2017, 19, 6514.
doi: 10.1021/acs.orglett.7b03211 |
|
(b) Sheng, G.-R.; Ma, S.-C.; Bai, S.-L.; Qian, J.; Huang, K.; Lang, B.; Lu, P.; Wang, Y.-G. Tetrahedron 2018, 74, 2151.
doi: 10.1016/j.tet.2018.03.021 |
|
|
(c) Gao, K.; Kou, L.-Y.; Fu, R.; Bao, X.-G. Adv. Synth. Catal. 2020, 362, 1292.
doi: 10.1002/adsc.v362.6 |
|
|
(d) Fu, R.; Kou, L.-Y.; Zhou, S.-F.; Bao, X.-G. Chin. J. Chem. 2021, 39, 1565.
doi: 10.1002/cjoc.v39.6 |
|
|
(e) Zhang, W.-D.; Wei, S.-Q.; Qu, J.-P.; Wang, B.-M. Org. Biomol. Chem. 2021, 19, 4992.
doi: 10.1039/D1OB00592H |
|
|
(f) Zhang, W.-D.; Nawaz, S.; Huang, Y.; Gong, W.-J.; Wei, X.-F.; Qu, J.-P.; Wang, B.-M. Org. Biomol. Chem. 2021, 19, 10215.
doi: 10.1039/D1OB01920A |
| [1] | 董江湖, 宣良明, 王池, 赵晨熙, 王海峰, 严琼姣, 汪伟, 陈芬儿. 无过渡金属或无光催化剂条件下可见光促进喹喔啉酮C(3)—H官能团化研究进展[J]. 有机化学, 2024, 44(1): 111-136. |
| [2] | 雷容超, 兰文捷, 李梦竹, 傅滨. 苯并磺内酰胺联吡唑化合物的简便合成[J]. 有机化学, 2023, 43(7): 2553-2560. |
| [3] | 鲍志成, 李慕尧, 王剑波. 铜催化芳基重氮乙酸酯与双[(频哪醇)硼基]甲烷的偶联反应[J]. 有机化学, 2023, 43(5): 1808-1814. |
| [4] | 南宁, 吴双, 秦景灏, 李金恒. 基于硅烷化启动的环化反应研究进展[J]. 有机化学, 2023, 43(10): 3414-3453. |
| [5] | 谢阳, 宣俊. 重氮化合物作为自由基前体参与的光催化反应[J]. 有机化学, 2022, 42(12): 4247-4256. |
| [6] | 李森, 周磊. 可见光促进重氮化合物参与的自由基反应[J]. 有机化学, 2022, 42(12): 3944-3958. |
| [7] | 张骁勇, 于丽丽, 高俊芳, 宫岳, 赵玉龙. 1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)驱动的双分子硝基烷烃对重氮化合物的亲核加成反应: 多官能化腙和四氢哒嗪化合物的合成[J]. 有机化学, 2022, 42(11): 3704-3713. |
| [8] | 商铭洲, 张兰兰, 陈淼淼, 胡汪成, 何心伟, 陆红健. 铑催化的邻苯二甲酸酐与环状2-重氮-1,3-二酮和甲醇的串联C—H活化/跨环偶联/环化反应合成酯基官能化的并环异香豆素类化合物的研究[J]. 有机化学, 2022, 42(11): 3816-3823. |
| [9] | 滕明瑜, 韩涛, 黄恩和, 叶龙武. 金属卡宾参与的对映选择性去对称化反应研究进展[J]. 有机化学, 2022, 42(10): 3295-3301. |
| [10] | 李芳洁, 卢斌, 刘阳, 王晓明. 双铑(II)/Xantphos催化的C—H官能团化/烯丙基烷基化串联: 从N-芳基-α-重氮-β-酮酯简便制备3-酰基-3-烯丙基氧化吲哚衍生物[J]. 有机化学, 2022, 42(10): 3390-3397. |
| [11] | 蔡宝贵, 宣俊. 可见光诱导重氮化合物产生卡宾及其官能化反应[J]. 有机化学, 2021, 41(12): 4565-4574. |
| [12] | 罗亮, 曹晓梅, 赖国伟, 刘金香, 罗海清, 路东亮, 张勇. “水上”吡唑啉酮与三氟甲基酮的亲核加成[J]. 有机化学, 2020, 40(5): 1323-1330. |
| [13] | 张慧苗, 李灵芝, 沈方旗, 蔡涛, 沈润溥. 过渡金属催化卡宾对Si―H键的插入反应研究进展[J]. 有机化学, 2020, 40(4): 873-885. |
| [14] | 岳永双, 解正峰, 褚义成, 薛松松. 新型螺[色烯并(2,3-c)吡唑-4,1'-异苯并呋喃]-3'-酮类化合物的合成及光学性能研究[J]. 有机化学, 2020, 40(2): 501-510. |
| [15] | 王帅, 杨成, 孙硕, 孙晗力, 王剑波. 钯催化芳香溴化物与三甲基硅基重氮甲烷的还原偶联及其在芳香化合物甲基化中的应用[J]. 有机化学, 2020, 40(11): 3881-3888. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||