有机化学 ›› 2020, Vol. 40 ›› Issue (4): 856-872.DOI: 10.6023/cjoc201910039 上一篇 下一篇
综述与进展
严丽君a, 闫玉鑫a, 陈雪冰b, 王永超a
收稿日期:2019-10-31
修回日期:2019-12-02
发布日期:2020-05-06
通讯作者:
王永超, 陈雪冰
E-mail:yongchaowang126@126.com;orangekaka@126.com
基金资助:Yan Lijuna, Yan Yuxina, Chen Xuebingb, Wang Yongchaoa
Received:2019-10-31
Revised:2019-12-02
Published:2020-05-06
Supported by:文章分享
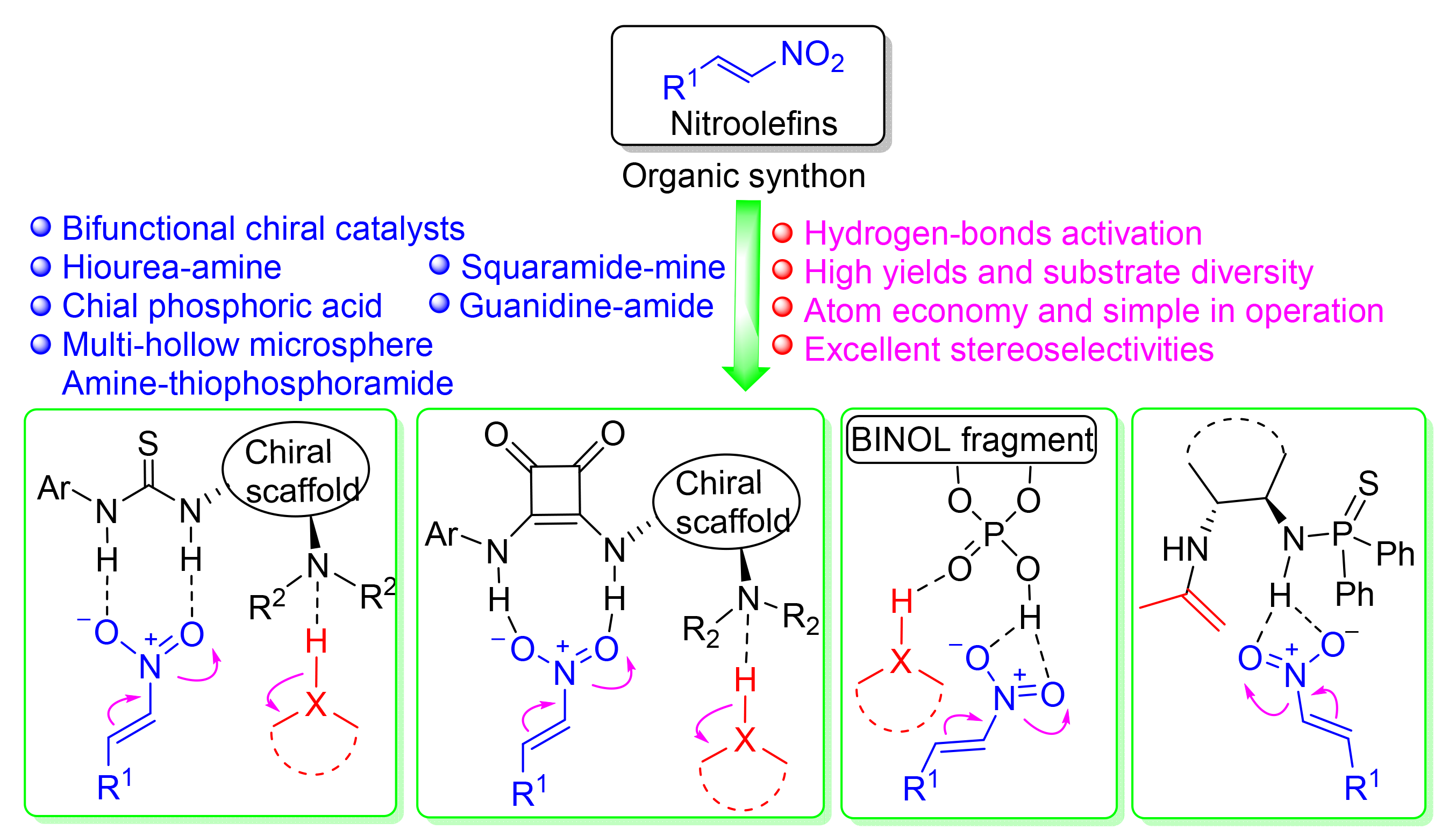
有机催化多组分不对称串联反应是构建复杂手性化合物的最有效方法之一,双功能手性催化剂是一类重要的单分子双活化有机小分子催化剂,能同时对多个反应底物进行氢键活化,实现多个新键的形成和多个手性中心的立体选择性控制.基于双功能催化剂氢键活化的硝基烯是一类重要的有机反应合成子,能参与多种有机小分子催化的串联反应.对硝基烯参与的多组分不对称串联反应,根据双功能催化剂的结构特征,从双功能硫脲-胺催化、双功能方酰胺-胺催化、其它双功能催化剂催化三个方面进行文献综述.从反应类型、反应机理、反应特点及应用等方面进行了系统地阐述,并对该领域的研究应用和发展前景进行了展望.
严丽君, 闫玉鑫, 陈雪冰, 王永超. 氢键活化的硝基烯参与的多组分不对称串联合成研究进展[J]. 有机化学, 2020, 40(4): 856-872.
Yan Lijun, Yan Yuxin, Chen Xuebing, Wang Yongchao. Advances in Multicomponent Asymmetric Cascade Synthesis Involving Hydrogen-Bond-Activated Nitroolefins[J]. Chinese Journal of Organic Chemistry, 2020, 40(4): 856-872.
| [1] For some typical references in this area, see:(a) Volla, C. M. R.; Atodiresei, I.; Rueping, M. Chem. Rev. 2013, 114, 2390. (b) Chauhan, P.; Mahajan, S.; Kaya, U.; Hack, D.; Enders, D. Adv. Synth. Catal. 2015, 357, 253. (c) Yan, L. J., Wang, Y. C. ChemistrySelect 2016, 1, 6948. (d) Cao, Y.; Jiang, X.; Liu, L.; Shen, F.; Zhang, F.; Wang, R. Angew. Chem., Int. Ed. 2011, 50, 9124. (e) Li, X.; Guo, L.; Peng, C.; Han, B. Chem. Rec. 2019, 19, 394. (f) Vinogradov, M. G.; Turova, O. V.; Zlotin, S. G. Org. Biomol. Chem. 2019, 17, 3670. (g) Wu, X.; Li, M. L.; Gong, L. Z. Acta Chim. Sinica 2013, 71, 1091(in Chinese). (吴祥, 李明丽, 龚流柱, 化学学报, 2013, 71, 1091.) (h) Han, Z. Y.; Gong, L. Z. Prog. Chem. 2018, 30, 505(in Chinese). (韩志勇, 龚流柱, 化学进展, 2018, 30, 505.) [2] (a) Shibasaki, M.; Matsunaga, S. Chem. Soc. Rev. 2006, 35, 269. (b) Georgiou, I.; Ilyashenko, G.; Whiting, A. Acc. Chem. Res. 2009, 42, 756. (c) Asano, K.; Matsubara, S. J. Am. Chem. Soc. 2011, 133, 16711. (d) Xiao, Y. C.; Chen, F. E. ChemCatChem 2019, 11, 2018. (e) Yu, X.; Wang, W. Chem.-Asian J. 2008, 3, 516. (f) Held, F. E.; Tsogoeva, S. B. Catal. Sci. Technol. 2016, 6, 645. (g) Du, L.; Peng, C.; Liao, J. Acta Chim. Sinica 2013, 71, 1239(in Chinese). (杜乐, 曹鹏, 廖建, 化学学报, 2013, 71, 1239.) [3] Hiemstra, H.; Wynberg, H. J. Am. Chem. Soc. 1981, 103, 417. [4] Okino, T.; Hoashi, Y.; Takemoto, Y. J. Am. Chem. Soc. 2003, 125, 12672. [5] For some typical references in this area, see:(a) Zhan, G.; Du, W.; Chen, Y. C. Chem. Soc. Rev. 2017, 46, 1675. (b) Okino, T.; Hoashi, Y.; Furukawa, T.; Xu, X.; Takemoto, Y. J. Am. Chem. Soc. 2005, 127, 119. (c) Liu, J. Y.; Zhao, J.; Zhang, J. L.; Xu, P. F. Org. Lett. 2017, 19, 1846. (d) Shirakawa, S.; Koga, K.; Tokuda, T.; Yamamoto, K.; Maruoka, K. Angew. Chem., Int. Ed. 2014, 53, 6220. (e) Chen, P.; Bao, X.; Zhang, L. F.; Ding, M.; Han, X. J.; Li, J.; Zhang, B. B.; Tu, Y. Q.; Fan, C. A. Angew. Chem., Int. Ed. 2011, 50, 8161. (f) Miyamura, H.; Choo, G. C.; Yasukawa, T.; Yoo, W. J.; Kobayashi, S. Chem. Commun. 2013, 49, 9917. [6] (a) Barrett, A. G.; Graboski, G. G. Chem. Rev. 1986, 86, 751. (b) Zimmer, R.; Reissig, H. U. Chem. Soc. Rev. 2014, 43, 2888. (c) Feng, J.; Li, X. J. Org. Chem. 2017, 82, 7317. (d) Gao, W.; Lv, H.; Zhang, T.; Yang, Y.; Chung, L. W.; Wu, Y. D.; Zhang, X. Chem. Sci. 2017, 8, 6419. (e) Zhang, W. S.; Xu, W. J.; Zhang, F.; Li, Y. Chin. J. Org. Chem. 2019, 39, 1277(in Chinese). (张文生, 许文静, 张斐, 李焱, 有机化学, 2019, 39, 1277.) (f) Yan, L. J.; Xu, H.; Wang, Y.; Dong, J. W.; Wang, Y. C. Chin. J. Org. Chem. 2020, 40, 284(in Chinese). (严丽君, 徐菡, 王艳, 董建伟, 王永超, 有机化学, 2020, 40, 284.) [7] Sigman, M. S.; Jacobsen, E. N. J. Am. Chem. Soc. 1998, 120, 4901. [8] (a) Pei, Z.; Li, X.; von Geldern, T. W.; Longenecker, K.; Pireh, D.; Stewart, K. D.; Backes, B. J.; Lai, C.; Lubben, T. H.; Ballaron, S. J.; Beno, D. W. A.; Kempf-Grote, A. J.; Sham, H. L.; Trevillyan, J. M. J. Med. Chem. 2007, 50, 1983. (b) Nara, S.; Tanaka, R.; Eishima, J.; Hara, M.; Takahashi, Y.; Otaki, S.; Foglesong, R. J.; Hughes, P. F.; Turkington, S.; Kanada, Y. J. Med. Chem. 2003, 46, 2467. [9] Imashiro, R.; Uehara, H.; Barbas III, C. F. Org. Lett. 2010, 12, 5250. [10] Uehara, H.; Imashiro, R.; Hernández-Torres, G.; Barbas III, C. F. Proc. Natl. Acad. Sci. U. S. A. 2010, 107, 20672. [11] Basle, O.; Raimondi, W.; Duque, M. D. M. S.; Bonne, D.; Constantieux, T.; Rodriguez, J. Org. Lett. 2010, 12, 5246. [12] Wang, Y.; Han, R. G.; Zhao, Y. L.; Yang, S.; Xu, P. F.; Dixon, D. J. Angew. Chem., Int. Ed. 2009, 48, 9834. [13] Mao, Z.; Jia, Y.; Xu, Z.; Wang, R. Adv. Synth. Catal. 2012, 354, 1401. [14] For recent reviews, see:(a) Robinson, D. E. J. E.; Bull, S. D. Tetrahedron:Asymmetry 2003, 14, 1407. (b) Keith, J. M.; Larrow, J. F.; Jacobsen, E. N. Adv. Synth. Catal. 2001, 343, 5. (c) Reetz, M. T. Angew. Chem., Int. Ed. 2001, 40, 284. (d) Vedejs, E.; Jure, M. Angew. Chem., Int. Ed. 2005, 44, 3974. [15] Roy, S.; Chen, K. Org. Lett. 2012, 14, 2496. [16] Zhou, B.; Yang, Y.; Shi, J.; Luo, Z.; Li, Y. J. Org. Chem. 2013, 78, 2897. [17] For some typical references in this area, see:(a) Pearson, W. H.; Hines, J. V. J. Org. Chem. 1989, 54, 4235. (b) Kingston, D. G.; Samranayake, G.; Ivey, C. A. J. Nat. Prod. 1990, 3, 1. (c) Slade, J.; Stanton, J. L.; Ben-David, D.; Mazzenga, G. C. J. Med. Chem. 1985, 28, 1517. (d) Le, V.; Inai, M.; Williams, R.; Kan, T. Nat. Prod. Rep. 2015, 32, 328. (e) Jiang, Y.; Chen, X.; Zheng, Y.; Xue, Z.; Shu, C.; Yuan, W.; Zhang, X. Angew. Chem., Int. Ed. 2011, 50, 7304. (f) Wang, Q.; Huang, W.; Yuan, H.; Cai, Q.; Chen, L.; Lv, H.; Zhang, X. J. Am. Chem. Soc. 2014, 136, 16120. [18] Hou, W.; Wei, Q.; Liu, G.; Chen, J.; Guo, J.; Peng, Y. Org. Lett. 2015, 17, 4870. [19] Hou, W.; Wei, Q.; Peng, Y. Adv. Synth. Catal. 2016, 358, 1035. [20] (a) Smits, R.; Cadicamo, C. D.; Burger, K.; Koksch, B. Chem. Soc. Rev. 2008, 37, 1727. (b) Mikami, K.; Itoh, Y.; Yamanaka, M. Chem. Rev. 2004, 104, 1. [21] For some recent reviews, see:(a) Zhou, Y.; Wang, J.; Gu, Z.; Wang, S.; Zhu, W.; Aceña, J. L.; Soloshonok, V. A.; Izawa, K.; Liu, H. Chem. Rev. 2016, 2, 422. (b) Yang, X.; Wu, T.; Phipps, R. J.; Toste, F. D. Chem. Rev. 2015, 2, 826. (c) Wang, J.; Sánchez-Roselló, M.; Aceña, J. L.; del Pozo, C.; Sorochinsky, A. E.; Fustero, S.; Soloshonok, V. A.; Liu, H. Chem. Rev. 2014, 114, 2432. [22] Huang, X.; Liu, M.; Jasinski, J. P.; Peng, B.; Zhang, W. Adv. Synth. Catal. 2017, 359, 1919. [23] Wang, Y.; Yu, D. F.; Liu, Y. Z.; Wei, H.; Luo, Y. C.; Dixon, D. J.; Xu, P. F. Chem.-Eur. J. 2010, 16, 3922. [24] Enders, D.; Urbanietz, G.; Cassens-Sasse, E.; Keess, S.; Raabe, G. Adv. Synth. Catal. 2012, 354, 1481. [25] Wu, M. Y.; He, W. W.; Liu, X. Y.; Tan, B. Angew. Chem., Int. Ed. 2015, 54, 9409. [26] Malerich, J. P.; Hagihara, K.; Rawal, V. H. J. Am. Chem. Soc. 2008, 130, 14416. [27] (a) Giacalone, F.; Gruttadauria, M.; Agrigento, P.; Noto, R. Chem. Soc. Rev. 2012, 41, 2406. (b) Banik, S. M.; Levina, A.; Hyde, A. M.; Jacobsen, E. N. Science 2017, 358, 761. (c) Deng, Y. H.; Zhang, X. Z.; Yu, K. Y.; Yan, X.; Du, J. Y.; Huang, H.; Fan, C. A. Chem. Commun. 2016, 52, 4183. (d) Bae, H. Y.; Song, C. E. ACS Catal. 2015, 5, 3613. (e) Kasaplar, P.; Riente, P.; Hartmann, C.; Pericàs, M. A. Adv. Synth. Catal. 2012, 354, 2905. [28] (a) Didaskalou, C.; Kupai, J.; Cseri, L.; Barabas, J.; Vass, E.; Holtzl, T.; Szekely, G. ACS Catal. 2018, 8, 7430. (b) Kucherenko, A. S.; Kostenko, A. A.; Komogortsev, A. N.; Lichitsky, B. V.; Fedotov, M. Y.; Zlotin, S. G. J. Org. Chem. 2019, 84, 4304. (c) Liu, K.; Khan, I.; Cheng, J.; Hsueh, Y. J.; Zhang, Y. J. ACS Catal. 2018, 8, 11600. (d) Vural, U.; Durmaz, M.; Sirit, A. Org. Chem. Front. 2016, 3, 730. (e)Yang, W.; Du, D. M. Org. Lett. 2010, 12, 5450. [29] For some selected reports and recent reviews, see:(a) Shi, F.; Tao, Z. L.; Luo, S. W.; Tu, S. J.; Gong, L. Z. Chem.-Eur. J. 2012, 18, 6885. (b) Xi, N.; Arvedson, S.; Eisenberg, S.; Han, N.; Handley, M.; Huang, L.; Huang, Q.; Kiselyov, A.; Liu, Q.; Lu, Y.; Nunez, G.; Osslund, T.; Powers, D.; Tasker, A. S.; Wang, L.; Xiang, T.; Xu, S.; Zhang, J.; Zhu, J.; Kendall, R.; Dominguez, C. Bioorg. Med. Chem. Lett. 2004, 14, 2905. (c) Periyasami, G.; Raghunathan, R.; Surendiran, G.; Mathivanan, N. Bioorg. Med. Chem. Lett. 2008, 18, 2342. (d) Girgis, A. S. Eur. J. Med. Chem. 2009, 44, 91. (e) Ali, M. A.; Ismail, R.; Choon, T. S.; Yoon, Y. K.; Wei, A. C.; Pandian, S.; Kumar, R. S.; Osman, H.; Manogaran, E. Bioorg. Med. Chem. Lett. 2010, 20, 7064. (f) Hong, L.; Wang, R. Adv. Synth. Catal. 2013, 355, 1023. (g) Tian, L.; Luo, Y. C.; Hu, X. Q.; Xu, P. F. Asian J. Org. Chem. 2016, 5, 580. (h) Mei, G. J.; Shi, F. Chem. Commun. 2018, 54, 6607. (i) Fang, X.; Wang, C. J. Org. Biomol. Chem. 2018, 16, 2591. (j) Cheng, D.; Ishihara, Y.; Tan, B.; Barbas III, C. F. ACS Catal. 2014, 4, 743. (k) Wang, Y. C.; Wang, J. L.; Burgess, K. S.; Zhang, J. W.; Zheng, Q. M.; Pu, Y. D.; Yan, L. J.; Chen, X. B. RSC Adv. 2018, 8, 5702. (l) Zhang, D.; Qin, Y. Acta Chim. Sinica 2013, 71, 147(in Chinese). (张丹, 秦勇, 化学学报, 2013, 71, 147.) (m) Zhang, L. L.; Zhang, J. W.; Xiang, S. H.; Guo, Z.; Tan, B. Org. Lett. 2018, 20, 6022. (n) Zhang, L. L.; Zhang, J. W.; Xiang, S. H.; Guo, Z.; Tan, B. Chin. J. Chem. 2018, 36, 1182. [30] Tian, L.; Hu, X. Q.; Li, Y. H.; Xu, P. F. Chem. Commun. 2013, 49, 7213. [31] Chen, D. F.; Zhao, F.; Hu, Y.; Gong, L. Z. Angew. Chem., Int. Ed. 2014, 53, 10763. [32] (a) Eschenbrenner-Lux, V.; Küchler, P.; Ziegler, S.; Kumar, K.; Waldmann, H. Angew. Chem., Int. Ed. 2014, 53, 2134. (b) Mengozzi, L.; Gualandi, A.; Cozzi, P. G. Chem. Sci. 2014, 5, 3915. (c) Khashper, A.; Lubell, W. D. Org. Biomol. Chem. 2014, 12, 5052. (d) Friedman, R. K.; Rovis, T. J. Am. Chem. Soc. 2009, 131, 10775. (e) Perreault, S.; Rovis, T. Chem. Soc. Rev. 2009, 38, 3149. [33] Blümel, M.; Chauhan, P.; Hahn, R.; Raabe, G.; Enders, D. Org. Lett. 2014, 16, 6012. [34] Blüemel, M.; Chauhan, P.; Vermeeren, C.; Dreier, A.; Lehmann, C.; Enders, D. Synthesis 2015, 47, 3618. [35] For recent reviews on the synthesis of tetrahydropyrans, see:(a) Yeung, K. S.; Paterson, I. Chem. Rev. 2005, 105, 4237. (b) Nising, C. F.; Braese, S. Chem. Soc. Rev. 2012, 41, 988. (c) Larrosa, I.; Romea, P.; Urpí. F. Tetrahedron 2008, 64, 2683. [36] Hahn, R.; Raabe, G.; Enders, D. Org. Lett. 2014, 16, 3636. [37] Chauhan, P.; Mahajan, S.; Loh, C. C.; Raabe, G.; Enders, D. Org. Lett. 2014, 16, 2954. [38] Chauhan, P.; Urbanietz, G.; Raabe, G.; Enders, D. Chem. Commun. 2014, 50, 6853. [39] Chauhan, P.; Mahajan, S.; Raabe, G.; Enders, D. Chem. Commun. 2015, 51, 2270. [40] Sun, Q. S.; Chen, X. Y.; Zhu, H.; Lin, H.; Sun, X. W.; Lin, G. Q. Org. Chem. Front. 2015, 2, 110. [41] Sun, Q. S.; Zhu, H.; Lin, H.; Tan, Y.; Yang, X. D.; Sun, X. W.; Sun, X. Tetrahedron Lett. 2016, 57, 5768. [42] For some typical references in this area, see:(a) Yang, J.; Liu, G. Y.; Lu, D. L.; Dai, F.; Qian, Y. P.; Jin, X. L.; Zhou, B. Chem.-Eur. J. 2010, 16, 12808. (b) Koufaki, M.; Theodorou, E.; Galaris, D.; Nousis, L.; Katsanou, E. S.; Alexis, M. N. J. Med. Chem. 2006, 49, 300. (c) Koufaki, M.; Detsi, A.; Theodorou, E.; Kiziridi, C.; Calogeropoulou, T.; Vassilopoulos, A.; Kourounakis, A. P.; Rekka, E.; Kourounakis, P. N.; Gaitanaki, C.; Papazafiri, P. Bioorg. Med. Chem. 2004, 12, 4835. (d) Reddy, K. A.; Lohray, B. B.; Bhushan, V.; Reddy, A. S.; Mamidi, N. V. S. R.; Reddy, P. P.; Saibaba, V.; Reddy, N. J.; Suryaprakash, A.; Misra, P.; Vikramadithyan, R. K.; Rajagopalan, R. J. Med. Chem. 1999, 42, 3265. [43] Xiao, Y.; Lin, J. B.; Zhao, Y. N.; Liu, J. Y.; Xu, P. F. Org. Lett. 2016, 18, 6276. [44] (a) Dalpozzo, R.; Bartoli, G.; Bencivenni, G. Chem. Soc. Rev. 2012, 41, 7247. (b) Zhang, J.; Qian, Z.; Wu, X.; Ding, Y.; Li, J.; Lu, C.; Shen, Y. Org. Lett. 2014, 16, 2752. (c) Zhou, F.; Liu, Y. L.; Zhou, J. Adv. Synth. Catal. 2010, 352, 1381. (d) Ziarani, G. M.; Moradi, R.; Lashgari, N. Tetrahedron:Asymmetry 2015, 26, 517. (e) Galliford, C. V.; Scheidt, K. A. Angew. Chem., Int. Ed. 2007, 46, 8748. (f) Shen, K.; Liu, X.; Lin, L.; Feng, X. Chem. Sci. 2012, 3, 327. [45] Lian, X. L.; Meng, J.; Han, Z. Y. Org. Lett. 2016, 18, 4270. [46] Urruzuno, I.; Mugica, O.; Oiarbide, M.; Palomo, C. Angew. Chem., Int. Ed. 2017, 56, 2059. [47] (a) Hamama, W. S.; El-Gohary, H. G.; Kuhnert, N; Zoorob, H. H. Curr. Org. Chem. 2012, 16, 373. (b) Horton, D. A.; Bourne, G. T.; Smythe, M. L. Chem. Rev. 2003, 103, 893. (c) Yoshida, H.; Yanai, H.; Namiki, Y.; Fukatsu-Sasaki, K.; Furutani, N.; Tada, N. CNS Drug Rev. 2006, 12, 9. (d) Hadi, V.; Koh, Y. H.; Sanchez, T. W.; Barrios, D.; Neamati, N.; Jung, K. W. Bioorg. Med. Chem. Lett. 2010, 20, 6854. (e) Chande, M. S.; Barve, P. A.; Suryanarayan, V. J. Heterocycl. Chem. 2007, 44, 49. [48] Li, J. H.; Cui, Z. H.; Du, D. M. Org. Chem. Front. 2016, 3, 1087. [49] (a) Wang, T.; Yu, Z.; Hoon, D. L.; Huang, K. W.; Lan, Y.; Lu, Y. Chem. Sci. 2015, 6, 4912. (b) Ibrahim, D. A. Eur. J. Med. Chem. 2009, 44, 2776. (c) Abdel-Wahab, B. F.; Abdel-Latif, E.; Mohamed, H. A.; Awad, G. E. Eur. J. Med. Chem. 2012, 52, 263. (d) Bayomi, S. M.; El-Kashef, H. A.; El-Ashmawy, M. B.; Nasr, M. N.; El-Sherbeny, M. A.; Abdel-Aziz, N. I.; El-Sayed, M. A. A.; Suddek, G. M.; El-Messery, S. M.; Ghaly, M. A. Eur. J. Med. Chem. 2015, 101, 584. (e) Ding, C. R.; Pan, Y. Y.; Yin, X.; Tan, C. X. Chin. J. Org. Chem. 2019, 39, 2099(in Chinese). (丁成荣, 潘亚运, 殷许, 谭成侠, 有机化学, 2019, 39, 2099.) [50] Xiao, Y.; Jiang, R.; Wang, Y.; Zhou, Z. Adv. Synth. Catal. 2018, 360, 1961. [51] For some typical references in this area, see:(a) Maji, R.; Mallojjala, S. C.; Wheeler, S. E. Chem. Soc. Rev. 2018, 47, 1142. (b) Zhang, Y. L.; He, B. J.; Xie, Y. W.; Wang, Y. H.; Wang, Y. L.; Shen, Y. C.; Huang, Y. Y. Adv. Synth. Catal. 2019, 361, 3074. (c) Kang, Q.; Zhao, Z. A.; You, S. L. J. Am. Chem. Soc. 2007, 129, 1484. (d) Wang, S. G.; Yin, Q.; Zhuo, C. X.; You, S. L. Angew. Chem., Int. Ed. 2015, 54, 647. (e) Yin, Q.; Wang, S. G.; You, S. L. Org. Lett. 2013, 15, 2688. (f) Zhang, K. F.; Nie, J.; Guo, R.; Zheng, Y.; Ma, J. A. Adv. Synth. Catal. 2013, 355, 3497. (g) Zhang, Y.; Ao, Y. F.; Huang, Z. T.; Wang, D. X.; Wang, M. X.; Zhu, J. Angew. Chem. Int. Ed. 2016, 55, 5282. (h) Smith, M. J.; Reichl, K. D.; Escobar, R. A.; Heavey, T. J.; Coker, D. F.; Schaus, S. E.; Porco Jr, J. A. J. Am. Chem. Soc. 2018, 141, 148. [52] (a) Akiyama, T.; Itoh, J.; Yokota, K.; Fuchibe, K. Angew. Chem., Int. Ed. 2004, 43, 1566. (b) Uraguchi, D.; Terada, M. J. Am. Chem. Soc. 2004, 126, 5356. (c) Uraguchi, D.; Sorimachi, K.; Terada, M. J. Am. Chem. Soc. 2004, 126, 11804. [53] (a) Wang, Y. B.; Tan, B. Acc. Chem. Res. 2018, 51, 534. (b) Xia, Z. L.; Zheng, C.; Xu, R. Q.; You, S. L. Nat. commun. 2019, 10, 3150. (c) Zhang, L.; Xiang, S. H.; Wang, J. J.; Xiao, J.; Wang, J. Q.; Tan, B. Nat. Commun. 2019, 10, 566. (d) Li, J. S.; Liu, Y. J.; Li, S.; Ma, J. A. Chem. Commun. 2018, 54, 9151. (e) Su, Y. J.; Shi, F. Q. Chin. J. Org. Chem. 2010, 30, 486(in Chinese). (苏亚军, 史福强, 有机化学, 2010, 30, 486.) [54] Zhu, G.; Wang, B.; Bao, X.; Zhang, H.; Wei, Q.; Qu, J. Chem. Commun. 2015, 51, 15510. [55] Wu, S.; Zhu, G.; Wei, S.; Chen, H.; Qu, J.; Wang, B. Org. Biomol. Chem. 2018, 16, 807. [56] For some recent reviews, see:(a) Si, Y.; Chen, M.; Wu, L. Chem. Soc. Rev. 2016, 45, 690. (b) Qi, J.; Lai, X.; Wang, J.; Tang, H.; Ren, H.; Yang, Y.; Jin, Q.; Zhang, L.; Yu, R.; Ma, G.; Su, Z.; Zhao, H.; Wang, D. Chem. Soc. Rev. 2015, 44, 6749. (c) Chen, Y.; Chen, H. R.; Shi, J. L. Acc. Chem. Res. 2014, 47, 125. (d) Sasidharan, M.; Nakashima, K. Acc. Chem. Res. 2014, 47, 157. [57] Dai, F.; Zhao, Z.; Xie, G.; Feng, D.; Ma, X. ChemCatChem 2017, 9, 89. [58] (a) Lu, A.; Liu, T.; Wu, R.; Wang, Y.; Zhou, Z.; Wu, G.; Fang, J.; Tang, C. Eur. J. Org. Chem. 2010, 5777. (b) Lu, A.; Liu, T.; Wu, R.; Wang, Y.; Wu, G.; Zhou, Z.; Fang, J.; Tang, C. J. Org. Chem. 2011, 76, 3872. [59] Sun, J.; Jiang, C.; Zhou, Z. Eur. J. Org. Chem. 2016, 2016, 1165. [60] (a) Dong, S.; Feng, X.; Liu, X. Chem. Soc. Rev. 2018, 47, 8525. (b) Xie, L.; Dong, S.; Zhang, Q.; Feng, X.; Liu, X. Chem. Commun. 2018, 55, 87. (c) Kang, T.; Zhao, P.; Yang, J.; Lin, L.; Feng, X.; Liu, X. Chem.-Eur. J. 2018, 24, 3703. (d) Cui, X. Y.; Tan, C. H.; Leow, D. Org. Biomol. Chem. 2019, 17, 4689. [61] Chen, Y.; Liu, X.; Luo, W.; Lin, L.; Feng, X. Synlett 2017, 28, 966. |
| [1] | 付雅彤, 孙超凡, 张丹, 金成国, 陆居有. 巢式-碳硼烷硼氢键官能化反应研究进展[J]. 有机化学, 2024, 44(2): 438-447. |
| [2] | 王化坤, 任晓龙, 宣宜宁. 卤盐催化的α,β-环氧羧酸酯与异氰酸酯[3+2]环加成反应研究[J]. 有机化学, 2024, 44(1): 251-258. |
| [3] | 于士航, 刘嘉威, 安碧玉, 边庆花, 王敏, 钟江春. 黑腹尼虎天牛接触性信息素的不对称合成[J]. 有机化学, 2024, 44(1): 301-308. |
| [4] | 王玉超, 刘晋彪, 何智涛. 钯催化共轭二烯的不对称氢官能团化[J]. 有机化学, 2023, 43(8): 2614-2627. |
| [5] | 宋亭谕, 李冉, 黄利华, 贾世琨, 梅光建. N—N单键阻转异构体的催化不对称合成[J]. 有机化学, 2023, 43(6): 1977-1990. |
| [6] | 罗诚, 尹艳丽, 江智勇. P-手性膦氧化物的不对称合成研究进展[J]. 有机化学, 2023, 43(6): 1963-1976. |
| [7] | 曾成富, 何媛, 李清, 董琳. Ir(III)催化新型三组分串联三氟乙氧基化反应并一锅法构建复杂酰胺化合物[J]. 有机化学, 2023, 43(3): 1115-1123. |
| [8] | 贾海瑞, 邱早早. 过渡金属催化硼-氢键活化合成含硼-杂原子键邻碳硼烷衍生物的研究进展[J]. 有机化学, 2023, 43(3): 1045-1068. |
| [9] | 蒙玲, 汪君. 硫代黄烷酮类衍生物的合成研究进展[J]. 有机化学, 2023, 43(3): 873-891. |
| [10] | 李硕, 王明亮, 周来运, 王兰芝. 磁性纳米负载对甲苯磺酸催化串联合成稠合多环的1,5-苯并氧氮杂䓬类化合物[J]. 有机化学, 2023, 43(11): 3977-3988. |
| [11] | 张怀远, 许诺, 唐蓉萍, 石星丽. 手性高价碘试剂诱导的不对称去芳构化反应研究进展[J]. 有机化学, 2023, 43(11): 3784-3805. |
| [12] | 孙美娇, 谭晶, 谭玉, 彭进松, 陈春霞. 钯催化3-(2-氨基嘧啶-4-基)吲哚2位C—H键芳基化反应的研究[J]. 有机化学, 2023, 43(11): 3945-3959. |
| [13] | 匡鑫, 丁昌华, 吴奕晨, 王鹏. 手性烯丙基硅烷的催化对映选择性合成[J]. 有机化学, 2023, 43(10): 3367-3387. |
| [14] | 濮留洋, 李芷悦, 李利民, 马玉翠, 马民, 胡胜全, 吴正治. 秋水仙碱及其天然类似物(–)-N-乙酰秋水酚甲醚的不对称合成[J]. 有机化学, 2023, 43(1): 313-319. |
| [15] | 石云, 肖婷, 夏冬, 杨文超. 三氟甲硫基自由基引发不饱和烃的串联反应[J]. 有机化学, 2022, 42(9): 2715-2727. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||