有机化学 ›› 2024, Vol. 44 ›› Issue (1): 291-300.DOI: 10.6023/cjoc202306002 上一篇 下一篇
研究论文
文思a,b, 丁宇浩b, 田青于b, 葛进b, 程国林b,*( )
)
收稿日期:2023-06-01
修回日期:2023-07-26
发布日期:2023-08-22
基金资助:
Si Wena,b, Yuhao Dingb, Qingyu Tianb, Jin Geb, Guolin Chengb( )
)
Received:2023-06-01
Revised:2023-07-26
Published:2023-08-22
Contact:
*E-mail: Supported by:文章分享
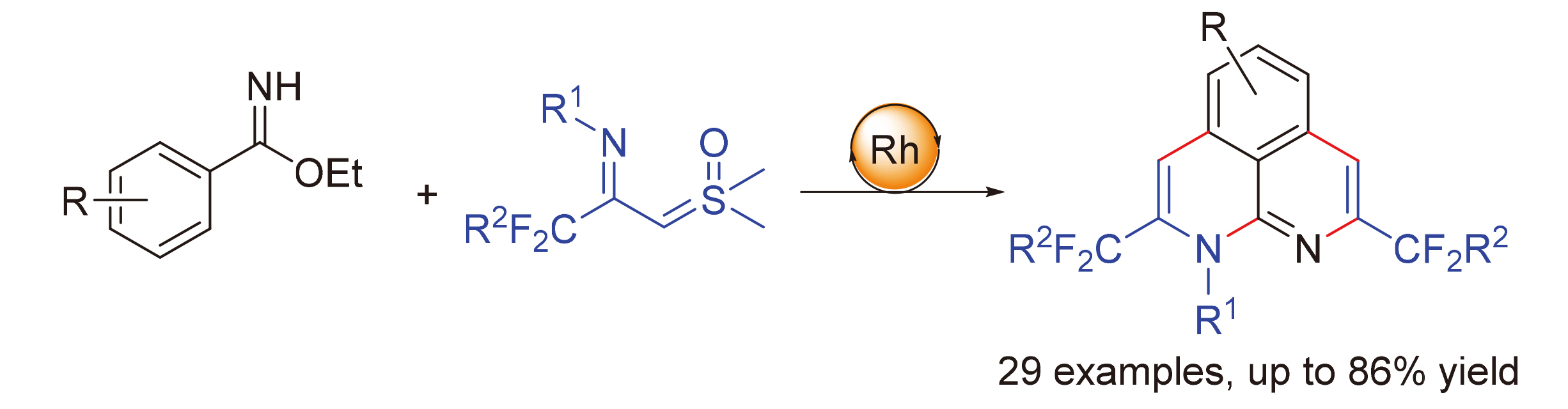
在铑催化下, 实现了苯甲亚胺酸乙酯类化合物与CF3-亚胺叶立德的C—H活化/环化多米诺反应. 该合成策略具有良好的官能团耐受性和底物的普适性, 合成了一系列含三氟甲基的1H-苯并[de][1,8]萘吡啶, 产率为22%~86%.
文思, 丁宇浩, 田青于, 葛进, 程国林. 铑(III)催化苯甲亚胺酸乙酯和CF3-亚胺氧锍叶立德C—H 活化/环化反应合成CF3-1H-苯并[de][1,8]萘吡啶[J]. 有机化学, 2024, 44(1): 291-300.
Si Wen, Yuhao Ding, Qingyu Tian, Jin Ge, Guolin Cheng. Rhodium(III)-Catalyzed Synthesis of CF3-1H-benzo[de][1,8]naph-thyridines via C—H Activation/Annulation of Benzimidates and CF3-Imidoyl Sulfoxonium Ylides[J]. Chinese Journal of Organic Chemistry, 2024, 44(1): 291-300.
| Entry | Solvent | Base | Additive | Yieldb/% |
|---|---|---|---|---|
| 1 | DCE | NaOAc | AgSbF6 | 54 |
| 2 | DMF | NaOAc | AgSbF6 | 0 |
| 3 | DMSO | NaOAc | AgSbF6 | 0 |
| 4 | THF | NaOAc | AgSbF6 | 44 |
| 5 | HFIP | NaOAc | AgSbF6 | 58 |
| 6 | Toluene | NaOAc | AgSbF6 | 74 |
| 7 | Toluene | Na2CO3 | AgSbF6 | 20 |
| 8 | Toluene | tBuONa | AgSbF6 | 0 |
| 9 | Toluene | KHCO3 | AgSbF6 | 58 |
| 10 | Toluene | KOAc | AgSbF6 | 18 |
| 11 | Toluene | Cs2CO3 | AgSbF6 | 0 |
| 12 | Toluene | CsOAc | AgSbF6 | 48 |
| 13 | Toluene | Li2CO3 | AgSbF6 | 46 |
| 14 | Toluene | LiOAc | AgSbF6 | 58 |
| 15 | Toluene | — | AgSbF6 | 70 |
| 16 | Toluene | NaOAc | AgOAc | 32 |
| 17 | Toluene | NaOAc | — | 0 |
| 18d | Toluene | NaOAc | AgSbF6 | 68 |
| 19e | Toluene | NaOAc | AgSbF6 | 77 |
| 20e,f | Toluene | NaOAc | AgSbF6 | 80 (75)c |
| 21e,g | Toluene | NaOAc | AgSbF6 | 72 |
| 22e,h | Toluene | NaOAc | AgSbF6 | 54 |
| 23e,i | Toluene | NaOAc | AgSbF6 | Trace |
| Entry | Solvent | Base | Additive | Yieldb/% |
|---|---|---|---|---|
| 1 | DCE | NaOAc | AgSbF6 | 54 |
| 2 | DMF | NaOAc | AgSbF6 | 0 |
| 3 | DMSO | NaOAc | AgSbF6 | 0 |
| 4 | THF | NaOAc | AgSbF6 | 44 |
| 5 | HFIP | NaOAc | AgSbF6 | 58 |
| 6 | Toluene | NaOAc | AgSbF6 | 74 |
| 7 | Toluene | Na2CO3 | AgSbF6 | 20 |
| 8 | Toluene | tBuONa | AgSbF6 | 0 |
| 9 | Toluene | KHCO3 | AgSbF6 | 58 |
| 10 | Toluene | KOAc | AgSbF6 | 18 |
| 11 | Toluene | Cs2CO3 | AgSbF6 | 0 |
| 12 | Toluene | CsOAc | AgSbF6 | 48 |
| 13 | Toluene | Li2CO3 | AgSbF6 | 46 |
| 14 | Toluene | LiOAc | AgSbF6 | 58 |
| 15 | Toluene | — | AgSbF6 | 70 |
| 16 | Toluene | NaOAc | AgOAc | 32 |
| 17 | Toluene | NaOAc | — | 0 |
| 18d | Toluene | NaOAc | AgSbF6 | 68 |
| 19e | Toluene | NaOAc | AgSbF6 | 77 |
| 20e,f | Toluene | NaOAc | AgSbF6 | 80 (75)c |
| 21e,g | Toluene | NaOAc | AgSbF6 | 72 |
| 22e,h | Toluene | NaOAc | AgSbF6 | 54 |
| 23e,i | Toluene | NaOAc | AgSbF6 | Trace |
| [1] |
(a) Zhuang, L.; Wai, J. S.; Embrey, M. W.; Fisher, T. E.; Egbertson, M. S.; Payne, L. S.; Guare, J. P.; Vacca, J. P.; Hazuda, D. J.; Felock, P. J.; Wolfe, A. L.; Stillmock, K. A.; Witmer, M. V.; Moyer, G.; Schleif, W. A.; Gabryelski, L. J.; Leonard, Y. M.; Lynch, J. J.; Michelson, S. R.; Young, S. D. J. Med. Chem. 2003, 46, 453.
doi: 10.1021/jm025553u |
|
(b) Embrey, M. W.; Wai, J. S.; Funk, T. W.; Homnick, C. F.; Perlow, D. S.; Young, S. D.; Vacca, J. P.; Hazuda, D. J.; Felock, P. J.; Stillmock, K. A.; Witmer, M. V.; Moyer, G.; Schleif, W. A.; Gabryelski, L. J.; Jin, L.; Chen, I.-W.; Ellis, J. D.; Wong, B. K.; Lin, J. H.; Leonard, Y. M.; Tsou, N. N.; Zhuang, L. Bioorg. Med. Chem. Lett. 2005, 15, 4550.
doi: 10.1016/j.bmcl.2005.06.105 |
|
| [2] |
(a) Calcul, L.; Longeon, A.; Mourabit, A. A.; Guyot, M.; Bourguet-Kondracki, M.-L. Tetrahedron 2003, 59, 6539.
doi: 10.1016/S0040-4020(03)01069-X |
|
(b) Aoki, S.; Kong, D.; Suna, H.; Sowa, Y.; Sakai, T.; Setiawan, A.; Kobayashi, M. Biochem. Biophys. Res. Commun. 2006, 342, 101.
doi: 10.1016/j.bbrc.2006.01.119 |
|
| [3] |
(a) Stockner, F.; Beckert, R.; Gleich, D.; Birckner, E.; Gunther, W.; Gorls, H.; Vaughan, G. Eur. J. Org. Chem. 2007, 2007, 1237.
doi: 10.1002/ejoc.v2007:8 |
|
(b) Matschke, M.; Beckert, R.; Würthwein, E.-U.; Gorls, H. Synlett 2008, 2633.
|
|
|
(c) Bunz, U. H. F. Chem.-Eur. J. 2009, 15, 6780.
doi: 10.1002/chem.v15:28 |
|
|
(d) Tang, Q.; Liu, J.; Chan, H. S.; Miao, Q. Chem.-Eur. J. 2009, 15, 3965.
doi: 10.1002/chem.v15:16 |
|
|
(e) Behof, W. J.; Wang, D.; Niu, W.; Gorman, C. B. Org. Lett. 2010, 12, 2146.
doi: 10.1021/ol100656d |
|
| [4] |
(a) Chen, X.; Engle, K. M.; Wang, D.-H.; Yu, J.-Q. Angew. Chem., Int. Ed. 2009, 48, 5094.
doi: 10.1002/anie.v48:28 |
|
(b) Colby, D. A.; Bergman, R. G.; Ellman, J. A. Chem. Rev. 2010, 110, 624.
doi: 10.1021/cr900005n |
|
|
(c) Lyons, T. W.; Sanford, M. S. Chem. Rev. 2010, 110, 1147.
doi: 10.1021/cr900184e |
|
| [5] |
(a) Mochida, S.; Umeda, N.; Hirano, K.; Satoh, T.; Miura, M. Chem. Lett. 2010, 39, 744.
doi: 10.1246/cl.2010.744 |
|
(b) Huang, J.-R.; Dong, L.; Han, B.; Peng, C.; Chen, Y.-C. Chem.-Eur. J. 2012, 18, 8896.
doi: 10.1002/chem.v18.29 |
|
|
(c) Tan, X.; Liu, B.; Li, X.; Li, B.; Xu, S.; Song, H.; Wang, B. J. Am. Chem. Soc. 2012, 134, 16163.
doi: 10.1021/ja3075242 |
|
| [6] |
Jayakumar, J.; Parthasarathy, K.; Chen, Y.-H.; Lee, T.-H.; Chuang, S.-C.; Cheng, C.-H. Angew. Chem., Int. Ed. 2014, 53, 9889.
doi: 10.1002/anie.v53.37 |
| [7] |
Huang, T.; Wang, T.; Shi, Y.; Chen, J.; Guo, X.; Guo, X.; Guo, X.; Wu, Z.; Peng, D.; Wang, L.; Li, H.; Hai, L.; Wu, Y. Org. Lett. 2021, 23, 1548.
doi: 10.1021/acs.orglett.0c04155 |
| [8] |
(a) Barday, M.; Janot, C.; Halcovitch, N. R.; Muir, J.; Aissa, C. Angew. Chem., Int. Ed. 2017, 56, 13117.
doi: 10.1002/anie.v56.42 |
|
(b) Xu, Y.; Xu, Y.; Zheng, G.; Li, X. Org. Lett. 2017, 19, 5256.
doi: 10.1021/acs.orglett.7b02531 |
|
|
(c) Shi, X.; Wang, R.; Zeng, X.; Zeng, X.; Hu, H.; Xie, C.; Wang, M. Adv. Synth. Catal. 2018, 360, 4049.
doi: 10.1002/adsc.v360.21 |
|
|
(d) Wu, X.; Xiong, H.; Sun, S.; Cheng, J. Org. Lett. 2018, 20, 1396.
doi: 10.1021/acs.orglett.8b00119 |
|
|
(e) Zheng, G.; Tian, M.; Xu, Y.; Xu, Y.; Li, X. Org. Chem. Front. 2018, 5, 998.
doi: 10.1039/C7QO01033H |
|
|
(f) Cai, L.; Zhu, X.; Zhu, X.; Lin, A.; Yao, H. Org. Chem. Front. 2019, 6, 3688.
doi: 10.1039/C9QO00830F |
|
|
(g) Xie, W.; Chen, X.; Shi, J.; Li, J.; Liu, R. Org. Chem. Front. 2019, 6, 2662.
doi: 10.1039/C9QO00524B |
|
|
(h) Dong, Y.; Yu, J.-T.; Sun, S.; Cheng, J. Chem. Commun. 2020, 56, 6688.
doi: 10.1039/D0CC00176G |
|
|
(i) Hong, C.; Jiang, X.; Yu, S.; Lu, Z.; Zhang, Y. Chin. J. Org. Chem. 2021, 41, 888 (in Chinese).
doi: 10.6023/cjoc202007037 |
|
|
(洪超, 蒋希程, 于书玲, 刘占祥, 张玉红, 有机化学, 2021, 41, 888.)
|
|
|
(j) Lee, S. C.; Son, J.-Y.; Kim, J. Y.; Eom, H.; Jang, S. B.; Lee, P. H. Adv. Synth. Catal. 2021, 363, 512.
doi: 10.1002/adsc.v363.2 |
|
|
(k) Aher, Y. N.; Pawar, A. B. J. Org. Chem. 2022, 87, 12608.
doi: 10.1021/acs.joc.2c00931 |
|
|
(l) Caiuby, C. A. D.; Furniel, L. G.; Burtoloso, A. C. B. Chem. Sci. 2022, 13, 1192.
doi: 10.1039/D1SC05708A |
|
|
(m) Kumar, S.; Nunewar, S.; Sabbi, T. K.; Kanchupalli, V. Org. Lett. 2022, 24, 3395.
doi: 10.1021/acs.orglett.2c01166 |
|
|
(n) Ming, S.; Yang, J.; Wu, S.; Yao, G.; Xiong, H.; Du, Y.; Gong, J. Org. Chem. Front. 2022, 9, 5147.
doi: 10.1039/D2QO01068B |
|
|
(o) Zheng, Y.-C.; Shu, B.; Zeng, Y.-F.; Chen, S.-Y.; Song, J.-L.; Liu, Y.-Z.; Xiao, L.; Liu, X.-G.; Zhang, X.; Zhang, S.-S. Org. Chem. Front. 2022, 9, 5185.
doi: 10.1039/D2QO00871H |
|
|
(p) Phukon, J.; Bhorali, P.; Changmai, S.; Gogoi, S. Org. Lett. 2023, 25, 215.
doi: 10.1021/acs.orglett.2c04068 |
|
| [9] |
(a) Johnson, B. M.; Shu, Y.-Z.; Zhuo, X.; Meanwell, N. A. J. Med. Chem. 2020, 63, 6315.
doi: 10.1021/acs.jmedchem.9b01877 |
|
(b) Mandal, D.; Maji, S.; Pal, T.; Sinha, S. K.; Maiti, D. Chem. Commun. 2022, 58, 10442.
doi: 10.1039/D2CC04082D |
|
|
(c) Chen, D.; Jiang, J.; Wan, J.-P. Chin. J. Chem. 2022, 40, 2582.
doi: 10.1002/cjoc.v40.21 |
|
| [10] |
Ma, R.; Deng, Z.; Wang, K.; Huang, D.; Hu, Y.; Lü, X. Chin. J. Org. Chem. 2022, 42, 353 (in Chinese).
|
|
(马然松, 邓周斌, 王克虎, 黄丹凤, 胡雨来, 闾肖波, 有机化学, 2022, 42, 353.)
|
|
| [11] |
(a) Wen, S.; Tian, Q.; Chen, Y.; Zhang, Y.; Cheng, G. Org. Lett. 2021, 23, 7407.
doi: 10.1021/acs.orglett.1c02598 |
|
(b) Wen, S.; Chen, Y.; Tian, Q.; Zhang, Y.; Cheng, G. J. Org. Chem. 2022, 87, 1124.
doi: 10.1021/acs.joc.1c02464 |
|
|
(c) Wen, S.; Zhang, Y.; Tian, Q.; Chen, Y.; Cheng, G. Org. Chem. Front. 2022, 9, 4388.
doi: 10.1039/D2QO00839D |
|
| [12] |
(a) Pan, M.; Tong, Y.; Qiu, X.; Zeng, X.; Xiong, B. Chem. Commun. 2022, 58, 12443.
doi: 10.1039/D2CC04863A |
|
(b) Sun, Y.; Yang, Z.; Lu, S.-N.; Chen, Z.; Wu, X.-F. Org. Lett. 2022, 24, 6822.
doi: 10.1021/acs.orglett.2c02746 |
|
|
(c) Yang, Z.; Tang, J.; Chen, Z.; Wu, X.-F. Org. Lett. 2022, 24, 7288.
doi: 10.1021/acs.orglett.2c02685 |
|
|
(d) Yang, D.; Wang, Y.; Wang, T.; Dou, Q.; Zhou, K.; Zhai, H.; Cheng, B. Adv. Synth. Catal. 2023, 365, 88.
doi: 10.1002/adsc.v365.1 |
|
|
(e) Sun, Y.; Ling, S.; Duan, Y.; Li, J.; Zhengkai, C.; Wu, X.-F. Adv. Synth. Catal. 2023, 365, 1521.
doi: 10.1002/adsc.v365.9 |
|
|
(f) Wei, G.; Sun, Y.; Zheng, D.; Qiu, S.; Chen, Z.; Wu, X.-F. Eur. J. Org. Chem. 2023, 26, e202300090.
|
|
| [13] |
(a) Wen, S.; Lv, W.; Ba, D.; Liu, J.; Cheng, G. Chem. Sci. 2019, 10, 9104.
doi: 10.1039/C9SC03245B |
|
(b) Yu, J.; Wen, S.; Ba, D.; Lv, W.; Chen, Y.; Cheng, G. Org. Lett. 2019, 21, 6366.
doi: 10.1021/acs.orglett.9b02253 |
|
|
(c) Wen, S.; Chen, Y.; Zhao, Z.; Ba, D.; Lv, W.; Cheng, G. J. Org. Chem. 2020, 85, 1216.
doi: 10.1021/acs.joc.9b02520 |
|
| [14] |
For the selected papers on Rh(III)-catalyzed C—H activations, see: (a) Fu, L.; Xu, W.; Pu, M.; Wu, Y.-D.; Liu, Y.; Wan, J.-P. Org. Lett. 2022, 24, 3003.
doi: 10.1021/acs.orglett.2c00912 |
|
(b) Chen, D.; Zhou, L.; Liu, Y.; Wan, J.-P. Chem. Commun. 2023, 59, 4036.
doi: 10.1039/D3CC00649B |
|
|
(c) Chen, D.; Zhou, L.; Wen, C.; Wan, J.-P. J. Org. Chem. 2023, 88, 8619
doi: 10.1021/acs.joc.3c00526 |
|
|
(d) Cheng, G.-L.; Wen, S.; Zhang, S.-S. CN 202211461998, 2022.
|
|
|
(e) Zhang, Y.; Ling, S.; Li, P.; Chen, Z.; Wu, X.-F. Org. Lett. 2022, 24, 8864.
doi: 10.1021/acs.orglett.2c03666 |
|
| [15] |
Wappes, E. A.; Nakafuku, K. M.; Nagib, D. A. J. Am. Chem. Soc. 2017, 139, 10204.
doi: 10.1021/jacs.7b05214 |
| [16] |
Lian, Y.; Coffey, S. B.; Li, Q.; Londregan, A. T. Org. Lett. 2016, 18, 1362.
doi: 10.1021/acs.orglett.6b00295 |
| [1] | 马虎, 黄丹凤, 王克虎, 唐朵朵, 冯杨, 任园园, 王君娇, 胡雨来. 3-(三氟甲基)吡唑类化合物的合成[J]. 有机化学, 2023, 43(9): 3257-3267. |
| [2] | 岁丹丹, 岑南楠, 龚若蕖, 陈阳, 陈文博. 无支持电解质条件下连续流电化学合成三氟甲基化氧化吲哚[J]. 有机化学, 2023, 43(9): 3239-3245. |
| [3] | 张彦波, 孙萌. 铑催化碳酸亚乙烯酯与吲哚啉C(7)位C—H甲酰甲基化反应[J]. 有机化学, 2023, 43(8): 2905-2912. |
| [4] | 刘静, 郝健, 沈其龙. 可见光促进的含色氨酸寡肽与YlideFluor试剂的直接三氟甲基化反应研究[J]. 有机化学, 2023, 43(4): 1517-1524. |
| [5] | 汤振, 皮超, 吴养洁, 崔秀灵. 铑催化2-芳基-2H-吲唑与硫叶立德的酰甲基化/串联环化反应高效构建6-芳基吲唑并[2,3-a]喹啉类衍生物[J]. 有机化学, 2023, 43(3): 1187-1196. |
| [6] | 王睿, 高朗, 周岑, 张霄. 苯基吩噻嗪多孔有机聚合物催化的非活化末端烯烃的卤代全氟烷基化反应[J]. 有机化学, 2023, 43(3): 1136-1145. |
| [7] | Yasir Mumtaz, 刘杰, 黄鑫. 铜促进的苯胺类化合物与CF3SO2Na的三氟甲硫基化反应[J]. 有机化学, 2023, 43(2): 679-685. |
| [8] | 宋树勇, 徐森苗. 三氟甲基烯烃的选择性C-F键活化最新进展[J]. 有机化学, 2023, 43(2): 411-425. |
| [9] | 朱佳洁, 万义, 袁启洋, 魏金莲, 张永强. 可见光/路易斯碱协同催化的三氟甲基取代烯烃脱氟硅化反应研究[J]. 有机化学, 2023, 43(10): 3623-3634. |
| [10] | 徐琳琳, 兰美君, 张慕雨, 张永琪, 冯宇豪, 荣良策, 张金鹏. 芳基乙烯β-H区域选择性三氟甲基磺酰化反应[J]. 有机化学, 2022, 42(7): 2134-2139. |
| [11] | 刘晓洁, 徐必平, 苏伟平. 铑催化羧酸原位生成酰氟的脱羰Suzuki-Miyaura偶联[J]. 有机化学, 2022, 42(7): 2184-2191. |
| [12] | 杨明, 黄丹凤, 王克虎, 韩侗育, 赵鹏飞, 王凤, 王君姣, 苏瀛鹏, 胡雨来. 银催化下三氟甲基取代的2-咪唑啉化合物的合成[J]. 有机化学, 2022, 42(5): 1509-1519. |
| [13] | 顾清云, 程振凤, 曾小宝. 电化学氧化三氟甲基亚磺酸钠与α-羰基二硫缩烯酮的三氟甲基化反应[J]. 有机化学, 2022, 42(5): 1537-1544. |
| [14] | 锅小龙, 王玉贤, 赵志强, 王庆, 左剑, 王陆瑶. 电化学氧化下喹喔啉-2(1H)-酮的三氟甲基化及电描述符对反应性能的评价[J]. 有机化学, 2022, 42(2): 641-649. |
| [15] | 马然松, 邓周斌, 王克虎, 黄丹凤, 胡雨来, 闾肖波. CF3Br参与的三氟甲基化反应研究进展[J]. 有机化学, 2022, 42(2): 353-362. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||