有机化学 ›› 2025, Vol. 45 ›› Issue (3): 748-763.DOI: 10.6023/cjoc202410003 上一篇 下一篇
综述与进展
收稿日期:2024-10-08
修回日期:2025-01-15
发布日期:2025-02-07
基金资助:
Tao Longa, Shuzhong Hea( ), Chao Lib(
), Chao Lib( )
)
Received:2024-10-08
Revised:2025-01-15
Published:2025-02-07
Contact:
* E-mail: Supported by:文章分享

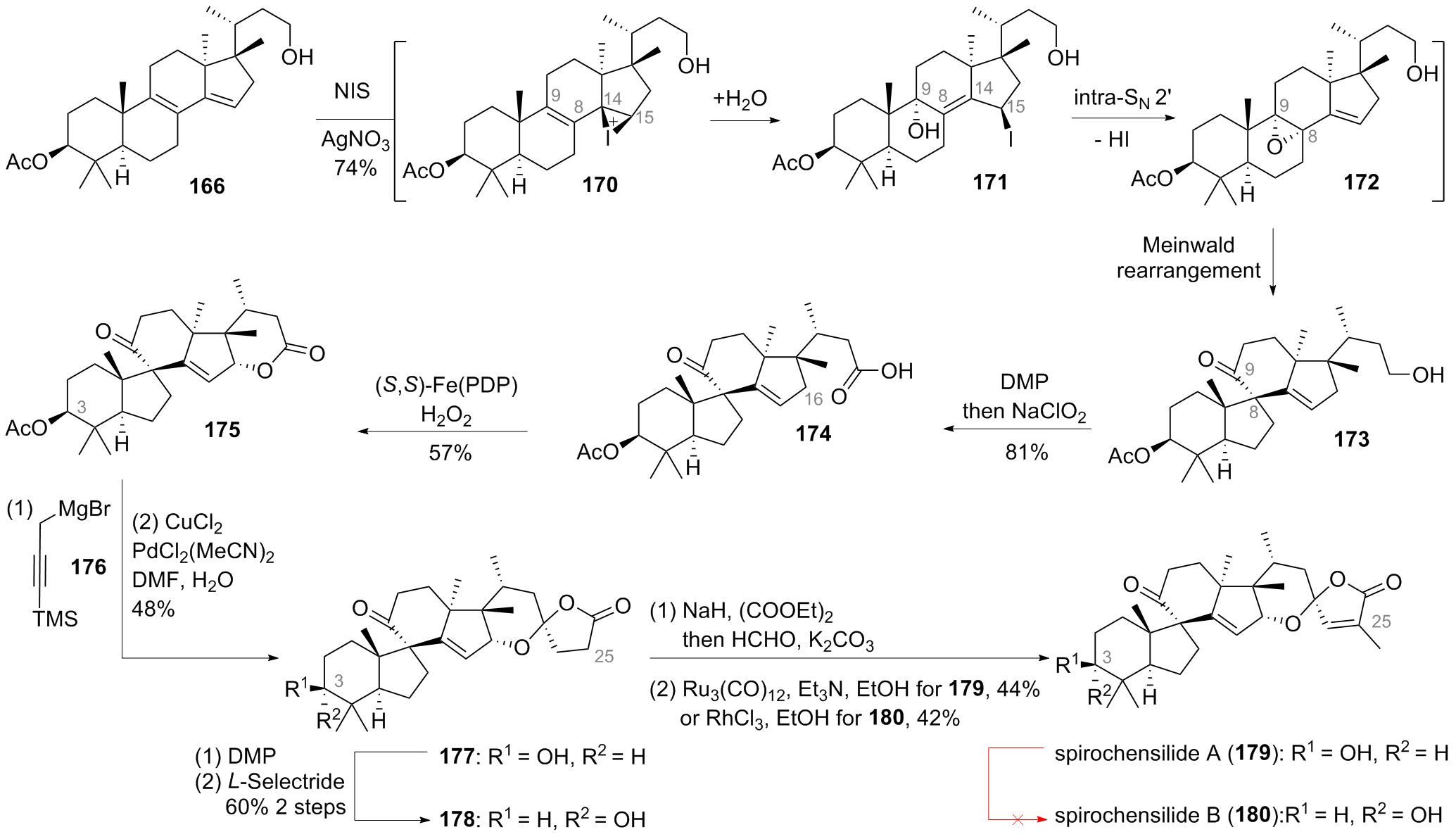
自由基-极性交叉转化(RPCO)是一类链接自由基中间体和离子型中间体的串联反应, 因此可以一步构建多根化学键, 进而快速提高分子复杂度. 近几十年来, 已有多个课题组利用RPCO为关键反应, 完成萜类、生物碱、木脂素和甾体等天然产物的全合成. 但目前, 与此类反应相关的综述却鲜有报道. 将RPCO反应分为还原型、氧化型以及氧化还原中性型三类, 并按照此分类逐一介绍了RPCO反应在天然产物全合成中的应用.
龙涛, 何述钟, 李超. 自由基-极性交叉转化反应在天然产物全合成中的研究进展[J]. 有机化学, 2025, 45(3): 748-763.
Tao Long, Shuzhong He, Chao Li. Research Progress on the Radical-Polar Crossover Reaction in Total Synthesis of Natural Products[J]. Chinese Journal of Organic Chemistry, 2025, 45(3): 748-763.

| [1] |
(a) Romero, K. J.; Galliher, M. S.; Pratt, D. A.; Stephenson, C. R. J. Chem. Soc. Rev. 2018, 47, 7851.
|
|
(b) Plesniak, M. P.; Huang, H.-M.; Procter, D. J. Nat. Rev. Chem. 2017, 1, 0077.
|
|
|
(c) Hung, K.; Hu, X.-R.; Maimone, T. J. Nat. Prod. Rep. 2018, 35, 174.
|
|
|
(d) Smith, J. M.; Harwood, S. J.; Baran, P. S. Acc. Chem. Res. 2018, 51, 1807.
|
|
|
(e) Pitre, S. P.; Weires, N. A.; Overman, L. E. J. Am. Chem. Soc. 2019, 141, 2800.
|
|
|
(f) Galliher, M. S.; Roldan, B. J.; Stephenson, C. R. J. Chem. Soc. Rev. 2021, 50, 10044.
|
|
|
(g) Pitre, S. P.; Overman, L. E. Chem. Rev. 2022, 122, 1717.
|
|
|
(h) Huang, H.-H.; Garduño-Castro, M. H.; Procter, D. J. Chem. Soc. Rev. 2019, 48, 4626.
|
|
|
(i) Zhang, B.; Studer, A. Chem. Soc. Rev. 2015, 44, 3505.
|
|
| [2] |
Pitzer, L.; Schwarz, J. L.; Glorius, F. Chem. Sci. 2019, 10, 8285.
|
| [3] |
Goto, K.; Sudzuki, H. Bull. Chem. Soc. Jpn. 1929, 4, 220.
|
| [4] |
Yu, B.-W.; Chen, J.-Y.; Wang, Y.-P.; Cheng, K.-F.; Li, X.-Y.; Qin, G.-W. Phytochemistry 2002, 61, 439.
|
| [5] |
Dilmac, A. M.; Spuling, E.; de Meijere, A.; Bräse, S. Angew. Chem., Int. Ed. 2017, 56, 5684.
|
| [6] |
Li, F.; Samuel, S. T.; Castle, S. L. J. Am. Chem. Soc. 2009, 131, 6674.
|
| [7] |
Li, F.; Castle, S. L. Org. Lett. 2007, 9, 4033.
|
| [8] |
Ondeyka, J. G.; Helms, G. L.; Hensens, O. D.; Goetz, M. A.; Zink, D. L.; Tsipouras, A.; Shoop, W. L.; Slayton, L.; Dombrowski, A. W.; Polishook, J. D.; Ostlind, D. A.; Tsou, N. N.; Ball, R. G.; Singh, S. B. J. Am. Chem. Soc. 1997, 119, 8809.
|
| [9] |
Zou, Y.-K.; Melvin, J. E.; Gonzales, S. S.; Spafford, M. J.; Smith, A. B. J. Am. Chem. Soc. 2015, 137, 7095.
|
| [10] |
Zou, Y.-K.; Li, X.-Q.; Yang, Y.; Berritt, S.; Melvin, J.; Gonzales, S.; Spafford, M.; Smith, A. B. J. Am. Chem. Soc. 2018, 140, 9502.
|
| [11] |
Godfrey, N. A.; Schatz, D. J.; Pronin, S. V. J. Am. Chem. Soc. 2018, 140, 12770.
|
| [12] |
Bhat, S. V.; Bajqwa, B. S.; Dornauer, H.; do Scusa, N. J.; Fehlhaber, H. W. Tetrahedron Lett. 1977, 18, 1669.
|
| [13] |
Thomas, W. P.; Schatz, D. J.; George, D. T.; Pronin, S. V. J. Am. Chem. Soc. 2019, 141, 12246.
|
| [14] |
Guo, Z.; Vangapandu, S.; Sindelar, R. W.; Walker, L. A.; Sindelar, R. D. Curr. Med. Chem. 2005, 12, 173.
|
| [15] |
Thomas, W. P.; Pronin, S. V. J. Am. Chem. Soc. 2022, 144, 118.
|
| [16] |
Zhuo, J.-M.; Zhu, C.-L.; Wu, J.-B.; Li, Z.-J.; Li, C. J. Am. Chem. Soc. 2022, 144, 99.
|
| [17] |
Sun, H.-D.; Huang, S.-X.; Han, Q.-B. Nat. Prod. Rep. 2006, 23, 673.
|
| [18] |
Fujita, E.; Shibuya, M.; Nakamura, S.; Okada, Y.; Fujita, T. J. Chem. Soc., Chem. Commun. 1972, 1107.
|
| [19] |
Pan, S.-Y.; Chen, S.-C.; Dong, G.-B. Angew. Chem., Int. Ed. 2018, 57, 6333.
|
| [20] |
Cao, Z.-C.; Sun, W.-X.; Zhang, J.-F.; Zhuo, J.-M.; Yang, S.-Q.; Song, X.-C.; Ma, Y.; Lu, P.-R.; Han, T.; Li, C. Nat. Commun. 2024, 15, 6052.
|
| [21] |
Schulte, G. R.; Scheuer, P. J.; McConnell, O. J. J. Org. Chem. 1980, 45, 552.
|
| [22] |
Paquette, L. A.; Schaefer, A. G.; Springer, J. P. Tetrahedron 1987, 43, 5567.
|
| [23] |
Zhao, Q.-Q.; Song, Q.-Y.; Jiang, K.; Li, G.-D.; Wei, W.-J.; Li, Y.; Gao, K. Org. Lett. 2015, 17, 2760.
|
| [24] |
Alekseychuk, M.; Adrian, S.; Heinze, R. C.; Heretsch, P. J. Am. Chem. Soc. 2022, 144, 11574.
|
| [25] |
Callaghan, O.; Lampard, C.; Kennedy, A. R.; Murphy, J. A. J. Chem. Soc., Perkin Trans. 1 , 1999, 995.
|
| [26] |
Ackland, M. J.; Hanson, J. R.; Hitchcock, P. B. J. Chem. Soc., Perkin Trans. 1 , 1985, 843.
|
| [27] |
Cortezano-Arellano, O. C.; Quintero, L.; Sartillo-Piscil, F. J. Org. Chem. 2015, 80, 2601.
|
| [28] |
Huang, Z.; Lumb, J. P. Nat. Chem. 2021, 13, 24.
|
| [29] |
Carroll-Pöhls, M.; Lumb, J. P. ChemCatChem 2024, 16, e202301290.
|
| [1] | 杨雪莹, 徐园双, 张新迎, 范学森. 基于2-芳基-3H-吲哚与环丙醇的串联反应合成C2-螺环吲哚啉衍生物[J]. 有机化学, 2025, 45(2): 694-706. |
| [2] | 曹素芳, 刘云云, 万结平. α-三氟甲基酮的合成及其脱氟转化反应研究进展[J]. 有机化学, 2025, 45(1): 86-103. |
| [3] | 孟书玉, 郭闻涛, 王全瑞. 基于炔基亚砜与炔酰胺/炔醚的交叉偶联/[3,3]-硫鎓离子重排串联策略构筑四取代呋喃[J]. 有机化学, 2024, 44(7): 2274-2285. |
| [4] | 何蔺恒, 夏稳, 周玉祥, 于贤勇. 电催化N-芳基甘氨酸和苯并[e][1,2,3]噁噻嗪-2,2-二氧化物的串联脱羧环化反应[J]. 有机化学, 2024, 44(3): 997-1004. |
| [5] | 曾成富, 何媛, 李清, 董琳. Ir(III)催化新型三组分串联三氟乙氧基化反应并一锅法构建复杂酰胺化合物[J]. 有机化学, 2023, 43(3): 1115-1123. |
| [6] | 李硕, 王明亮, 周来运, 王兰芝. 磁性纳米负载对甲苯磺酸催化串联合成稠合多环的1,5-苯并氧氮杂䓬类化合物[J]. 有机化学, 2023, 43(11): 3977-3988. |
| [7] | 石云, 肖婷, 夏冬, 杨文超. 三氟甲硫基自由基引发不饱和烃的串联反应[J]. 有机化学, 2022, 42(9): 2715-2727. |
| [8] | 赵晓正, 凌琴琴, 曹桂妍, 火星, 赵小龙, 苏瀛鹏. 炔丙醇类化合物参与的环化反应研究进展[J]. 有机化学, 2022, 42(9): 2605-2639. |
| [9] | 周旭煜, 张爱君, 张庆庆, 刘庆安, 宣俊. 可见光诱导4-色满酮合成: 醋酸碘苯促进的α-酮酸与邻-烯丙氧基芳醛的自由基串联环化反应[J]. 有机化学, 2022, 42(8): 2488-2495. |
| [10] | 侯金松, 杨高升. 三(邻二甲胺基苄基)钇催化脂肪胺对烯腈的插入串联反应[J]. 有机化学, 2022, 42(7): 2070-2078. |
| [11] | 袁飞, 赵艳, 郭青松, 尹福丹, 赖金荣, 念倍芳, 张明, 汤峨. 乙烯基硒盐参与的串联反应合成1-[1-(胺基)环丙基]酮化合物[J]. 有机化学, 2022, 42(6): 1759-1769. |
| [12] | 孙鑫, 屈超凡, 马超蕊, 赵筱薇, 柴国璧, 江智勇. 光氧化还原催化串联自由基加成反应构建1,4-二酮官能团化喹喔啉-2(1H)-酮衍生物[J]. 有机化学, 2022, 42(5): 1396-1406. |
| [13] | 肖立伟, 刘光仙, 任萍, 吴彤桐, 卢玉伟, 孔洁. 单质硫: 合成含硫杂环的优质硫源[J]. 有机化学, 2022, 42(4): 1002-1012. |
| [14] | 乔辉杰, 杨利婷, 陈雅, 王嘉琳, 孙武轩, 董昊博, 王云威. 温和条件下高效合成咪唑并杂环-肼类衍生物的三组分串联反应[J]. 有机化学, 2022, 42(4): 1188-1197. |
| [15] | 罗享豪, 谢益碧, 黄年玉, 王龙. 基于原位捕获异腈的Ugi四组分反应及其后修饰串联反应: 一锅法合成含氮杂环化合物[J]. 有机化学, 2022, 42(3): 838-846. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||