有机化学 ›› 2019, Vol. 39 ›› Issue (10): 2946-2951.DOI: 10.6023/cjoc201904050 上一篇 下一篇
所属专题: 碳氢活化合辑2018-2019
研究简报
收稿日期:2019-04-20
修回日期:2019-05-14
发布日期:2019-06-12
通讯作者:
何树华
E-mail:thshuhua@163.com
基金资助:
Wu, Yan, Luo, Fan, Pan, Shimin, Li, Yuhan, He, Shuhua*( )
)
Received:2019-04-20
Revised:2019-05-14
Published:2019-06-12
Contact:
He, Shuhua
E-mail:thshuhua@163.com
Supported by:文章分享

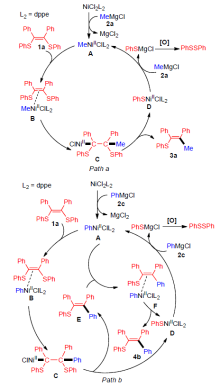
以5.0 mol% NiCl2(dppe)作为催化剂, 催化(Z)-1,2-二芳硫基-1,2-二芳基烯烃和格氏试剂偶联反应, 高选择性制备了一系列多取代烯烃化合物. 有机硫基团经水解、氧化后生成二芳基二硫醚, 实现了硫资源的循环利用, 符合绿色化学要求. 同时, 此方法对不同取代的(Z)-1,2-二芳硫基-1,2-二芳基烯烃和格氏试剂均具有较好的适用性, 以较高的产率获得相应的目标产物, 为多取代烯烃的制备提供了有效的路径.
吴燕, 罗凡, 潘世敏, 李玉涵, 何树华. 镍催化(Z)-1,2-二芳硫基-1,2-二芳基烯烃与格氏试剂偶联反应制备多取代烯烃[J]. 有机化学, 2019, 39(10): 2946-2951.
Wu, Yan, Luo, Fan, Pan, Shimin, Li, Yuhan, He, Shuhua. Nickel-Catalyzed Coupling of 1,2-Diarylthio-1,2-diarylalkenes with Grignard Reagents for Synthesis of Multi-substituted Alkenes[J]. Chinese Journal of Organic Chemistry, 2019, 39(10): 2946-2951.
| Entry | Catalyst (mol%) | Ligand (mol%) | Solvent | Temp./℃ | Time/h | Yieldb/% of 3a |
|---|---|---|---|---|---|---|
| 1 | NiF2 (25) | PPh3 (25) | THF | 80 | 6.0 | 21 |
| 2 | NiF2 (25) | dppe (25) | THF | 80 | 6.0 | 34 |
| 3 | NiF2 (25) | PCy3 (25) | THF | 80 | 6.0 | Trace |
| 4 | NiCl2 (25) | dppe (25) | THF | 80 | 6.0 | 38 |
| 5 | NiBr2 (25) | dppe (25) | THF | 80 | 6.0 | 32 |
| 6 | Ni(acac)2 (25) | dppe (25) | THF | 80 | 6.0 | Trace |
| 7 | Ni(OAc)2 (25) | dppe (25) | THF | 80 | 6.0 | Trace |
| 8 | NiCl2(PPh3)2 (25) | dppe (25) | THF | 80 | 6.0 | 25 |
| 9 | NiCl2(dppe) (25) | — | THF | 80 | 6.0 | 82 |
| 10 | NiCl2(dppe) (25) | — | Toluene | 80 | 6.0 | 78 |
| 11 | NiCl2(dppe) (25) | — | DCM | 80 | 6.0 | 62 |
| 12 | NiCl2(dppe) (25) | — | CH3CN | 80 | 6.0 | 74 |
| 13 | NiCl2(dppe) (10) | — | THF | 80 | 6.0 | 65 |
| 14 | NiCl2(dppe) (10) | — | THF | 120 | 6.0 | 60 |
| 15 | NiCl2(dppe) (10) | — | THF | 80 | 8.0 | 72 |
| 16 | NiCl2(dppe) (10) | — | THF | 80 | 12 | 81 |
| 17 | NiCl2(dppe) (5.0) | — | THF | 80 | 20 | 89 (87)c |
| 18 | NiCl2(dppe) (1.0) | — | THF | 80 | 30 | 48 |
| 19d | NiCl2(dppe) (5.0) | — | THF | 80 | 20 | 89 |
| Entry | Catalyst (mol%) | Ligand (mol%) | Solvent | Temp./℃ | Time/h | Yieldb/% of 3a |
|---|---|---|---|---|---|---|
| 1 | NiF2 (25) | PPh3 (25) | THF | 80 | 6.0 | 21 |
| 2 | NiF2 (25) | dppe (25) | THF | 80 | 6.0 | 34 |
| 3 | NiF2 (25) | PCy3 (25) | THF | 80 | 6.0 | Trace |
| 4 | NiCl2 (25) | dppe (25) | THF | 80 | 6.0 | 38 |
| 5 | NiBr2 (25) | dppe (25) | THF | 80 | 6.0 | 32 |
| 6 | Ni(acac)2 (25) | dppe (25) | THF | 80 | 6.0 | Trace |
| 7 | Ni(OAc)2 (25) | dppe (25) | THF | 80 | 6.0 | Trace |
| 8 | NiCl2(PPh3)2 (25) | dppe (25) | THF | 80 | 6.0 | 25 |
| 9 | NiCl2(dppe) (25) | — | THF | 80 | 6.0 | 82 |
| 10 | NiCl2(dppe) (25) | — | Toluene | 80 | 6.0 | 78 |
| 11 | NiCl2(dppe) (25) | — | DCM | 80 | 6.0 | 62 |
| 12 | NiCl2(dppe) (25) | — | CH3CN | 80 | 6.0 | 74 |
| 13 | NiCl2(dppe) (10) | — | THF | 80 | 6.0 | 65 |
| 14 | NiCl2(dppe) (10) | — | THF | 120 | 6.0 | 60 |
| 15 | NiCl2(dppe) (10) | — | THF | 80 | 8.0 | 72 |
| 16 | NiCl2(dppe) (10) | — | THF | 80 | 12 | 81 |
| 17 | NiCl2(dppe) (5.0) | — | THF | 80 | 20 | 89 (87)c |
| 18 | NiCl2(dppe) (1.0) | — | THF | 80 | 30 | 48 |
| 19d | NiCl2(dppe) (5.0) | — | THF | 80 | 20 | 89 |
| Entry | R1 | R2 | R3 | X | Product | Yieldb/% |
|---|---|---|---|---|---|---|
| 1 | Ph | Ph | Me | Cl | 3a | 87 |
| 2 | Ph | 4-MeC6H4 | Me | Cl | 3b | 86 |
| 3 | Ph | 4-MeOC6H4 | Me | Cl | 3c | 85 |
| 4 | Ph | 4-MeC6H4 | Et | Cl | 3d | 86 |
| 5 | 3-ClC6H4 | Ph | Et | Cl | 3e | 72 |
| 6 | Ph | Ph | Et | Cl | 3f | 88 |
| 7 | Ph | Ph | Ph | Br | 4b | 79 |
| 8 | Ph | 4-MeC6H4 | Ph | Br | 4b | 72 |
| 9 | 4-FC6H4 | Ph | Ph | Br | 4c | 63 |
| 10 | Ph | Ph | 4-MeC6H4 | Br | 4d | 80 |
| 11 | Ph | 4-MeC6H4 | 4-MeC6H4 | Br | 4d | 84 |
| 12 | Ph | Ph | 2-MeOC6H4 | Br | 4e | Tracec |
| 13 | n-Pr | Ph | Ph | Br | N.R.d | |
| 14 | Ph | n-Pr | Ph | Br | N.R. |
| Entry | R1 | R2 | R3 | X | Product | Yieldb/% |
|---|---|---|---|---|---|---|
| 1 | Ph | Ph | Me | Cl | 3a | 87 |
| 2 | Ph | 4-MeC6H4 | Me | Cl | 3b | 86 |
| 3 | Ph | 4-MeOC6H4 | Me | Cl | 3c | 85 |
| 4 | Ph | 4-MeC6H4 | Et | Cl | 3d | 86 |
| 5 | 3-ClC6H4 | Ph | Et | Cl | 3e | 72 |
| 6 | Ph | Ph | Et | Cl | 3f | 88 |
| 7 | Ph | Ph | Ph | Br | 4b | 79 |
| 8 | Ph | 4-MeC6H4 | Ph | Br | 4b | 72 |
| 9 | 4-FC6H4 | Ph | Ph | Br | 4c | 63 |
| 10 | Ph | Ph | 4-MeC6H4 | Br | 4d | 80 |
| 11 | Ph | 4-MeC6H4 | 4-MeC6H4 | Br | 4d | 84 |
| 12 | Ph | Ph | 2-MeOC6H4 | Br | 4e | Tracec |
| 13 | n-Pr | Ph | Ph | Br | N.R.d | |
| 14 | Ph | n-Pr | Ph | Br | N.R. |

| [1] | (a) Witing, G.; Geissler, G. Justus Liebigs Ann. Chem. 1953,44. |
| (b) Staudinger, H.; Meyer, J. Helv. Chim. Acta 1919, 2, 619. | |
| [2] |
Lu, L.-H.; Wang, Z.; Xia, W.; Cheng, P.; Zhang, B.; Cao, Z.; He, W.-M . Chin. Chem. Lett. 2019, 30, 1237.
doi: 10.1016/j.cclet.2019.04.033 |
| [3] |
Caturla, F.; Amat, M.; Reinoso, R. F.; Córdoba, M.; Warrellow, G. Bioorg. Med. Chem. Lett. 2006, 16, 3209.
doi: 10.1016/j.bmcl.2006.03.052 |
| [4] |
Zhang, Y.-H.; Shi, B.-F.; Yu, J.-Q. J. Am. Chem. Soc. 2009, 131, 5072.
doi: 10.1021/ja900327e |
| [5] |
Moragas, T.; Cornella, J.; Martin, R. J. Am. Chem. Soc. 2014, 136, 17702.
doi: 10.1021/ja509077a |
| [6] |
Oonishi, Y.; Ogura, J.; Sato, Y. Tetrahedron Lett. 2007, 48, 7505.
doi: 10.1016/j.tetlet.2007.08.061 |
| [7] |
Coulter, M. M.; Dornan, P. K.; Dong, V. M. J. Am. Chem. Soc. 2009, 131, 6932.
doi: 10.1021/ja901915u |
| [8] |
Guo, R.; Huang, J.; Zhao, X. ACS Catal. 2018, 8, 926.
doi: 10.1021/acscatal.7b03829 |
| [9] |
Zhou, C. X.; Larock, R. C. J. Org. Chem. 2005, 70, 3765.
doi: 10.1021/jo048265+ |
| [10] |
Takahashi, A.; Kirio, Y.; Sodeoka, M.; Sasai, H.; Shibasaki, M. J. Am. Chem. Soc. 1989, 111, 643.
doi: 10.1021/ja00184a036 |
| [11] |
Oishi, S.; Miyamoto, K.; Niida, A.; Yamamoto, M.; Ajito, K.; Tamamura, H.; Otaka, A.; Kuroda, Y.; Asai, A.; Fujii, N. Tetrahedron 2006, 62, 1416.
doi: 10.1016/j.tet.2005.11.033 |
| [12] |
Misumi, Y.; Masuda, T. Macromolecules 1998, 31, 7572.
doi: 10.1021/ma981265p |
| [13] |
Hall, H. K. J. Angew. Chem., Int. Ed. 1983, 22, 440.
doi: 10.1002/(ISSN)1521-3773 |
| [14] |
Schreivogel, A.; Maurer, J.; Winter, R.; Baro, A.; Laschat, S. Eur. J. Org. Chem. 2010, 2006, 3395.
doi: 10.1002/(ISSN)1099-0690 |
| [15] |
Urriolabeitia, E. P.; Villuendas, P.; Ruiz, S.; Vidossich, P.; Lledós, A . Chem-Eur. J. 2018, 24, 13124.
doi: 10.1002/chem.201802546 |
| [16] |
Trost, B. M.; Tracy, J. S. ACS Catal. 2019, 9, 1584.
doi: 10.1021/acscatal.8b04567 |
| [17] |
Wang, Q.; Liu, Z.; Lou, J.; Yu, Z. Org. Lett. 2018, 20, 6007.
doi: 10.1021/acs.orglett.8b02253 |
| [18] |
He, Z.; Kirchberg, S.; Fröhlich, R.; Studer, A. Angew. Chem., Int. Ed. 2012, 51, 3699.
doi: 10.1002/anie.v51.15 |
| [19] |
Wu, C.; Hong, L.; Shu, H.; Zhou, Q.-H.; Wang, Y.; Sun, M.; Jiang, S.; Cao, Z.; He, W.-M . ACS Sustainable Chem. Eng. 2019, 7, 8798.
doi: 10.1021/acssuschemeng.9b00708 |
| [20] |
Itami, K.; Mineno, M.; Muraoka, N.; Yoshida, J. J. Am. Chem. Soc. 2004, 126, 11778.
doi: 10.1021/ja045858t |
| [21] |
Mckinley, N. F.; O’Shea, D. F. J. Org. Chem. 2006, 71, 9552.
doi: 10.1021/jo061949s |
| [22] |
Nishihara, Y.; Miyasaka, M.; Okamoto, M.; Takahashi, H.; Inoue, E.; Tanemura, K.; Takagi, K. J. Am. Chem. Soc. 2007, 129, 12634.
doi: 10.1021/ja075234y |
| [23] |
Suero, M. G.; Bayle, E. D.; Collins, B. S. L.; Gaunt, M. J. J. Am. Chem. Soc. 2013, 135, 5332.
doi: 10.1021/ja401840j |
| [24] |
Alfaro, R.; Parra, A.; Aleman, J.; Ruano, J. L. G.; Tortosa, M. J. Am. Chem. Soc. 2012, 134, 15165.
doi: 10.1021/ja307670k |
| [25] |
Itami, K.; Kamei, T.; Yoshida, J. J. Am. Chem. Soc. 2003, 125, 14670.
doi: 10.1021/ja037566i |
| [26] |
Yoshida, H.; Kageyuki, I.; Takaki, K. Org. Lett. 2013, 15, 952.
doi: 10.1021/ol4001526 |
| [27] |
Reiser, O . Angew. Chem., Int. Ed. 2006, 45, 2838.
doi: 10.1002/(ISSN)1521-3773 |
| [28] |
Iwasaki, M.; Topolovčan, N.; Hu, H.; Nishimura, Y.; Gagnot, G.; Na, N. R.; Nakajima, K.; Nishihara, Y. Org. Lett. 2016, 18, 1642.
doi: 10.1021/acs.orglett.6b00503 |
| [29] |
Itami, K.; Higashi, S.; Mineno, M.; Yoshida, J. Org. Lett. 2005, 7, 1219.
doi: 10.1021/ol047504c |
| [30] |
Jiang, H.; Tang, X.; Xu, Z.; Wang, H.; Han, K.; Yang, X.; Zhou, Y.; Feng, Y.-L.; Yu, X.-Y.; Gui, Q. Org. Biomol. Chem. 2019, 17, 2715.
doi: 10.1039/C8OB02992J |
| [31] |
Bouchet, L. M.; Penenory, A. B.; Robert, M.; Arguello, J. E. RSC Adv. 2015, 5, 11753.
doi: 10.1039/C4RA16154H |
| [32] |
Prasad, C. D.; Sattar, M.; Kumar, S. Org. Lett. 2017, 19, 774.
doi: 10.1021/acs.orglett.6b03735 |
| [33] |
Chen, J.; Chen, S.; Xu, X.; Tang, Z.; Au, C. T.; Qiu, R. J. Org. Chem. 2016, 81, 3246.
doi: 10.1021/acs.joc.6b00203 |
| [34] |
Cha, M.; Shoner, S. C.; Kovacs, J. A. Inorg. Chem. 1993, 32, 1860.
doi: 10.1021/ic00061a052 |
| [35] |
Tzeng, Y.-L.; Yang, P.-F.; Mei, N.-W.; Yuan, T.-M.; Yu, C.-C.; Luh, T.-Y. J. Org. Chem. 1991, 56, 5289.
doi: 10.1021/jo00018a016 |
| [36] |
Ni, Z.-J.; Mei, N.-W.; Shi, X.; Tzeng, Y.-L.; Wang, M. C.; Luh, T.-Y. J. Org. Chem. 1991, 56, 4035.
doi: 10.1021/jo00012a043 |
| [37] | Ananikov, V. P.; Gayduk, K. A.; Orlov, N. V.; Beletskaya, I. P.; Khrustalev, V. N.; Mikhail, Yu, A . Chem-Eur. J. 2010, 16, 2067. |
| [38] |
Nambo, M.; Tahara, Y.; Yim, J. C.-H.; Crudden, C. M . Chem-Eur. J. 2019, 25, 1923.
doi: 10.1002/chem.v25.8 |
| [39] | Obora, Y.; Moriya, H.; Tokunaga, M.; Tsuji, Y . Chem. Commun. 2003, 22, 2820. |
| [40] |
Leung, C. W. T.; Hong, Y.; Chen, S.; Zhao, E.; Lam, J. W. Y.; Tang, B. Z. J. Am. Chem. Soc. 2013, 135, 62.
doi: 10.1021/ja310324q |
| [1] | 韩吉来, 唐美麟, 孙逊. 白藜芦醇二聚体Quadrangularin A和Pallidol合成方法学研究[J]. 有机化学, 2020, 40(6): 1571-1577. |
| [2] | 姜铨, 何玲, 李卫东. 多取代烯丙基硅化合物的立体选择性合成研究[J]. 有机化学, 2019, 39(12): 3454-3459. |
| [3] | 陈锦杨, 吴小波, 易荣楠, 许新华. 镍催化格氏试剂与二芳基乙炔偶联反应制备四取代萘[J]. 有机化学, 2017, 37(7): 1850-1854. |
| [4] | 陈程, 徐蒙蒙, 赵青, 刘承秀, 杨鸿均, 冯豫川. 盐酸黄连素的汇聚式合成研究[J]. 有机化学, 2017, 37(2): 503-507. |
| [5] | 李灵杰, 张敬, 唐渝, 许开天, 张渊明. 无催化剂一锅法合成4-取代喹唑啉[J]. 有机化学, 2017, 37(10): 2711-2716. |
| [6] | 康娟, 黄丹凤, 王克虎, 苏瀛鹏, 胡雨来, 常青. α-三氟甲基-α-羟基Weinreb酰胺的合成研究[J]. 有机化学, 2017, 37(1): 103-109. |
| [7] | 贾婉, 赵立志, 魏恒旭, 朱林东, 傅磊, 陈蔚春. 铁催化二级氯代烷烃与炔基格氏试剂的交叉偶联反应[J]. 有机化学, 2016, 36(5): 1060-1064. |
| [8] | 唐凤翔, 叶久勇. 铜催化格氏试剂不对称共轭加成研究进展[J]. 有机化学, 2015, 35(7): 1414-1427. |
| [9] | 赵蔚, 刘伟. Weinreb酰胺在有机合成中的应用进展[J]. 有机化学, 2015, 35(1): 55-69. |
| [10] | 刘雨燕, 方烨汶, 张莉, 金小平, 李瑞丰, 朱帅汝, 高浩其, 房江华, 夏勤波. LiCl促进的多官能团格氏试剂的制备及应用研究进展[J]. 有机化学, 2014, 34(8): 1523-1541. |
| [11] | 马丽芳, 吕文贤, 黄丹凤, 牛腾, 苏瀛鹏, 王克虎, 胡雨来. 菲啶类化合物的合成新方法[J]. 有机化学, 2014, 34(5): 962-967. |
| [12] | 唐金鹏, 唐渝, 杨骏, 张渊明. 单质硒促进的格氏试剂自偶联反应[J]. 有机化学, 2013, 33(05): 1010-1014. |
| [13] | 姚贵阳, 韦京辰, 戴伟龙, 杨达, 潘英明, 王恒山. 马来海松酸三甲酯区域选择性格氏加成反应研究[J]. 有机化学, 2013, 33(01): 138-142. |
| [14] | 朱新强, 阳年发, 任芳. 薄荷基氯格氏试剂与卤代烃的立体选择性反应研究[J]. 有机化学, 2010, 30(11): 1759-1763. |
| [15] | 汪顺义,纪顺俊. 铜络合物催化的格氏试剂不对称1,4-共轭加成反应研究进展[J]. 有机化学, 2008, 28(2): 181-186. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||