有机化学 ›› 2021, Vol. 41 ›› Issue (4): 1527-1542.DOI: 10.6023/cjoc202007034 上一篇 下一篇
综述与进展
收稿日期:2020-07-12
修回日期:2020-10-01
发布日期:2020-10-28
通讯作者:
贾丰成, 徐程
基金资助:
Fengcheng Jiaa,*( ), Na Luoa, Cheng Xub,*(
), Na Luoa, Cheng Xub,*( ), Anxin Wuc
), Anxin Wuc
Received:2020-07-12
Revised:2020-10-01
Published:2020-10-28
Contact:
Fengcheng Jia, Cheng Xu
About author:Supported by:文章分享

靛红是一种吲哚系天然小分子化合物, 由于其结构独特、廉价易得, 利用靛红作为起始原料来构建结构复杂多样的杂环化合物一直是有机合成领域的研究热点. 由于靛红具有丰富的反应位点, 在转化为类似的“近亲”杂环方面具有显著的步骤优势. 近年来基于靛红的串联反应构建杂环化合物方面研究取得了诸多进展. 根据合成杂环种类的不同, 对靛红参与的串联反应合成苯并杂环化合物的研究进展进行了简要论述.
贾丰成, 罗娜, 徐程, 吴安心. 靛红在苯并氮杂环类化合物的合成应用进展[J]. 有机化学, 2021, 41(4): 1527-1542.
Fengcheng Jia, Na Luo, Cheng Xu, Anxin Wu. Recent Advances in the Synthesis of Benzoheterocyclic Compounds Involving Isatins[J]. Chinese Journal of Organic Chemistry, 2021, 41(4): 1527-1542.
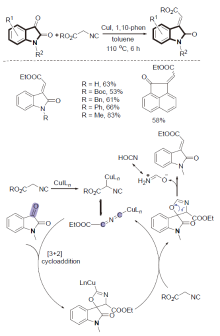
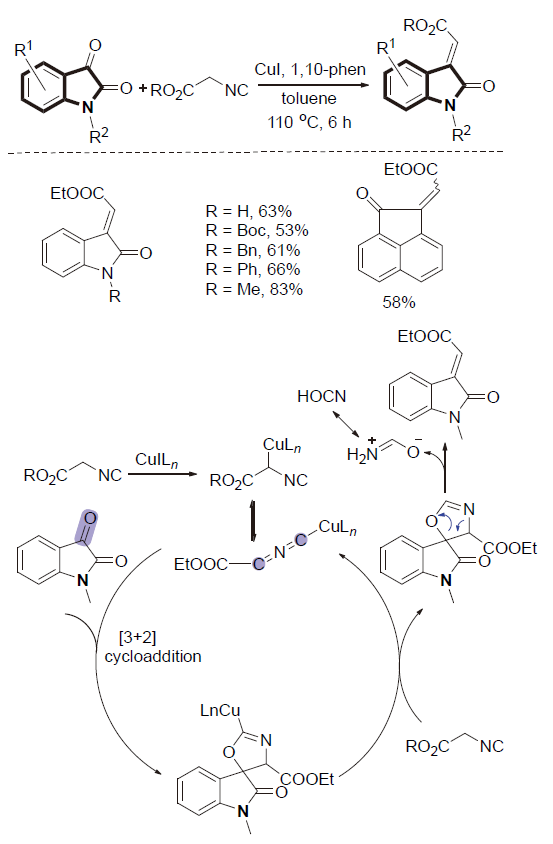


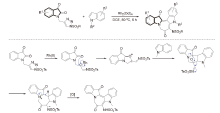
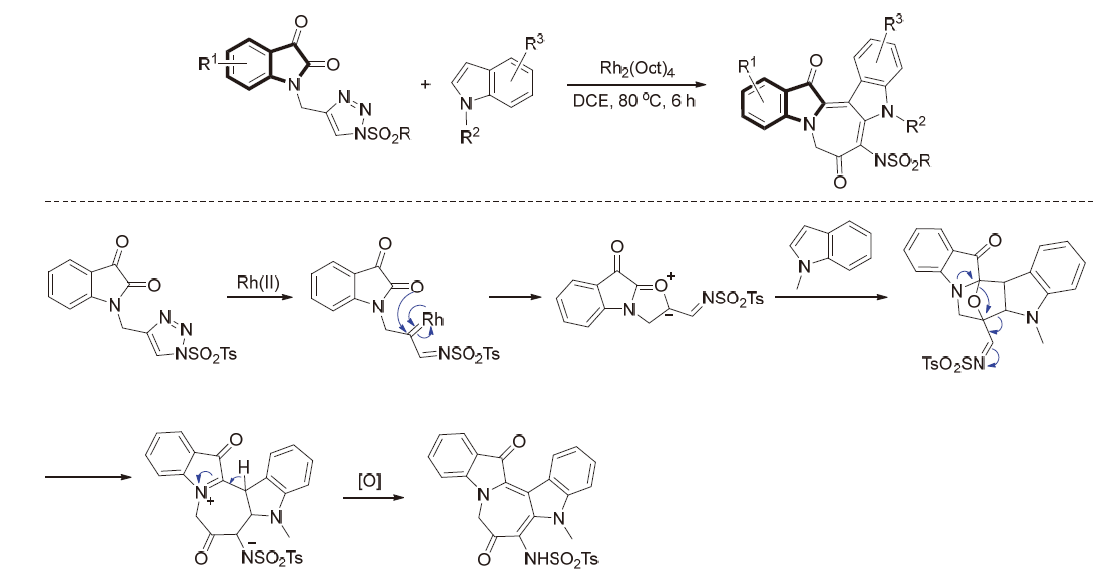
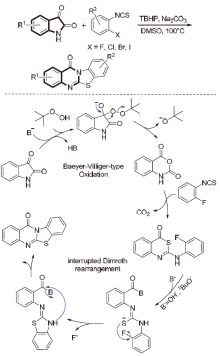
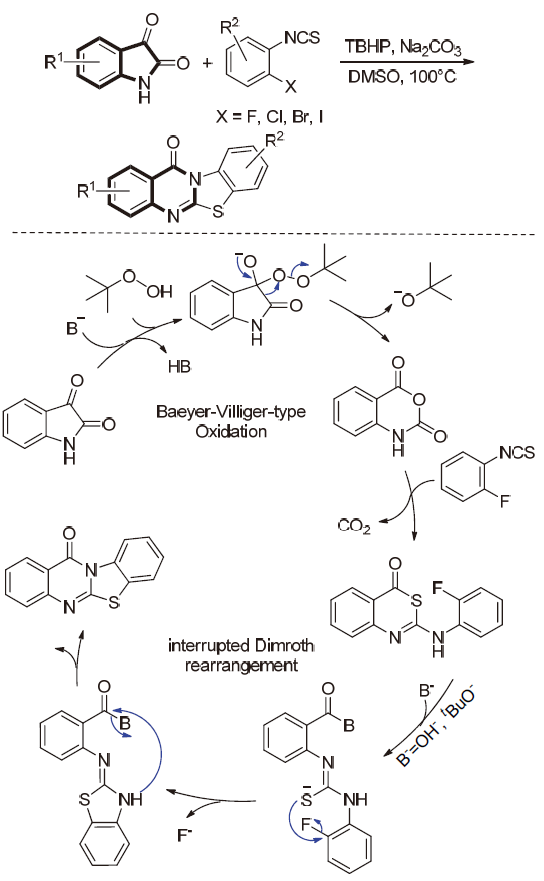
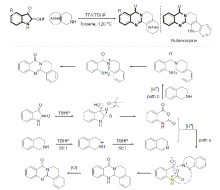
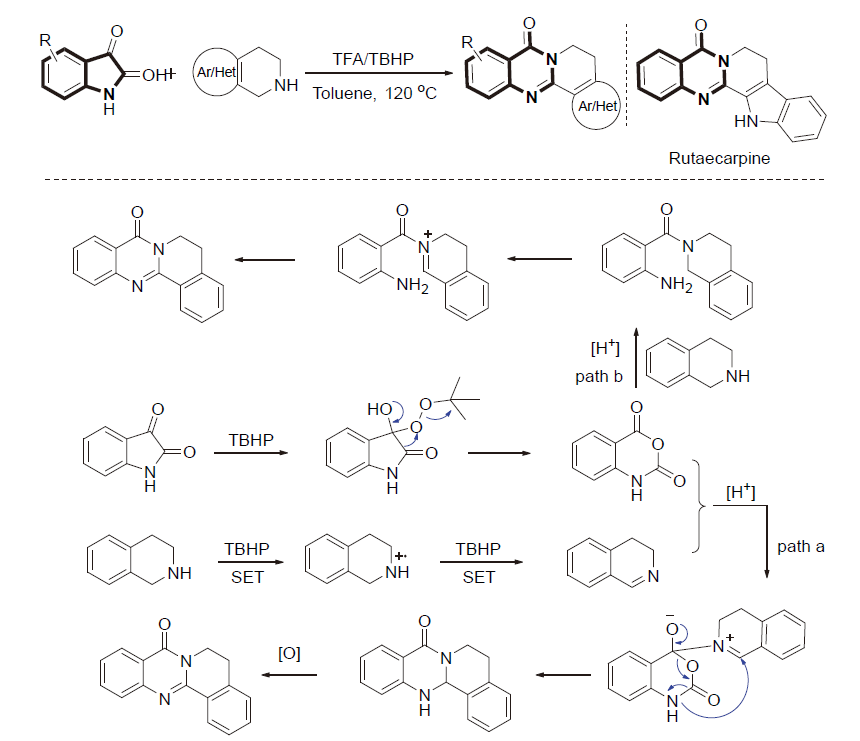


| [1] |
(a) Silva, J.; Garden, S.; Pinto, A. J. Braz. Chem. Soc. 2001, 12,273.
|
|
(b) Bergman, J.; Lindström, J.O. Tetrahedron 1985, 41,2879.
|
|
| [2] |
(a) Raj, A.; Raghunathan, R.; Sridevikumaria, M.R.; Raman, N. Bioorg. Med. Chem. 2003, 11,407.
pmid: 20696500 |
|
(b) Tripathy, R.; Reiboldt, A.; Messina, P.; Iqbal, M.; Singh, J.; Bacon, E.; Angeles, T.; Yang, S.; Albom, M.; Robinson, C.; Chang, H.; Ruggeri, B.; Mallamo, J. Bioorg. Med. Chem. Lett. 2006, 16,2158.
doi: 10.1016/j.bmcl.2006.01.063 pmid: 20696500 |
|
|
(c) Jiang, T.; Kuhen, K.; Wolff, K.; Yin, H.; Bieza, K.; Caldwell, J.; Bursulaya, B.; Tuntland, T.; Zhang, K.; Karanewsky, D.; He, Y. Bioorg. Med. Chem. Lett. 2006, 16,2109.
pmid: 20696500 |
|
|
(d) Bal, T.; Anand, B.; Yogeeswari, P.; Sriram, D. Bioorg. Med. Chem. Lett. 2005, 15,4451.
doi: 10.1016/j.bmcl.2005.07.046 pmid: 20696500 |
|
|
(e) Aboul-Fadl, T.; Bin-Jubair, F.; Aboul-Wafa, O. Eur. J. Med. Chem. 2010, 45,4578.
doi: 10.1016/j.ejmech.2010.07.020 pmid: 20696500 |
|
| [3] |
(a) Marti, C.; Carreira, E.M. J. Am. Chem. Soc. 2005, 127,11505.
doi: 10.1021/ja0518880 pmid: 16599614 |
|
(b) Mitsunuma, H.; Shibasaki, M.; Kanai, M.; Matsunaga, S. Angew. Chem. Int. Ed. 2012, 51,5217.
pmid: 16599614 |
|
|
(c) Hodges, T.R.; Benjamin, N.M.; Martin, S.F. Org. Lett. 2017, 19,2254.
doi: 10.1021/acs.orglett.7b00735 pmid: 16599614 |
|
|
(d) Wu, H.; Xue, F.; Xiao, X.; Qin, Y. J. Am. Chem. Soc. 2010, 132,14052.
pmid: 16599614 |
|
|
(e) Hughes, C.C.; Fenical, W. J. Am. Chem. Soc. 2010, 132,2528.
pmid: 16599614 |
|
|
(f) Sun, C.; Lin, X.; Weinreb, S.M. J. Org. Chem. 2006, 71,3159.
doi: 10.1021/jo060084f pmid: 16599614 |
|
| [4] |
(a) Kumar, V.; Poonam; Prasad, A.K.; Parmar, V.S. Nat. Prod. Rep. 2003, 20,565.
doi: 10.1039/b303648k pmid: 14700200 |
|
(b) Bentley, K.W. Nat. Prod. Rep. 2006, 23,444.
pmid: 14700200 |
|
| [5] |
(a) Liu, Y, H. Liaoning Med. 2002, (4),18. (in Chinese)
pmid: 18625562 |
|
( 刘英华, 辽宁医药, 2002, (4),18.)
pmid: 18625562 |
|
|
(b) Gundla, R.; Kazemi, R.; Sanam, R.; Muttineni, R.; Sarma, J. A., R.P.; Dayam, R.; Neamati, N. J. Med. Chem. 2008, 51,3367.
pmid: 18625562 |
|
|
(c) Mendes da Silva, J.F.; Walters, M.; Al-Damluji, S.; Ganellin, C.R. Bioorg. Med. Chem. 2008, 16,7254.
doi: 10.1016/j.bmc.2008.06.037 pmid: 18625562 |
|
| [6] |
(a) Ma, Z.Z.; Hano, Y.; Nomura, T.; Chen, Y.J. Heterocycles 1997, 46,541.
pmid: 20251439 |
|
(b) Michael, J.P. Nat. Prod. Rep. 2007, 24,223.
doi: 10.1039/b509528j pmid: 20251439 |
|
|
(c) Koepfli, J.B.; Mead, J.F.; Brockman, J. A. J. Am. Chem. Soc. 1947, 69,1837.
doi: 10.1021/ja01199a513 pmid: 20251439 |
|
|
(d) Koepfli, J.B.; Mead, J.F.; Brockman, J. A. J. Am. Chem. Soc. 1949, 71,1048.
pmid: 20251439 |
|
|
(e) Ablondi, F.; Gordon, S.; Morton, J.II, Williams, J.H. J. Org. Chem. 1952, 17,14.
pmid: 20251439 |
|
| [7] |
Manfroni, G.; Cannalire, R.; Barreca, M.L.; Kaushik-Basu, N.; Leyssen, P.; Winquist, J.; Iraci, N.; Manvar, D.; Paeshuyse, J.; Guhamazumder, R.; Basu, A.; Sabatini, S.; Tabarrini, O.; Danielson, U.H.; Neyts, J.; Cecchetti, V. J. Med. Chem. 2014, 57,1952.
pmid: 24131104 |
| [8] |
(a) Yang, Z.; Huang, D.; Wen, L.; Wang, J.; Wang, K.; Hu, Y. Chin. J. Org. Chem. 2018, 38,1725. (in Chinese)
pmid: 22950860 |
|
( 杨政, 黄丹凤, 文岚, 王娟娟, 王克虎, 胡雨来, 有机化学, 2018, 38,1725.)
pmid: 22950860 |
|
|
(b) Yang, F.; Sun, J.; Gao, H.; Yan, C.G. RSC Adv. 2015, 5,32786.
pmid: 22950860 |
|
|
(c) Singh, G.S.; Desta, Z.Y. Chem. Rev. 2012, 112,6104.
doi: 10.1021/cr300135y pmid: 22950860 |
|
|
(d) Liu, Y.; Wang, H.; Wan, J. Asian J. Org. Chem. 2013, 2,374.
pmid: 22950860 |
|
|
(e) Varun, V.; Sonam, S.; Kakkar, R. Med. Chem. Commun. 2019, 10,351.
pmid: 22950860 |
|
| [9] |
Cheng, D.; Ling, F.; Zheng, C.; Ma, C. Org. Lett. 2016, 18,2435.
doi: 10.1021/acs.orglett.6b00964 pmid: 27149101 |
| [10] |
Yuan, W.K.; Cui, T.; Liu, W.; Wen, L.R.; Li, M. Org. Lett. 2018, 20,1513.
doi: 10.1021/acs.orglett.8b00217 pmid: 29517237 |
| [11] |
Ao, C.; Yang, X.; Jia, S.; Xu, X.; Yuan, Y.; Zhang, D.; Hu, W. J. Org. Chem. 2019, 84,15331.
doi: 10.1021/acs.joc.9b02350 pmid: 31702914 |
| [12] |
Xu, T.; Chen, K.; Zhu, H.Y.; Hao, W.J.; Tu, S.J.; Jiang, B. Org. Lett. 2020, 22,2414.
pmid: 32148050 |
| [13] |
Ramakumar, K.; Maji, T.; Partridge, J.J.; Tunge, J.A. Org. Lett. 2017, 19,4014.
doi: 10.1021/acs.orglett.7b01752 pmid: 28737400 |
| [14] |
(a) Zhu, S.; Chen, C.; Duan, K.; Sun, Y.M.; Li, S.S.; Liu, Q.; Xiao, J. J. Org. Chem. 2019, 84,8440.
pmid: 30721075 |
|
(b) Li, S.S.; Zhu, S.; Chen, C.; Duan, K.; Liu, Q.; Xiao, J. Org. Lett. 2019, 21,1058.
pmid: 30721075 |
|
|
(c) Wang, S.; An, X.D.; Li, S.S.; Liu, X.; Liu, Q.; Xiao, J. Chem. Commun. 2018, 54,13833.
pmid: 30721075 |
|
| [15] |
Wang, L.; Du, Z.; Peng, S.; Zhang, K.; Wang, J. Adv. Synth. Catal. 2014, 356,2943.
|
| [16] |
Pal, K.; Shukla, R.K.; Volla, C.M. R. Org. Lett. 2017, 19,5764.
doi: 10.1021/acs.orglett.7b02697 pmid: 29058439 |
| [17] |
Jiang, S.; Li, K.; Yan, J.; Shi, K.; Zhao, C.; Yang, L.; Zhong, G. J. Org. Chem. 2017, 82,9779.
doi: 10.1021/acs.joc.7b00547 pmid: 28829132 |
| [18] |
(a) Mei, G.J.; Bian, C.Y.; Li, G.H.; Xu, S.L.; Zheng, W.Q.; Shi, F. Org. Lett. 2017, 19,3219.
pmid: 30023685 |
|
(b) Jiang, K.M.; Luesakul, U.; Zhao, S.Y.; An, K.; Muangsin, N.; Neamati, N.; Jin, Y.; Lin, J. ACS Omega 2017, 2,3123.
doi: 10.1021/acsomega.7b00490 pmid: 30023685 |
|
| [19] |
Kahar, N.; Jadhav, P.; Reddy, R.V. R.; Dawande, S. Chem. Commun. 2020, 56,1207.
|
| [20] |
Wang, L.; Huang, J.; Peng, S.; Liu, H.; Jiang, X.; Wang, J. Angew. Chem. Int. Ed. 2012, 52,1768.
|
| [21] |
(a) Pfitzinger, W. J. Prak. Chem. 1886, 33,100.
|
|
(b) Zhu, H.; Yang, R.F.; Yun, L.H.; Li, J. Chin. Chem. Lett. 2010, 21,35.
|
|
| [22] |
(a) Yu, F.; Yan, S.; Hu, L.; Wang, Y.; Lin, J. Org. Lett. 2011, 13,4782.
pmid: 21848302 |
|
(b) Xu, H.; Zhou, B.; Zhou, P.; Zhou, J.; Shen, Y.; Yu, F.C.; Lu, L.L. Chem. Commun. 2016, 52,8002.
pmid: 21848302 |
|
| [23] |
(a) Wang, H.; Li, L.; Lin, W.; Xu, P.; Huang, Z.; Shi, D. Org. Lett. 2012, 14,4598.
doi: 10.1021/ol302058g pmid: 22920713 |
|
(b) Hao, W.J.; Wang, J.Q.; Xu, X.P.; Zhang, S.L.; Wang, S.Y.; Ji, S.J. J. Org. Chem. 2013, 78,12362.
pmid: 22920713 |
|
| [24] |
(a) Gao, Q.; Liu, Z.; Wang, Y.; Wu, X.; Zhang, J.; Wu, A. Adv. Synth. Catal. 2018, 360,1364.
|
|
(b) Ramaraju, A.; Chouhan, N.K.; Ravi, O.; Sridhar, B.; Bathula, S.R. Eur. J. Org. Chem. 2018,2963.
|
|
| [25] |
Wang, B.Q.; Zhang, C.H.; Tian, X.X.; Lin, J.; Yan, S.J. Org. Lett. 2018, 20,660.
pmid: 29323495 |
| [26] |
(a) Mhaske, S.B.; Argade, N.P. Tetrahedron 2006, 62,9787.
pmid: 25147608 |
|
(b) Lee, S.; Son, J.K.; Jeong, B.; Jeong, T.C.; Chang, H.; Lee, E.S.; Jahng, Y. Molecules 2008, 13,272.
doi: 10.3390/molecules13020272 pmid: 25147608 |
|
|
(c) D'yakonov, A.L.; Telezhenetskaya, M.V. Chem. Nat. Compd. 1997, 33,221.
pmid: 25147608 |
|
|
(d) Michael, J.P. Nat. Prod. Rep. 2008, 25,166.
doi: 10.1039/b612168n pmid: 25147608 |
|
|
(e) Fang, J.; Zhou, J. Org. Biomol. Chem. 2012, 10,2389.
doi: 10.1039/c2ob07178a pmid: 25147608 |
|
|
(f) Li, Y.; Feng, T.; Liu, P.; Liu, C.; Wang, X.; Li, D.; Li, N.; Chen, M.; Xu, Y.; Si, S. ACS Med. Chem. Lett. 2014, 5,884.
pmid: 25147608 |
|
|
(g) Liang, J.L.; Cha, H.C.; Jahng, Y. Molecules 2011, 16,4861.
pmid: 25147608 |
|
| [27] |
Jia, F.C.; Zhou, Z.W.; Xu, C.; Wu, Y.D.; Wu, A.X. Org. Lett. 2016, 18,2942.
|
| [28] |
Zhou, Z.W.; Jia, F.C.; Xu, C.; Jiang, S.F.; Wu, Y.D.; Wu, A.X. Chem. Commun. 2017, 53,1056.
|
| [29] |
Jia, F.C.; Chen, T.Z.; Hu, X.Q. Org. Chem. Front. 2020, 7,1635.
|
| [30] |
Li, P.G.; Yan, C.; Zhu, S.; Liu, S.H.; Zou, L.H. Org. Chem. Front. 2018, 5,3464.
|
| [31] |
Liu, M.; Shu, M.; Yao, C.; Yin, G.; Wang, D.; Huang, J. Org. Lett. 2016, 18,824.
|
| [32] |
Wang, L.C.; Du, S.; Chen, Z.; Wu, X.F. Org. Lett. 2020, 22,5567.
pmid: 32610908 |
| [33] |
Balwe, S.G.; Jeong, Y.T. Org. Chem. Front. 2018, 5,1628.
|
| [34] |
(a) Manfroni, G.; Cannalire, R.; Barreca, M. L.; Kaushik-Basu, N.; Leyssen, P.; Winquist, J.; Iraci, N.; Manvar, D.; Paeshuyse, J.; Guhamazumder, R.; Basu, A.; Sabatini, S.; Tabarrini, O.; Danielson, U. H.; Neyts, J.; Cecchetti, V. T. J. Med. Chem. 2013, 57,1952.
pmid: 2999403 |
|
(b) Chou, L. C.; Tsai, M. T.; Hsu, M. H.; Wang, S. H.; Way, T. D.; Huang, C. H.; Lin, H. Y.; Qian, K.; Dong, Y.; Lee, K. H.; Huang, L. J.; Kuo, S. C. J. Med. Chem. 2010, 53,8047.
pmid: 2999403 |
|
|
(c) Accurso, F.J.; Rowe, S.M.; Clancy, J.P.; Boyle, M.P.; Dunitz, J.M.; Durie, P.R.; Sagel, S.D.; Hornick, D.B.; Konstan, M.W.; Donaldson, S.H.; Moss, R.B.; Pilewski, J.M.; Rubenstein, R.C.; Uluer, A.Z.; Aitken, M.L.; Freedman, S.D.; Rose, L.M.; Mayer- Hamblett, N.; Dong, Q.M.; Zha, J.H.; Stone, A.J.; Olson, E.R.; Ordonez, C.L.; Campbell, P.W.; Ashlock, M.A.; Ramsey, B.W. N. Engl. J. Med. 2010, 363,1991.
pmid: 2999403 |
|
|
(d) Hazuda, D. J. Science 2000, 287,646.
pmid: 2999403 |
|
|
(e) Cairns, H.; Cox, D.; Gould, K. J.; Ingall, A. H.; Suschitzky, J. L. J. Med. Chem. 1985, 28,1832.
doi: 10.1021/jm00150a014 pmid: 2999403 |
|
| [35] |
Jiang, S.F.; Xu, C.; Zhou, Z.W.; Zhang, Q.; Wen, X.H.; Jia, F.C.; Wu, A.X. Org. Lett. 2018, 20,4231.
pmid: 29953242 |
| [36] |
Ma, Y.; Zhu, Y.; Zhang, D.; Meng, Y.; Tang, T.; Wang, K.; Ma, J.; Wang, J.; Sun, P. Green Chem. 2019, 21,478.
|
| [37] |
Li, W.; Liu, X.; Hao, X.; Cai, Y.; Lin, L.; Feng, X. Angew. Chem. Int. Ed. 2012, 51,8644.
|
| [38] |
(a) Zeng, R.; Dong, G. J. Am. Chem. Soc. 2015, 137,1408.
doi: 10.1021/ja512306a pmid: 27699088 |
|
(b) Zeng, R.; Chen, P.H.; Dong, G. ACS Catal. 2016, 6,969.
doi: 10.1021/acscatal.5b02532 pmid: 27699088 |
|
| [39] |
Prakash, R.; Gogoi, S. Adv. Synth. Catal. 2016, 358,3046.
|
| [40] |
Shi, R.G.; Wang, X.H.; Liu, R.; Yan, C.G. Chem. Commun. 2016, 52,6280.
|
| [41] |
For selected papers, see: (a) Banerjee, A.; Santra, S. K.; Mohanta, P. R.; Patel, B. K. Org. Lett. 2015, 17,5678.
doi: 10.1021/acs.orglett.5b02967 pmid: 32227905 |
|
(b) McCauley, J.; Rudd, M.; Nguyen, K.; McIntyre, C.; Romano, J.; Bush, K.; Varga, S.; Ross, C.; Carroll, S.; DiMuzio, J.; Stahlhut, M.; Olsen, D.; Lyle, T.; Vacca, J.; Liverton, N. Angew. Chem. Int. Ed. 2008, 47,9104.
pmid: 32227905 |
|
|
(c) Felicetti, T.; Cannalire, R.; Pietrella, D.; Latacz, G.; Lubelska, A.; Manfroni, G.; Barreca, M.L.; Massari, S.; Tabarrini, O.; Kieć-Kononowicz, K.; Schindler, B.D.; Kaatz, G.W.; Cecchetti, V.; Sabatini, S. J. Med. Chem. 2018, 61,7827.
pmid: 32227905 |
|
|
(d) Dong, F.; Liu, J.Q.; Wang, X.S. Org. Lett. 2020, 22,2887.
doi: 10.1021/acs.orglett.0c00497 pmid: 32227905 |
|
|
(e) Qiu, Q.; Liu, B.; Cui, J.; Li, Z.; Deng, X.; Qiang, H.; Li, J.; Liao, C.; Zhang, B.; Shi, W.; Pan, M.; Huang, W.; Qian, H. J. Med. Chem. 2017, 60,3289.
pmid: 32227905 |
| [1] | 曾成富, 何媛, 李清, 董琳. Ir(III)催化新型三组分串联三氟乙氧基化反应并一锅法构建复杂酰胺化合物[J]. 有机化学, 2023, 43(3): 1115-1123. |
| [2] | 刘婷婷, 胡宇才, 沈安. 亚胺配体协同氮杂环卡宾钯配合物催化碳碳偶联反应的作用机制[J]. 有机化学, 2023, 43(2): 622-628. |
| [3] | 刘悦灵, 钟欣欣, 张干兵. Pd(0)催化1-R-3-苯基亚丙基环丙烷(R=Me/H)与呋喃甲醛[3+2]环加成反应机理的密度泛函理论研究[J]. 有机化学, 2023, 43(2): 660-667. |
| [4] | 李硕, 王明亮, 周来运, 王兰芝. 磁性纳米负载对甲苯磺酸催化串联合成稠合多环的1,5-苯并氧氮杂䓬类化合物[J]. 有机化学, 2023, 43(11): 3977-3988. |
| [5] | 石云, 肖婷, 夏冬, 杨文超. 三氟甲硫基自由基引发不饱和烃的串联反应[J]. 有机化学, 2022, 42(9): 2715-2727. |
| [6] | 赵晓正, 凌琴琴, 曹桂妍, 火星, 赵小龙, 苏瀛鹏. 炔丙醇类化合物参与的环化反应研究进展[J]. 有机化学, 2022, 42(9): 2605-2639. |
| [7] | 周旭煜, 张爱君, 张庆庆, 刘庆安, 宣俊. 可见光诱导4-色满酮合成: 醋酸碘苯促进的α-酮酸与邻-烯丙氧基芳醛的自由基串联环化反应[J]. 有机化学, 2022, 42(8): 2488-2495. |
| [8] | 黄泽鑫, 尹宇强, 贾丰成, 吴安心. 吲哚及其衍生物C2—C3键断裂的反应研究进展[J]. 有机化学, 2022, 42(7): 2028-2044. |
| [9] | 侯金松, 杨高升. 三(邻二甲胺基苄基)钇催化脂肪胺对烯腈的插入串联反应[J]. 有机化学, 2022, 42(7): 2070-2078. |
| [10] | 袁飞, 赵艳, 郭青松, 尹福丹, 赖金荣, 念倍芳, 张明, 汤峨. 乙烯基硒盐参与的串联反应合成1-[1-(胺基)环丙基]酮化合物[J]. 有机化学, 2022, 42(6): 1759-1769. |
| [11] | 石宇冰, 白文己, 母伟花, 李江平, 于嘉玮, 连冰. 钯催化C—H键官能团化形成C—X (X=O, N, F, I, ……)键的密度泛函理论研究进展[J]. 有机化学, 2022, 42(5): 1346-1374. |
| [12] | 孙鑫, 屈超凡, 马超蕊, 赵筱薇, 柴国璧, 江智勇. 光氧化还原催化串联自由基加成反应构建1,4-二酮官能团化喹喔啉-2(1H)-酮衍生物[J]. 有机化学, 2022, 42(5): 1396-1406. |
| [13] | 肖立伟, 刘光仙, 任萍, 吴彤桐, 卢玉伟, 孔洁. 单质硫: 合成含硫杂环的优质硫源[J]. 有机化学, 2022, 42(4): 1002-1012. |
| [14] | 乔辉杰, 杨利婷, 陈雅, 王嘉琳, 孙武轩, 董昊博, 王云威. 温和条件下高效合成咪唑并杂环-肼类衍生物的三组分串联反应[J]. 有机化学, 2022, 42(4): 1188-1197. |
| [15] | 朱有财, 丁欣欣, 孙莉, 刘振. CO2/C2H4耦合制备丙烯酸及其衍生物的研究进展[J]. 有机化学, 2022, 42(4): 965-977. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||