有机化学 ›› 2024, Vol. 44 ›› Issue (2): 421-437.DOI: 10.6023/cjoc202308007 上一篇 下一篇
综述与进展
李路瑶a, 贺忠文a, 张振国a, 贾振华a,b,*( ), 罗德平a,b,*(
), 罗德平a,b,*( )
)
收稿日期:2023-08-09
修回日期:2023-10-08
发布日期:2023-10-30
基金资助:
Luyao Lia, Zhongwen Hea, Zhenguo Zhanga, Zhenhua Jiaa,b( ), Teck-Peng Loha,b(
), Teck-Peng Loha,b( )
)
Received:2023-08-09
Revised:2023-10-08
Published:2023-10-30
Contact:
E-mail: Supported by:文章分享

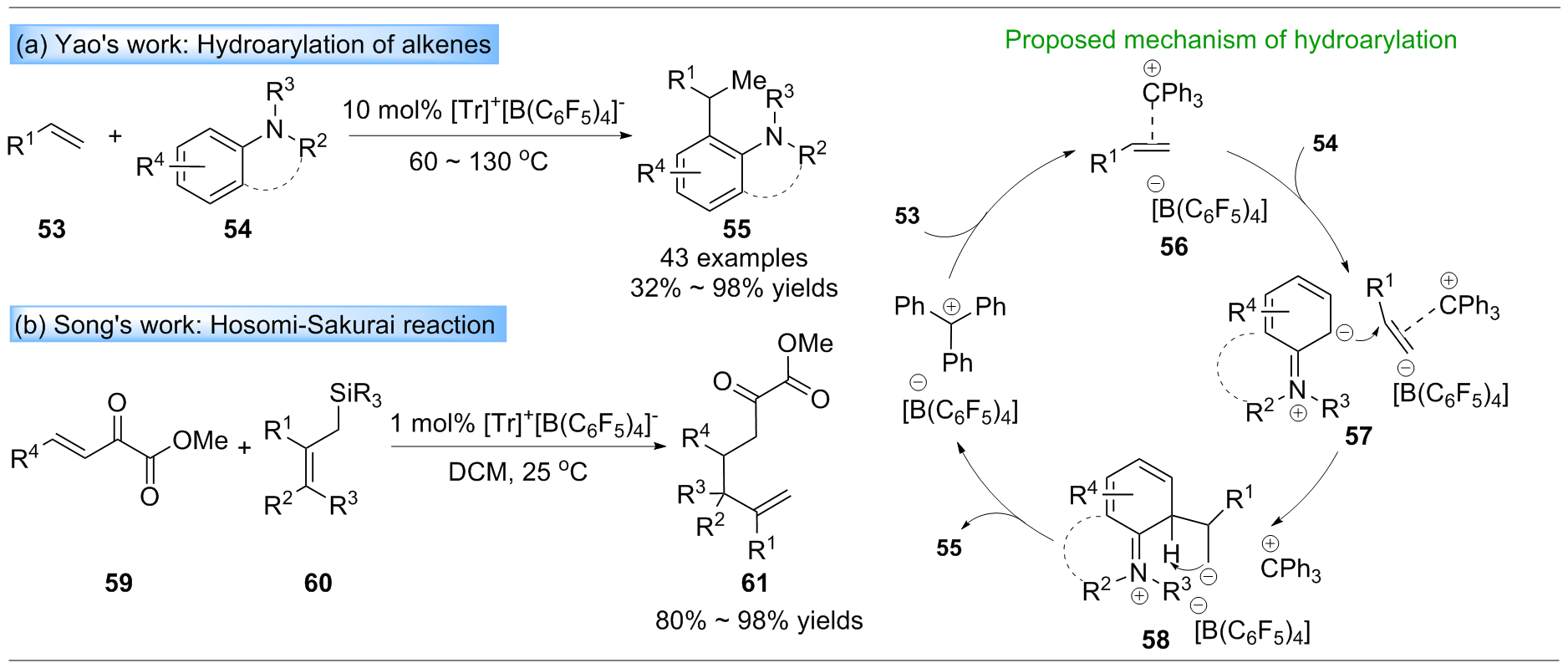
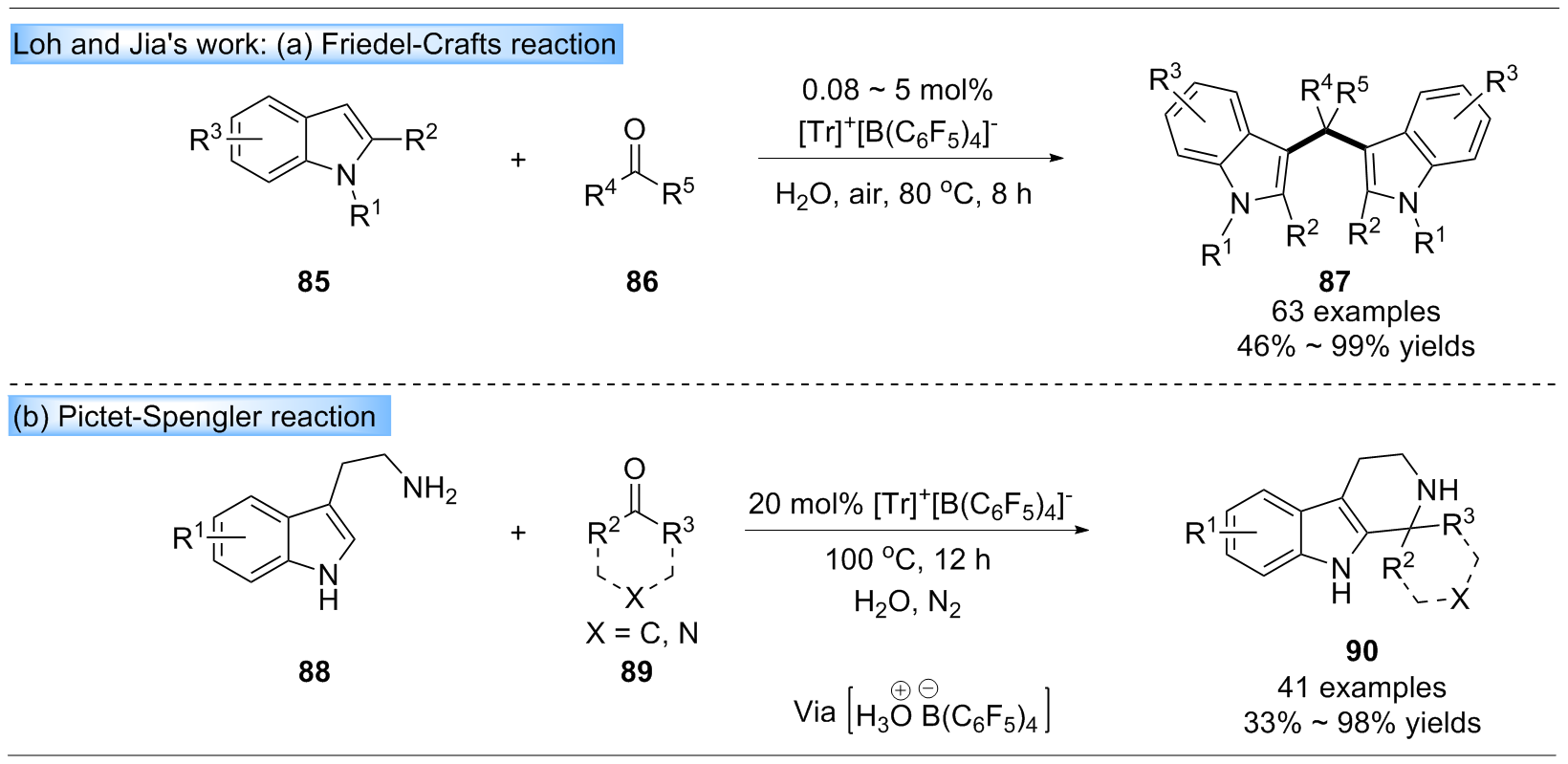
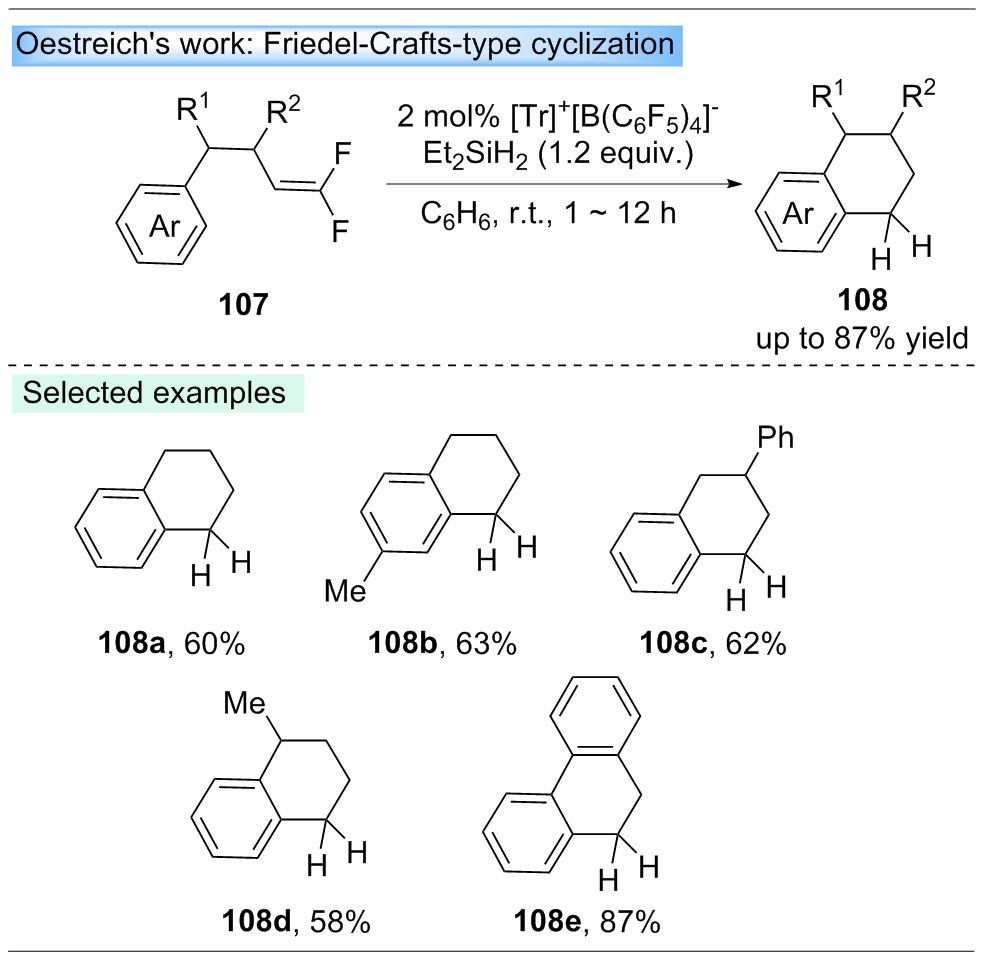
三芳基碳正离子作为一种优异的路易斯酸, 其最低空分子轨道(LUMO)轨道能级较低, 易接受一对电子, 被广泛应用于合成转化中, 是重要的试剂和催化剂. 近年来, 三芳基碳正离子在有机合成中主要被用作催化剂、预催化剂、共催化剂和添加剂. 此外, 三芳基碳正离子作为关键中间体, 可以成功应用于四芳基甲烷的合成. 综述了近年来三芳基碳正离子在有机合成中的应用进展, 并总结了三芳基碳正离子在有机合成中的多种功能作用, 希望引起广泛的关注.
李路瑶, 贺忠文, 张振国, 贾振华, 罗德平. 三芳基碳正离子在有机合成中的应用[J]. 有机化学, 2024, 44(2): 421-437.
Luyao Li, Zhongwen He, Zhenguo Zhang, Zhenhua Jia, Teck-Peng Loh. Application of Triaryl Carbenium in Organic Synthesis[J]. Chinese Journal of Organic Chemistry, 2024, 44(2): 421-437.








| [1] |
(a) Norris J. F. Am. Chem. J. 1901, 25, 117.
doi: 10.1021/ja02005a028 |
|
(b) Kehrmann, F.; Wentzel, F. Ber. Dtsch. Chem. Ges. 1901, 34, 3815.
doi: 10.1002/cber.v34:3 |
|
| [2] |
(a) Mukaiyama, T.; Kobayashi, S.; Shoda S.-I. Chem. Lett. 1984, 13, 907.
doi: 10.1246/cl.1984.907 |
|
(b) Mukaiyama, T.; Kobayashi, S.; Shoda, S.-I. Chem. Lett. 1984, 13, 1529.
doi: 10.1246/cl.1984.1529 |
|
|
(c) Mukaiyama, T.; Kobayashi, S.; Murakami, M. Chem. Lett. 1984, 13, 1759.
doi: 10.1246/cl.1984.1759 |
|
| [3] |
Cao, D.; Pan, P.; Li, C.-J.; Zeng, H. Green Synth. Catal. 2021, 2, 303.
|
| [4] |
Chen, P.; Tang, X.; Meng, X.; Tang, H.; Pan, Y.; Liang, Y. Green Synth. Catal. 2022, 3, 162.
|
| [5] |
Zhou, X.; Zhang, N.; Li, Y.; Mo, Z.; Ma, X.; Chen, Y.; Xu, Y. Green Synth. Catal. 2021, 2, 397.
|
| [6] |
Shi, L.; Li, T.; Mei, G. J. Green Synth. Catal. 2022, 3, 227.
|
| [7] |
Kang, M. S.; Xin Khoo, J. Y.; Jia, Z.; Loh, T.-P. Green Synth. Catal. 2022, 3, 309.
|
| [8] |
Lang, Y.; Han, X.; Peng, X.; Zheng, Z.; Li, C.; Zeng, H. Green Synth. Catal. 2022, 3, 373.
|
| [9] |
Lu, S.-N.; Zhang, J.; Li, J.; Chen, Z.; Wu, X. F. Green Synth. Catal. 2022, 3, 385.
|
| [10] |
Bah, J.; Franzén, J. Chem.-Eur. J. 2014, 20, 1066.
doi: 10.1002/chem.v20.4 |
| [11] |
Bah, J.; Naidu, V. R.; Teske, J.; Franzén, J. Adv. Synth. Catal. 2015, 357, 148.
doi: 10.1002/adsc.v357.1 |
| [12] |
Remaily, M. A. E. A. A. A. E.; Naidu, V. R.; Ni, S.; Franzén, J. Eur. J. Org. Chem. 2015, 47, 6610.
|
| [13] |
Naidu, V. R.; Bah, J.; Franzén, J. Eur. J. Org. Chem. 2015, 8, 1834.
|
| [14] |
Ni, S.; Remaily, M. A. E. A. A. A. E.; Franzén, J. Adv. Synth. Catal. 2018, 360, 4197.
doi: 10.1002/adsc.v360.21 |
| [15] |
Shang, W.; Duan, D.; Liu, Y.; Lv, J. Org. Lett. 2019, 21, 8013.
doi: 10.1021/acs.orglett.9b03005 |
| [16] |
Song, R.; Zhuo, C.; Si, W.; Wu, X.; Guan, T.; Yang, D.; Lv, J. Adv. Synth. Catal. 2022, 364, 4069.
doi: 10.1002/adsc.v364.23 |
| [17] |
Liu, R.; Wei, Y.; Shi, M. Chin. J. Chem. 2020, 38, 947.
doi: 10.1002/cjoc.v38.9 |
| [18] |
Nagamalla, S.; Mague J. T. Sathyamoorthi S. Org. Lett. 2022, 24, 939.
doi: 10.1021/acs.orglett.1c04310 |
| [19] |
Nagamalla, S.; Paul, D.; Mague, J. T.; Sathyamoorthi, S. Org. Lett. 2022, 24, 6202.
doi: 10.1021/acs.orglett.2c02496 |
| [20] |
Xu, Y.; Wang, L.; Chen, C.; Huang, P.; Dai, H.; Jiang, W.; Zhou, Y. Macromolecule. 2023, 56, 501.
doi: 10.1021/acs.macromol.2c02056 |
| [21] |
Nomoto, Y.; Horinouchi, R.; Nishiyama, N.; Nakano, K.; Ichikawa, Y.; Kotsuki, H. Synlet. 2017, 28, 265.
doi: 10.1055/s-0036-1588618 |
| [22] |
Zhang, Q.; Lv, J.; Li, S.; Luo, S. Org. Lett. 2018, 20, 2269.
doi: 10.1021/acs.orglett.8b00619 |
| [23] |
Jin, H.; Rudolph, M.; Rominger, F.; Hashmi, A. S. K. ACS Catal. 2019, 9, 11663.
doi: 10.1021/acscatal.9b03911 |
| [24] |
Zhu, W.; Sun, Q.; Wang, Y.; Yuan, D.; Yao, Y. Org. Lett. 2018, 20, 3101.
doi: 10.1021/acs.orglett.8b01158 |
| [25] |
Gan, Z.; Cui, D.; Zhang, H.; Feng, Y.; Huang, L.; Gui, Y.; Gao, L.; Song, Z. Molecule. 2022, 27, 4730.
doi: 10.3390/molecules27154730 |
| [26] |
(a) Riant, O.; Samuel, O.; Kagan, H. B. J. Am. Chem. Soc. 1993, 115, 5835.
doi: 10.1021/ja00066a066 pmid: 11178824 |
|
(b) Taudien, S.; Riant, O.; Kagan, H. Tetrahedron Lett. 1995, 36, 3513.
doi: 10.1016/0040-4039(95)00531-G pmid: 11178824 |
|
|
(c) Sammakia, T.; Latham, H. A. Tetrahedron Lett. 1995, 36, 6867.
doi: 10.1016/00404-0399(50)1440S- pmid: 11178824 |
|
|
(d) Chen, C.-T.; Chao, S.-D.; Yen, K.-C.; Chen, C.-H.; Chou, I.-C.; Hon, S.-W. J. Am. Chem. Soc. 1997, 119, 11341.
doi: 10.1021/ja970900o pmid: 11178824 |
|
|
(e) Magdziak, D.; Pettus, L. H.; Pettus, T. R. R. Org. Lett. 2001, 3, 557.
pmid: 11178824 |
|
|
(f) Bjurling, E.; Berg, U.; Andersson, C.-M. Organometallic. 2002, 21, 1583.
doi: 10.1021/om011016g pmid: 11178824 |
|
| [27] |
Lv, J.; Zhang, Q.; Zhong, X.; Luo, S. J. Am. Chem. Soc. 2015, 137, 15576.
doi: 10.1021/jacs.5b11085 |
| [28] |
Zhang, Q.; Lv, J.; Luo, S. Beilstein J. Org. Chem. 2019, 15, 1304.
doi: 10.3762/bjoc.15.129 |
| [29] |
Cai, X.; Keshavarz, A.; Omaque, J. D.; Stokes, B. J. Org. Lett. 2017, 19, 2626.
doi: 10.1021/acs.orglett.7b00958 |
| [30] |
Popov, S.; Shao, B.; Bagdasarian, A. L.; Benton, T. R.; Zou, L.; Yang, Z.; Houk, K. N.; Nelson, H. M. Scienc. 2018, 361, 381.
|
| [31] |
Wigman, B.; Popov, S.; Bagdasarian, A. L.; Shao, B.; Benton T. R. Williams, C. G.; Fisher, S. P.; Lavallo, V.; Houk, K. N.; Nelson, H. M. J. Am. Chem. Soc. 2019, 141, 9140.
doi: 10.1021/jacs.9b02110 |
| [32] |
Zhang, Z.; Ji, L.; Liu, X.; Li, Z.; Lv, Y.; Jia, Z.; Loh, T.-P. Org. Chem. Front. 2022, 9, 5154.
doi: 10.1039/D2QO01081J |
| [33] |
Zhang, Z.; Liu, X.; Ji, L.; Zhang, T.; Jia, Z.; Loh, T.-P. ACS Catal. 2022, 12, 2052.
doi: 10.1021/acscatal.1c05546 |
| [34] |
Zhang, Z.; Gu, J.; Lv, Y.; Ji, L.; Liu, X.; Wu, B.; Liu, F.; Jia, Z.; Loh, T.-P. Cell Rep. Phys. Sci. 2023, 4, 101246.
|
| [35] |
(a) Shi, X.; Nishiura, M.; Hou, Z. Angew. Chem.. Int. Ed. 2016, 55, 14812.
doi: 10.1002/anie.v55.47 |
|
(b) Wang, H.; Zhao, Y.; Nishiura, M.; Yang, Y.; Luo, G.; Luo, Y.; Hou, Z. J. Am. Chem. Soc. 2019, 141, 12624.
doi: 10.1021/jacs.9b04275 |
|
|
(c) Wang, H.; W, X.; Yang, Y.; Nishiura, M.; Hou, Z. Angew. Chem.. Int. Ed. 2020, 59, 7173.
doi: 10.1002/anie.v59.18 |
|
|
(d) Guo, F.; Jiang, L.; Diao, K.; Hou, Z. Polym. Chem. 2020, 11, 1314.
doi: 10.1039/C9PY01789E |
|
| [36] |
Song, G.; Luo, G.; Oyamada, J.; Luo, Y.; Hou, Z. Chem. Sci. 2016, 7, 5265.
doi: 10.1039/C6SC00833J |
| [37] |
Luo, Y.; Teng, H.-L.; Nishiura, M.; Hou, Z. Angew. Chem.. Int. Ed. 2017, 56, 9207.
doi: 10.1002/anie.v56.31 |
| [38] |
Arii, H.; Nakabayashi, K.; Mochida, K.; Kawashima, T. Molecule. 2016, 21, 999.
doi: 10.3390/molecules21080999 |
| [39] |
Forster, F.; Rendón López, V. M.; Oestreich, M. Organometallic. 2018, 37, 2656.
doi: 10.1021/acs.organomet.8b00409 |
| [40] |
He, T.; Wang, G.; Bonetti, V.; Klare, H. F. T.; Oestreich, M. Angew. Chem.. Int. Ed. 2020, 59, 12186.
doi: 10.1002/anie.v59.29 |
| [41] |
He, T.; Wang, G.; Long, P.-W.; Kemper, S.; Irran, E.; Klare, H. F. T.; Oestreich, M. Chem. Sci. 2021, 12, 569.
doi: 10.1039/D0SC05553K |
| [42] |
Roy, A.; Gao, H.; Klare, H. F. T.; Oestreich, M. Synthesi. 2023, 55, 1602.
doi: 10.1055/a-2009-8114 |
| [43] |
Laye, C.; Lusseau, J.; Robert, F.; Landais, Y. Adv. Synth. Catal. 2021, 363, 3035.
doi: 10.1002/adsc.v363.12 |
| [44] |
Israr, M.; Bae, H. Y. Green Chem. 2023, 25, 2387.
doi: 10.1039/D3GC00189J |
| [45] |
Courant, T.; Lombard, M.; Boyarskaya, D. V.; Neuville, L.; Masson, G. Org. Biomol. Chem. 2020, 18, 6502.
doi: 10.1039/D0OB01502D |
| [46] |
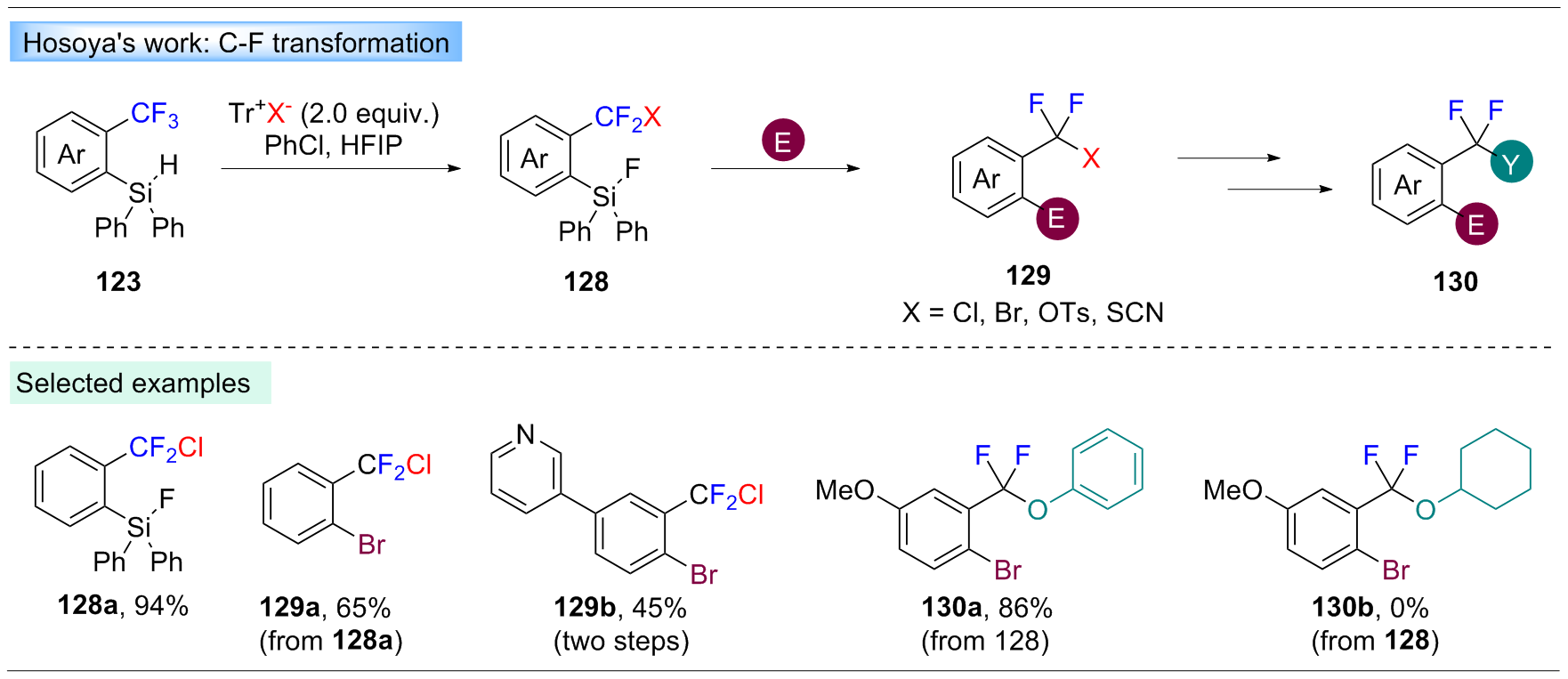
Yoshida, S.; Shimomori, K.; Kim, Y.; Hosoya, T. Angew. Chem.. Int. Ed. 2016, 55, 10406.
doi: 10.1002/anie.v55.35 |
| [47] |
Idogawa, R.; Kim, Y.; Shimomori, K.; Hosoya, T.; Yoshida, S. Org. Lett. 2020, 22, 9292.
doi: 10.1021/acs.orglett.0c03529 pmid: 33180503 |
| [48] |
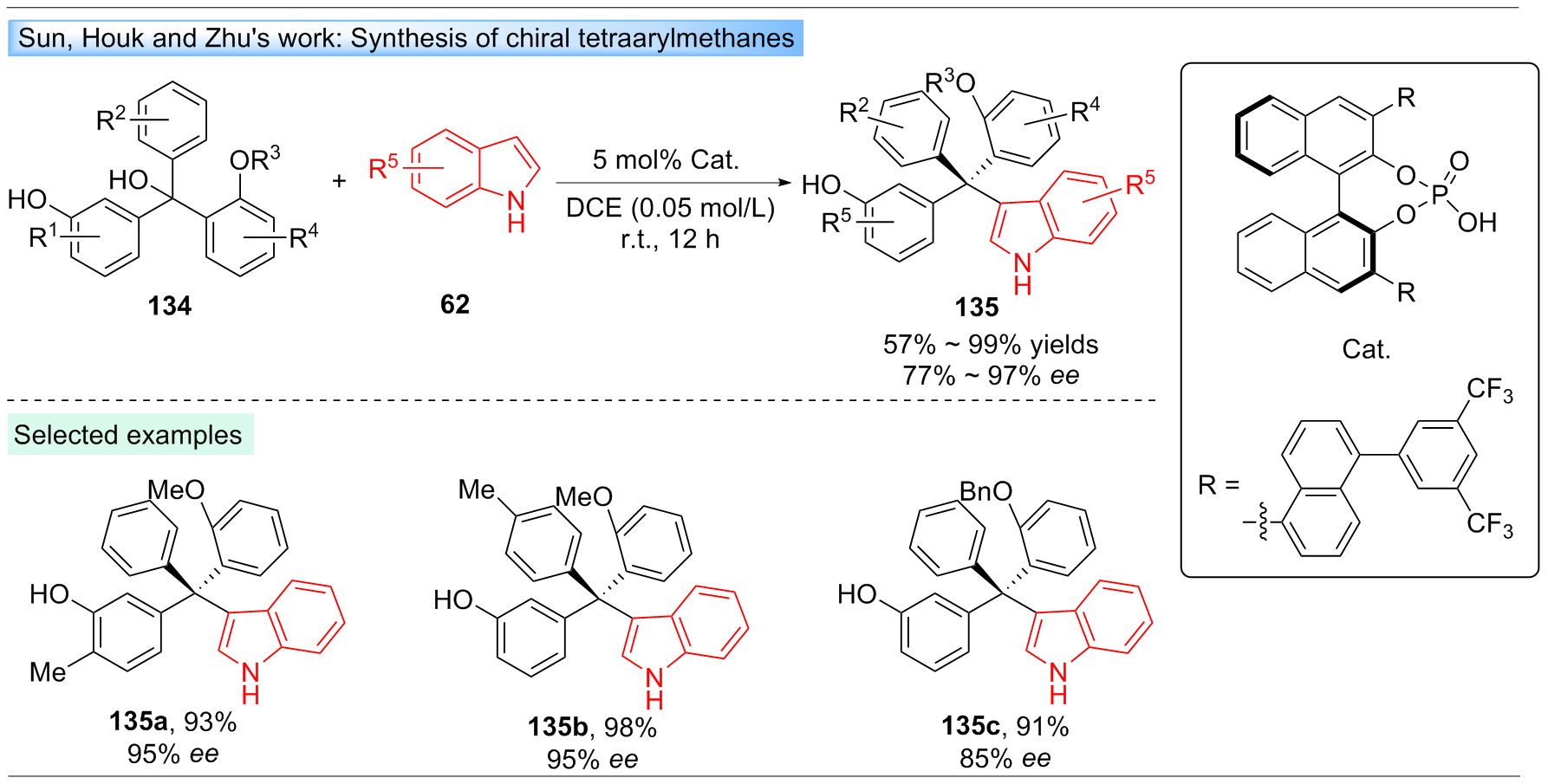
Li, X.; Duan, M.; Deng, Z.; Shao, Q.; Chen, M.; Zhu, G.; Houk, K. N.; Sun, J. Nat. Catal. 2020, 3, 1010.
doi: 10.1038/s41929-020-00535-4 |
| [49] |
Tan, X.; Deng, Z.; Wang, Q.; Chen, S.; Zhu, G.; Sun, J. Nat. Synth. 2023, 2, 275.
|
| [50] |
Liu, M.; Shen, B.; Liu, C.; Yu, P.; Li, P. J. Am. Chem. Soc. 2023, 145, 14562.
doi: 10.1021/jacs.3c05107 |
| [1] | 董江湖, 宣良明, 王池, 赵晨熙, 王海峰, 严琼姣, 汪伟, 陈芬儿. 无过渡金属或无光催化剂条件下可见光促进喹喔啉酮C(3)—H官能团化研究进展[J]. 有机化学, 2024, 44(1): 111-136. |
| [2] | 赵茜帆, 陈永正, 张世明. 碳基非金属催化剂在有机合成领域的应用及机理研究[J]. 有机化学, 2024, 44(1): 137-147. |
| [3] | 周然, 袁春梅, 张桃, 毛飘, 刘燚, 孟开妮, 幸惠, 薛伟. 含喹唑啉酮的查尔酮衍生物的设计、合成及生物活性研究[J]. 有机化学, 2023, 43(9): 3196-3209. |
| [4] | 张晓雨, 李欣燕, 崔冰, 邵志晖, 赵铭钦. 四氢-β-咔啉衍生物的设计、合成及抗氧化性能研究[J]. 有机化学, 2023, 43(8): 2885-2894. |
| [5] | 卢凯, 屈浩琦, 陈樨, 秋慧, 郑晶, 马猛涛. 无催化剂、无溶剂条件下炔烃和烯烃与儿茶酚硼烷的硼氢化反应[J]. 有机化学, 2023, 43(6): 2197-2205. |
| [6] | 徐光利, 许静, 徐海东, 崔香, 舒兴中. 过渡金属催化烯烃和炔烃合成1,3-共轭二烯化合物研究进展[J]. 有机化学, 2023, 43(6): 1899-1933. |
| [7] | 窦谦, 汪太民, 房丽晶, 翟宏斌, 程斌. 光诱导铁催化在有机合成中的应用研究进展[J]. 有机化学, 2023, 43(4): 1386-1415. |
| [8] | 白林盛, 洪鹏, 应安国. 功能化聚丙烯腈纤维促进有机反应的研究进展[J]. 有机化学, 2023, 43(4): 1241-1270. |
| [9] | 莫百川, 陈春霞, 彭进松. 木质素及其衍生物负载金属催化剂在有机合成中的应用研究进展[J]. 有机化学, 2023, 43(4): 1215-1240. |
| [10] | 纪健, 刘进华, 管丛, 陈绪文, 赵芸, 刘顺英. 原位生成的磺酸催化N-磺酰基-1,2,3-三氮唑与醇偶联高区域选择性合成N2-取代1,2,3-三氮唑[J]. 有机化学, 2023, 43(3): 1168-1176. |
| [11] | 马彪, 章淼淼, 李占宇, 彭进松, 陈春霞. 无过渡金属催化的Suzuki-Type交叉偶联反应研究进展[J]. 有机化学, 2023, 43(2): 455-470. |
| [12] | 吴利城, 伍贤青, 曲景平, 陈宜峰. Quinim配体的探索及其在镍催化烯烃的不对称胺甲酰基-烷基化反应的应用[J]. 有机化学, 2023, 43(12): 4239-4250. |
| [13] | 陈祥, 欧阳文韬, 李潇, 何卫民. 可见光诱导有机光催化合成二氟乙基苯并噁嗪[J]. 有机化学, 2023, 43(12): 4213-4219. |
| [14] | 肖朵朵, 张建涛, 周鹏, 刘卫兵. 无金属条件下芳基酮与二甲亚砜的α-C(sp3)—H亚甲基化反应合成γ-酮亚砜[J]. 有机化学, 2023, 43(11): 3900-3906. |
| [15] | 刘甜甜, 段新红. 不对称傅-克反应在构建手性3-取代吲哚中的研究进展[J]. 有机化学, 2023, 43(11): 3695-3712. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||