有机化学 ›› 2022, Vol. 42 ›› Issue (3): 770-784.DOI: 10.6023/cjoc202107001 上一篇 下一篇
综述与进展
孔媛芳a, 杨彬a, 庄严a, 张京玉a, 孙德梅a,*( ), 董春红b,*(
), 董春红b,*( )
)
收稿日期:2021-07-01
修回日期:2021-09-30
发布日期:2021-11-09
通讯作者:
孙德梅, 董春红
基金资助:
Yuanfang Konga, Bin Yanga, Yan Zhuanga, Jingyu Zhanga, Demei Suna( ), Chunhong Dongb(
), Chunhong Dongb( )
)
Received:2021-07-01
Revised:2021-09-30
Published:2021-11-09
Contact:
Demei Sun, Chunhong Dong
Supported by:文章分享

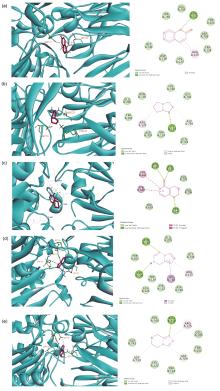
糖尿病是我国慢性疾病中威胁人类健康的主要疾病, 治疗糖尿病的药物作用靶点主要有二肽基肽酶4 (DPP-4)、单磷酸腺苷活化蛋白激酶(AMPK)、过氧化物酶体增殖物激活受体γ (PPARγ)受体等, 其中以DPP-4为靶点的靶向药物研究是近几年的热点. DPP-4抑制剂是治疗2型糖尿病的药物, 其最大的优点是不易诱发低血糖和增加体重. 据报道, 目前已上市的DPP-4靶向药物可引起胰腺炎和超敏等不良反应, 因此继续开发新型DPP-4抑制剂的降糖药物, 以避免不良反应发生值得进一步深入研究. 在系统的文献调研基础上, 总结出具有潜在的降糖活性杂环结构, 并通过计算机分子模拟对接, 针对DPP-4靶点, 最终筛选出5种易合成且降糖活性较高的杂环结构, 并对其合成路线及构效关系进行归纳总结分析, 为今后开发安全高效、结构新颖的DPP-4抑制剂的降糖药物提供研究基础.
孔媛芳, 杨彬, 庄严, 张京玉, 孙德梅, 董春红. 基于二肽基肽酶4 (DPP-4)靶点设计的五种降糖活性杂环合成及构效关系研究进展[J]. 有机化学, 2022, 42(3): 770-784.
Yuanfang Kong, Bin Yang, Yan Zhuang, Jingyu Zhang, Demei Sun, Chunhong Dong. Research Progress on the Synthesis and Structure-Activity Relationship of Five Hypoglycemic Active Heterocycles Based on Dipeptidyl Peptidase 4 (DPP-4) Target Design[J]. Chinese Journal of Organic Chemistry, 2022, 42(3): 770-784.
| Compd. | IC50/(mg•L–1) | |
|---|---|---|
| α-Glucosidase inhibitory activity | AGEs forming free radical activity | |
| 1a | >1000 | 5.247±0.519 |
| 1b | >1000 | 6.567±0.456 |
| 1c | >1000 | 3.239±0.713 |
| 1d | >1000 | 2.346±0.188 |
| 2a | >1000 | 4.223±0.268 |
| 2b | 0.469±0.042 | 2.453±0.069 |
| 2c | 0.250±0.042 | 1.132±0.141 |
| 2d | 1.020±0.062 | 0.623±0.016 |
| Acarbose | 0.042±0.002 | — |
| Aminoguanidine Hydrochloride | — | 28.255±0.657 |
| Compd. | IC50/(mg•L–1) | |
|---|---|---|
| α-Glucosidase inhibitory activity | AGEs forming free radical activity | |
| 1a | >1000 | 5.247±0.519 |
| 1b | >1000 | 6.567±0.456 |
| 1c | >1000 | 3.239±0.713 |
| 1d | >1000 | 2.346±0.188 |
| 2a | >1000 | 4.223±0.268 |
| 2b | 0.469±0.042 | 2.453±0.069 |
| 2c | 0.250±0.042 | 1.132±0.141 |
| 2d | 1.020±0.062 | 0.623±0.016 |
| Acarbose | 0.042±0.002 | — |
| Aminoguanidine Hydrochloride | — | 28.255±0.657 |
| Compd. | R1 | R2 | n | Decrease in blood glucose/% | |
|---|---|---|---|---|---|
| 18 h | 21 h | ||||
| 4a | Me | H | 0 | -7.0±4.8 | 3.6±0.7 |
| 4b | Me | H | 1 | 24.7±9.1 | 27.6±5.9 |
| 4c | Me | H | 2 | -5.6±6.2 | 13.0±9.3 |
| 4d | Me | H | 3 | -3.0±6.1 | -9.3±18.3 |
| 4e | H | H | 1 | 13.9±12.7 | 7.4±3.0 |
| 4f | Et | H | 1 | -19.5±8.7 | 2.4±8.3 |
| 4g | Ph | H | 1 | 3.9±5.6 | -3.4±22.4 |
| 4h | 4-ClC6H4CH2 | H | 1 | 24.5±8.2 | -8.5±19.0 |
| 4i | 4-PhC6H4CH2 | H | 1 | 3.8±13.4 | 11.4±6.0 |
| 4j | Me | Cl | 1 | 37.1±7.7 | 47.6±6.9 |
| Compd. | R1 | R2 | n | Decrease in blood glucose/% | |
|---|---|---|---|---|---|
| 18 h | 21 h | ||||
| 4a | Me | H | 0 | -7.0±4.8 | 3.6±0.7 |
| 4b | Me | H | 1 | 24.7±9.1 | 27.6±5.9 |
| 4c | Me | H | 2 | -5.6±6.2 | 13.0±9.3 |
| 4d | Me | H | 3 | -3.0±6.1 | -9.3±18.3 |
| 4e | H | H | 1 | 13.9±12.7 | 7.4±3.0 |
| 4f | Et | H | 1 | -19.5±8.7 | 2.4±8.3 |
| 4g | Ph | H | 1 | 3.9±5.6 | -3.4±22.4 |
| 4h | 4-ClC6H4CH2 | H | 1 | 24.5±8.2 | -8.5±19.0 |
| 4i | 4-PhC6H4CH2 | H | 1 | 3.8±13.4 | 11.4±6.0 |
| 4j | Me | Cl | 1 | 37.1±7.7 | 47.6±6.9 |
| Entry | FPG/(mol•L–1) | 2 h PBG/(mol•L–1) | |||
|---|---|---|---|---|---|
| Before treatment | Post treatment | | Before treatment | Post treatment | |
| 1 | 7.43±0.70 | 5.30±0.39 | 11.33±1.24 | 6.80±0.53 | |
| t | 0.569 | 12.010 | 0.105 | 8.000 | |
| P | 0.285 | 0.000 | 0.458 | 0.000 | |
| Entry | FPG/(mol•L–1) | 2 h PBG/(mol•L–1) | |||
|---|---|---|---|---|---|
| Before treatment | Post treatment | | Before treatment | Post treatment | |
| 1 | 7.43±0.70 | 5.30±0.39 | 11.33±1.24 | 6.80±0.53 | |
| t | 0.569 | 12.010 | 0.105 | 8.000 | |
| P | 0.285 | 0.000 | 0.458 | 0.000 | |
| Entry | Compound | Binding energy/(kJ•mol–1) |
|---|---|---|
| 1 | a | –25.62 |
| 2 | g | –22.68 |
| 3 | j | –22.68 |
| 4 | b | –21.84 |
| 5 | i | –21.42 |
| 6 | e | –21 |
| 7 | l | –20.58 |
| 8 | h | –20.16 |
| 9 | d | –19.32 |
| 10 | c | –17.64 |
| 11 | k | –17.64 |
| 12 | f | –13.86 |
| Entry | Compound | Binding energy/(kJ•mol–1) |
|---|---|---|
| 1 | a | –25.62 |
| 2 | g | –22.68 |
| 3 | j | –22.68 |
| 4 | b | –21.84 |
| 5 | i | –21.42 |
| 6 | e | –21 |
| 7 | l | –20.58 |
| 8 | h | –20.16 |
| 9 | d | –19.32 |
| 10 | c | –17.64 |
| 11 | k | –17.64 |
| 12 | f | –13.86 |

| [1] |
Chakraborty, R.; Ahmed, A. B.; Saha, D. Int. J. Curr. Pharm. Res. 2019, 4, 60.
|
| [2] |
Wang, L. M.; Gao, P.; Zhang, M.; Huang, Z. J.; Zhang, D. D.; Deng, Q.; Li, Y. C.; Zhao, Z. P.; Qin, X. Y.; Jin, D. Y.; Zhou, M. G.; Tang, X.; Hu, Y. H.; Wang, L. H. J. Am. Med. Assoc. 2017, 317, 2515.
doi: 10.1001/jama.2017.7596 |
| [3] |
Zimmet, P.; Shaw, J.; Alberti, K. G. M. M. Diabetic Med. 2003, 20, 693.
pmid: 12925046 |
| [4] |
Shen, W. Chin. J. Misdiagn 2011, 11, 8845. (in Chinese)
|
|
(谌卫, 中国误诊学杂志, 2011, 11, 8845.)
|
|
| [5] |
(a) Liakos, C. I.; Papadopoulos, D. P.; Sanidas, E. A.; Markou, M. I.; Hatziagelaki, E. E.; Grassos, C. A.; Velliou, M. L.; Barbetseas, J. D. Am. J. Cardiovasc. Drugs 2020, 21, 262.
|
|
(b) Sun, Z. G.; Li, Z. N.; Zhu, H. L. Mini-Rev. Med. Chem. 2020, 20, 1709.
doi: 10.2174/1389557520666200628032507 |
|
| [6] |
Xiong, L. J.; Jin, Y.; Fang, Y. Y. J. Shenyang Pharm. Univ. 2020, 37, 181. (in Chinese)
|
|
(熊丽娟, 金一, 房元英, 沈阳药科大学学报, 2020, 37, 181.)
|
|
| [7] |
Deacon, C. F. Diabetes 2004, 53, 2181.
doi: 10.2337/diabetes.53.9.2181 |
| [8] |
Tang, Y. Z.; Tian, L. L.; Ni, C. L. Med. Recapitulate 2018, 24, 770. (in Chinese)
|
|
(汤云昭, 田琳琳, 倪长霖, 医学综述, 2018, 24, 770.)
|
|
| [9] |
Dong, P. J. Qiqihar Med. Univ. 2019, 40, 218.
|
| [10] |
Havale, S. H.; Pal, M. Bioorg. Med. Chem. 2009, 17, 1783.
doi: 10.1016/j.bmc.2009.01.061 |
| [11] |
Rosenstock, J.; Perkovic, V.; Johansen, O. E.; Mark, E. Cooper, M. E.; Kahn, S. E.; Marx, N.; Alexander, J. H.; Pencina, M.; Toto, R. D.; Wanner, C.; Zinman, B.; Woerle, H. J.; Baanstra, D.; Pfarr, E.; Schnaidt, S.; Meinicke, T.; George, J. T.; Eynatten, M. V.; McGuire, D. K. J. Am. Med. Assoc. 2018. 321, 69.
doi: 10.1001/jama.2018.18269 |
| [12] |
Hu, Y. H.; Sun, J.; Yang, J.; Wang, X. J. Chem. Res. 2018, 29, 357. (in Chinese)
|
|
(胡玉恒, 孙捷, 杨洁, 王晓静, 化学研究, 2018, 29, 357.)
|
|
| [13] |
Thomas, D. A.; Bork, B.; Philip, A. B.; Leonard, J. B.; Cheon, S. H.; Rhonda, O. D.; Jay, B. F.; William, S. F.; James, D. F.; Jiaping, G.; Douglas, C. K.; Gerald, G. K.; Christina, L. L.; Jeffrey, N.; Ronald, S.; Howard, C. S. J. Med. Chem. 1998, 41, 4.
|
| [14] |
Aicher, T. D; Balkan, B.; Bell, P. A.; Brand, L. J.; Cheon, S. H.; Deems, R. O.; Fell, J. B.; Fillers, W. S.; Fraser, J. D; Gao, J.; Knorr, D. C.; Kahle, G. G.; Leone, C. L.; Nadelson, J.; Simpson, R.; Smith, H. C. J. Med. Chem. 1998, 41, 4556.
pmid: 9804695 |
| [15] |
Blank, B.; DiTullio, N. W.; Krog, A. J.; Saunders, H. L. J. Med. Chem. 1978, 21, 489.
pmid: 660598 |
| [16] |
Meltzer-Mats, E.; Babai-Shani, G.; Pasternak, L.; Uritsky, N.; Getter, T.; Viskind, O.; Eckel, J.; Cerasi, E.; Senderowitz, H.; Sasson, S.; Gruzman, A. J. Med. Chem. 2013, 56, 5335.
doi: 10.1021/jm4001488 pmid: 23750537 |
| [17] |
Oguchi, M.; Wada, K.; Honma, H.; Tanaka, A.; Kaneko, T.; Sakakibara, S.; Ohsumi, J.; Serizawa, N.; Fujiwara, T.; Horikoshi, H.; Fujita, T. J. Med. Chem. 2000, 43, 3052.
pmid: 10956213 |
| [18] |
Qiao, Y. B.; Xu, Q. Q.; Feng, W. Y.; Tao, L.; Li, X. N.; Liu, J. J.; Zhu, H. C.; Lu, Y. Y.; Wang, J. P.; Qi, C. X.; Xue, Y. B.; Zhang, Y. H. J. Nat. Prod. 2019, 82, 2925.
doi: 10.1021/acs.jnatprod.9b00188 |
| [19] |
Blank, B.; DiTullio, N. W.; Deviney, L.; Roberts, J. T.; Magnani, A.; Billig, M.; Saunders, H. L. J. Med. Chem. 1977, 20, 1572.
pmid: 592321 |
| [20] |
Blank, B.; DiTullio, N. W.; Krog, A. J.; Saunders, H. L. J. Med. Chem. 1979, 22, 840.
pmid: 448683 |
| [21] |
Li, C. J.; Le, Z. P.; Zhao, C. S. Chin. J. New Drugs 2014, 23, 2195. (in Chinese)
|
|
(李翠娟, 乐治平, 赵传生, 中国新药杂志, 2014, 23, 2195.)
|
|
| [22] |
Li, Z. Y.; Wang, J. T.; Gu, Y. Q.; Tang, L. Chem. Reagents 2013, 35, 114. (in Chinese)
|
|
(李志燕, 王建塔, 古元琴, 汤磊, 化学试剂, 2013, 35, 114.)
|
|
| [23] |
Zhang, C. L. Heilongjiang Med. J. 2019, 32, 1095. (in Chinese)
|
|
(张春玲, 黑龙江医药, 2019, 32, 1095.)
|
|
| [24] |
Veselinovic, J. B.; Veselinovic, A. M.; Vitnik, Z. J.; Vitnik, V. D.; Nikolic, G. M. Chem. Biol. 2014, 214, 49.
|
| [25] |
Arora, R. K.; Kaur, N.; Bansal, Y.; Bansal, G. Acta Pharm. Sin. B 2014, 4, 368.
doi: 10.1016/j.apsb.2014.07.001 |
| [26] |
Mahajan, D. H.; Pannecouque, C.; De, C. E.; Chikhalia, K. H. Arch. Pharm. (Weinheim, Ger.) 2009, 342, 281.
doi: 10.1002/ardp.v342:5 |
| [27] |
Sabry, N. M.; Mohamed, H. M.; Khattab, E. S.; Motlaq, S. S.; El- Agrody, A. M. Eur. J. Med. Chem. 2011, 46, 765.
doi: 10.1016/j.ejmech.2010.12.015 |
| [28] |
Miri, R.; Nejati, M.; Saso, L.; Khakdan, F.; Parshad, B.; Mathur, D.; Parmar, V. S.; Bracke, M. E.; Prasad, A. K.; Sharma, S. K.; Firuzi, O. Pharm. Biol. 2016, 54, 105.
doi: 10.3109/13880209.2015.1016183 |
| [29] |
Manvar, A.; Malde, A.; Verma, J.; Virsodia, V.; Mishra, A.; Upadhyay, K.; Acharya, H.; Coutinho, E.; Shah, A. Eur. J. Med. Chem. 2008, 43, 2395.
doi: 10.1016/j.ejmech.2008.01.016 pmid: 18328603 |
| [30] |
Yang, L. S.; Wang, Y.; Wang, E. H.; Yang, J.; Pan, X.; Liao, X.; Yang, X. S. Synth. Commun. 2020, 50, 3080.
doi: 10.1080/00397911.2020.1792498 |
| [31] |
Shakil, M.; Meguerdichian, A. G.; Tasnim, H.; Shirazi, A. A.; Seraji, M. S.; Suib, S. L. Inorg. Chem. 2019, 58, 5703.
doi: 10.1021/acs.inorgchem.9b00053 pmid: 30964675 |
| [32] |
Song, D.; Wang, C. M.; Ye, Z. P.; Xia, P. J.; Deng, Z. X.; Xiao, J. A.; Xiang, H. Y.; Yang, H. J. Org. Chem. 2019, 84, 7480.
doi: 10.1021/acs.joc.9b00715 pmid: 31062593 |
| [33] |
Vashishtha, M.; Mishra, M.; Shah, D. O. Green Chem. 2016, 18, 1339.
doi: 10.1039/C5GC01966D |
| [34] |
Konrádová, D.; Kozubíková, H.; Doležal, K.; Pospíšil, J. Eur. J. Org. Chem. 2017, 2017, 5204.
doi: 10.1002/ejoc.201701021 |
| [35] |
Guerrero-Analco, J.; Medina-Campos, O.; Brindis, F.; Bye, R.; Pedraza-Chaverri, J.; Navarrete, A.; Mata, R. Phytochemistry 2007, 68, 2087.
pmid: 17575991 |
| [36] |
Soares, J.; Espadinha, M.; Raimundo, L.; Ramos, H.; Gomes, A. S.; Gomes, S.; Loureiro, J. B.; Inga, A.; Reis, F.; Gomes, C.; Santos, M. M. M.; Saraiva, L. Mol. Oncol. 2017, 11, 612.
doi: 10.1002/1878-0261.12051 pmid: 28296148 |
| [37] |
Bao, B.; Bai, S.; Fan, J.; Su, J.; Wang, W.; Yu, D. Dyes Pigm. 2019, 171, 107778.
doi: 10.1016/j.dyepig.2019.107778 |
| [38] |
Chen, W. L.; Wang, L. Y.; Li, Y. J. Eur. J. Org. Chem. 2020, 1, 103.
|
| [39] |
Vasylyev, M.; Alper, H. Angew. Chem., Int. Ed. 2009, 48, 1287.
doi: 10.1002/anie.200802550 |
| [40] |
Elmore, S. W.; Coghlan, M. J.; Anderson, D. D.; Pratt, J. K.; Green, B. E.; Wang, A. X.; Stashko, M. A.; Lin, C. W.; Tyree, C. M.; Miner, J. N.; Jacobson, P. B.; Wilcox, D. M.; Lane, B. C. J. Med. Chem. 2001, 44, 4481.
pmid: 11728194 |
| [41] |
Wu, C. S.; Lin, Z. M.; Wang, L. N.; Guo, D. X.; Wang, S. Q.; Liu, Y. Q.; Yuan, H. Q.; Lou, H. X. Bioorg. Med. Chem. Lett. 2011, 21, 3261.
doi: 10.1016/j.bmcl.2011.04.025 |
| [42] |
Zan, L. F.; Qin, J. C.; Zhang, Y. M.; Yao, Y. H.; Bao, H. Y.; Li, X. Chem. Pharm. Bull. (Tokyo) 2011, 59, 770.
doi: 10.1248/cpb.59.770 |
| [43] |
Gurubrahamam, R.; Gao, B. F.; Chen, Y. M.; Chan, Y. T.; Tsai, M. K.; Chen, K. Org. Lett. 2016, 18, 3098.
doi: 10.1021/acs.orglett.6b01265 pmid: 27324401 |
| [44] |
Shrestha, R.; Khanal, H. D.; Lee, Y. R. RSC Adv. 2019, 9, 17347.
doi: 10.1039/c9ra03146d |
| [45] |
Bollikolla, H. B.; Choppakatla, S.; Polam, N.; Thripuram, V. D.; Chidipudi, S. R. Asian J. Org. Chem. 2017, 6, 1598.
doi: 10.1002/ajoc.v6.11 |
| [46] |
Neve, J. E.; Wijesekera, H. P.; Duffy, S.; Jenkins, I. D.; Ripper, J. A.; Teague, S. J.; Campitelli, M.; Garavelas, A.; Nikolakopoulos, G.; Le, P. V.; Leone, P.; Pham, N. B.; Shelton, P.; Fraser, N.; Carroll, A. R.; Avery, V. M.; McCrae, C.; Williams, N.; Quinn, R. J. J. Med. Chem. 2014, 57, 1252.
doi: 10.1021/jm401321v |
| [47] |
Yetra, S. R.; Roy, T.; Bhunia, A.; Porwal, D.; Biju, A. T. J. Org. Chem. 2014, 79, 4245.
doi: 10.1021/jo500693h |
| [48] |
Zhang, C.; Jin, L.; Mondie, B.; Mitchell, S. S.; Castelhano, A. L.; Cai, W. Z.; Bergenhem, N. Bioorg. Med. Chem. Lett. 2003, 13, 1433.
|
| [49] |
Zhang, Z.; Wallace, M. B.; Feng, J.; Stafford, J. A.; Skene, R. J.; Shi, L.; Lee, B.; Aertgeerts, K.; Jennings, A.; Xu, R.; Kassel, D. B.; Kaldor, S. W.; Navre, M.; Webb, D. R.; Gwaltney, S. L. J. Med. Chem. 2011, 54, 510.
doi: 10.1021/jm101016w |
| [50] |
Cai, Z. W.; Wei, D.; Borzilleri, R. M.; Qian, L.; Kamath, A.; Mortillo, S.; Wautlet, B.; Henley, B. J.; Jeyaseelan, R. S.; Tokarski, J.; Hunt, J. T.; Bhide, R. S.; Fargnoli, J.; Lombardo, L. J. Bioorg. Med. Chem. Lett. 2008, 18, 1354.
doi: 10.1016/j.bmcl.2008.01.012 |
| [51] |
Awale, M.; Mohan, C. G. J. Mol. Graphics Modell. 2008, 26, 1169.
doi: 10.1016/j.jmgm.2007.10.008 |
| [52] |
Ke, Z.; Lu, T.; Liu, H.; Yuan, H.; Ran, T.; Zhang, Y.; Yao, S.; Xiong, X.; Xu, J.; Xu, A.; Chen, Y. J. Mol. Struct. 2014, 1067, 127.
doi: 10.1016/j.molstruc.2014.03.036 |
| [53] |
Dugar, S.; Hollinger, F. P; Kuila, B.; Arora, R.; Sen, S.; Mahajan, D. Bioorg. Med. Chem. Lett. 2015, 25, 3142.
doi: 10.1016/j.bmcl.2015.06.007 |
| [54] |
Collin, M. P.; Lobell, M.; Hubsch, W.; Brohm, D.; Schirok, H.; Jautelat, R.; Lustig, K.; Bomer, U.; Vohringer, V.; Heroult, M.; Grunewald, S.; Hess, S. H. Med. Chem. 2018, 13, 437.
|
| [55] |
Qin, L. Y.; Ruan, Z.; Cherney, R. J.; Dhar, T. G. M.; Neels, J.; Weigelt, C. A.; Sack, J. S.; Srivastava, A. S.; Cornelius, L. A. M.; Tino, J. A.; Stefanski, K.; Gu, X.; Xie, J.; Susulic, V.; Yang, X.; Yarde, C. M.; Skala, S.; Bosnius, R.; Goldstein, C.; Davies, P.; Ruepp, S.; Salter, C. L.; Bhide, R. S.; Poss, M A. Bioorg. Med. Chem. Lett. 2017, 27, 855.
doi: 10.1016/j.bmcl.2017.01.016 |
| [56] |
Shi, W.; Qiang, H.; Huang, D. D.; Bi, X. Z.; Huang, W. L.; Qian, H. Eur. J. Med. Chem. 2018, 158, 814.
doi: 10.1016/j.ejmech.2018.09.050 |
| [57] |
Holmes, J. L.; Almeida, L.; Barlaam, B.; Croft, R. A.; Dishington, A. P.; Gingipalli, L.; Hassall, L. A.; Hawkins, J. L.; Ioannidis, S.; Johannes, J. W.; McGuire, T. M.; Moore, J. E.; Patel, A.; Pike, K. G.; Pontz, T.; Wu, X. Y.; Wang, T.; Zhang, H. J.; Zheng, X. L. Synthesis 2016, 48, 1226.
doi: 10.1055/s-00000084 |
| [58] |
Jia, H.; Dai, G.; Su, W.; Xiao, K.; Weng, J.; Zhang, Z.; Wang, Q.; Yuan, T.; Shi, F.; Zhang, Z.; Chen, W.; Sai, Y.; Wang, J.; Li, X.; Cai, Y.; Yu, J.; Ren, P.; Venable, J.; Rao, T.; Edwards, J. P.; Bembenek, S. D. J. Med. Chem. 2019, 62, 4936.
doi: 10.1021/acs.jmedchem.8b02014 |
| [59] |
Falsini, M.; Squarcialupi, L.; Catarzi, D.; Varano, F.; Betti, M.; Dal, B. D.; Marucci, G.; Buccioni, M.; Volpini, R.; De, V. T.; Cavalli, A.; Colotta, V. J. Med. Chem. 2017, 60, 5772.
doi: 10.1021/acs.jmedchem.7b00457 pmid: 28590753 |
| [60] |
Jethava, D. J.; Acharya, P. T.; Vasava, M. S.; Bhoi, M. N.; Bhavsar, Z. A.; Rathwa, S. K.; Rajani, D. P.; Patel, H. D. J. Mol. Struct. 2019, 1184, 168.
doi: 10.1016/j.molstruc.2019.01.091 |
| [61] |
Guan, L. P.; Zhang, R. P.; Chang, Y.; Gan, X. X. Asian J. Chem. 2013, 25, 3660.
doi: 10.14233/ajchem |
| [62] |
Hou, Y. L.; Zhu, L. Y.; Li, Z. W.; Shen, Q.; Xu, Q. L.; Li, W.; Liu, Y. J.; Gong, P. Eur. J. Med. Chem. 2019, 163, 690.
doi: 10.1016/j.ejmech.2018.12.009 |
| [63] |
Mannam, M. R.; Devineni, S. R.; Pavuluri, C. M.; Chamarthi, N. R.; Kottapalli, R. S. P. Phosphorus, Sulfur Silicon Relat. Elem. 2019, 194, 922.
doi: 10.1080/10426507.2019.1577845 |
| [64] |
Sumran, G.; Aggarwal, R.; Mittal, A.; Aggarwal, A.; Gupta, A. Bioorg. Chem. 2019, 88, 102932.
doi: 10.1016/j.bioorg.2019.102932 |
| [65] |
Unciti-Broceta, A.; Pineda-de-las-Infantas, M. J.; Díaz-Mochón, J. J.; Romagnoli, R.; Baraldi, P. G.; Gallo, M. A.; Espinosa, A. J. Org. Chem. 2005, 70, 2878.
pmid: 15787593 |
| [66] |
Ayothiraman, R.; Bandaru, D.; Paranthaman, R.; Fenster, M.; Eastgate, M. D.; Vaidyanathan, R. Org. Process Res. Dev. 2019, 23, 2510.
doi: 10.1021/acs.oprd.9b00396 |
| [67] |
Li, C. M.S. Thesis Fudan University, Shanghai, 2010. (in Chinese)
|
|
(李超, 硕士论文, 复旦大学, 上海, 2010.)
|
|
| [68] |
Deacon, C. F.; Hughes, T. E.; Holst, J. J. Diabetes 1998, 47, 764.
pmid: 9588448 |
| [1] | 吴思敏, 唐嘉欣, 周于佳, 徐学涛, 张昊星, 王少华. 2β-Acetoxyferruginol去醋酸基骨架衍生物抑制α-葡萄糖苷酶活性研究[J]. 有机化学, 2024, 44(2): 613-621. |
| [2] | 霍海波, 李桂霞, 王世军, 韩春, 师宝君, 李健. 新型γ-咔啉衍生物的合成及其抑菌活性研究[J]. 有机化学, 2024, 44(1): 204-215. |
| [3] | 王锋, 陈钰, 裴鸿艳, 张静, 张立新. 含哌啶的新型1,2,4-噁二唑类衍生物的设计合成及抗真菌活性研究[J]. 有机化学, 2023, 43(8): 2826-2836. |
| [4] | 刘敏, 杨冬燕, 肖玉梅, 苏旺苍, 赵峰海, 覃兆海. 5-硝基亚氨基[1,4-2H]-1,2,4-三唑啉烯式吡虫啉类似物的合成及生物活性研究[J]. 有机化学, 2023, 43(8): 2790-2799. |
| [5] | 关丽, 周艳艳, 毛永爆, 付恺森, 关文惠, 付义乐. 甲川链修饰菁染料的合成研究进展[J]. 有机化学, 2023, 43(8): 2682-2698. |
| [6] | 左鑫, 许诗诺, 陈忠洋, 鄢剑锋, 袁耀锋. 茂铁类单分子结电子传输性质的研究进展[J]. 有机化学, 2023, 43(7): 2313-2322. |
| [7] | 何金燕, 田富云, 吴青青, 郑月明, 陈玉婷, 许海燕, 金正盛, 詹丽, 程新强, 顾跃玲, 高召兵, 赵桂龙. 基于[3.3.3]螺桨烷的电压门控钙离子通道α2δ亚基配体的合成和生物活性研究[J]. 有机化学, 2023, 43(6): 2226-2238. |
| [8] | 钟玉梅, 邹小颖, 卓小丫, 王逸涵, 申佳奕, 郑绿茵, 郭维. 4-氧代-2-亚胺基噻唑烷-5-亚基乙酸乙酯类化合物的设计、合成及抗癌活性[J]. 有机化学, 2023, 43(4): 1452-1461. |
| [9] | 刘兴周, 于明加, 梁建华. 原小檗碱骨架的合成及其抗炎活性研究进展[J]. 有机化学, 2023, 43(4): 1325-1340. |
| [10] | 徐欢, 吴鸿飞, 张晓鸣, 路星星, 孙腾达, 亓悦, 林誉凡, 杨新玲, 张莉, 凌云. 含1,2,3,4-四氢异喹啉片段磺酰肼和酰肼类化合物的设计、合成及生物活性研究[J]. 有机化学, 2023, 43(2): 725-733. |
| [11] | 宋树勇, 徐森苗. 三氟甲基烯烃的选择性C-F键活化最新进展[J]. 有机化学, 2023, 43(2): 411-425. |
| [12] | 刘鹏, 钟富明, 廖礼豪, 谭伟强, 赵晓丹. 炔烃参与的去芳构化反应构建螺环己二烯酮类化合物的研究进展[J]. 有机化学, 2023, 43(12): 4019-4035. |
| [13] | 张雨杉, 桓臻, 杨金东, 程津培. 氮杂环磷氢试剂的氢转移活性研究进展[J]. 有机化学, 2023, 43(11): 3806-3825. |
| [14] | 孙昌兴, 张福豪, 张欢, 李鹏辉, 姜林. 新型2-(1-甲基-1H-吡唑-4-基)嘧啶-4-甲酰胺的设计、合成、杀菌活性及分子对接研究[J]. 有机化学, 2023, 43(1): 229-235. |
| [15] | 张蓉, 郜祥, 陈玲玲, 南发俊. 噻唑-噁唑串联杂环类RNA剪接抑制剂的发现及构效关系研究[J]. 有机化学, 2022, 42(9): 2925-2939. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||