有机化学 ›› 2023, Vol. 43 ›› Issue (1): 1-16.DOI: 10.6023/cjoc202205033 上一篇 下一篇
综述与进展
陈泗林a,b, 杨芸辉b,c,*( ), 陈超a,*(
), 陈超a,*( ), 王从洋b,c,*(
), 王从洋b,c,*( )
)
收稿日期:2022-05-20
修回日期:2022-08-09
发布日期:2022-08-25
通讯作者:
杨芸辉, 陈超, 王从洋
基金资助:
Silin Chena,b, Yunhui Yangb,c( ), Chao Chena(
), Chao Chena( ), Congyang Wangb,c(
), Congyang Wangb,c( )
)
Received:2022-05-20
Revised:2022-08-09
Published:2022-08-25
Contact:
Yunhui Yang, Chao Chen, Congyang Wang
Supported by:文章分享
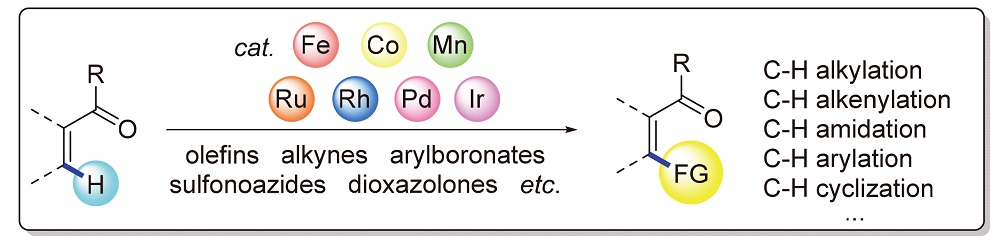
近二十年来, 过渡金属催化的酮羰基导向C—H键活化已发展成为在酮的非传统反应位点构建碳碳键和碳杂键(杂原子为氮、氟和氧原子等)的强有力而快捷的手段. 其中, 钌、铑、钯、铱等贵金属催化的酮羰基导向C—H键活化反应得到了广泛研究, 而廉价3d金属锰、铁和钴催化的酮羰基导向C—H活化反应逐渐成为当前研究的热点. 文中按照过渡金属催化的酮羰基导向C—H键官能化的不同反应类型(烷基化、烯基化、酰胺化、芳基化、环化等)综述了该领域近年来(2014~2021)的研究进展.
陈泗林, 杨芸辉, 陈超, 王从洋. 过渡金属催化的酮羰基导向C—H键官能化反应进展[J]. 有机化学, 2023, 43(1): 1-16.
Silin Chen, Yunhui Yang, Chao Chen, Congyang Wang. Advances in Transition-Metal-Catalyzed Keto Carbonyl-Directed C—H Bond Functionalization Reactions[J]. Chinese Journal of Organic Chemistry, 2023, 43(1): 1-16.
| [1] |
(a) Zheng, Q.-Z.; Jiao, N. Tetrahedron Lett. 2014, 55, 1121.
doi: 10.1016/j.tetlet.2013.12.107 pmid: 30033454 |
|
(b) Huang, Z.; Lim, H. N.; Mo, F.; Young, M. C.; Dong, G. Chem. Soc. Rev. 2015, 44, 7764.
doi: 10.1039/C5CS00272A pmid: 30033454 |
|
|
(c) Sambiagio, C.; Schonbauer, D.; Blieck, R.; Dao-Huy, T.; Pototschnig, G.; Schaaf, P.; Wiesinger, T.; Zia, M. F.; Wencel- Delord, J.; Besset, T.; Maes, B. U. W.; Schnurch, M. Chem. Soc. Rev. 2018, 47, 6603.
doi: 10.1039/c8cs00201k pmid: 30033454 |
|
| [2] |
Murai, S.; Kakiuchi, F.; Sekine, S.; Tanaka, Y.; Kamatani, A.; Sonoda, M.; Chatani, N. Nature 1993, 366, 529.
doi: 10.1038/366529a0 |
| [3] |
Wang, Z.; Wang, C. Green Synth. Catal. 2021, 2, 66.
|
| [4] |
Crisenza, G. E.; McCreanor, N. G.; Bower, J. F. J. Am. Chem. Soc. 2014, 136, 10258.
doi: 10.1021/ja505776m pmid: 25019322 |
| [5] |
Tsuchikama, K.; Kasagawa, M.; Hashimoto, Y.-K.; Endo, K.; Shibata, T. J. Organomet. Chem. 2008, 693, 3939.
doi: 10.1016/j.jorganchem.2008.09.065 |
| [6] |
Kimura, N.; Kochi, T.; Kakiuchi, F. J. Am. Chem. Soc. 2017, 139. 14849.
doi: 10.1021/jacs.7b08385 pmid: 29039660 |
| [7] |
Kimura, N.; Kochi, T.; Kakiuchi, F. Asian J. Org. Chem. 2019, 8, 1115.
doi: 10.1002/ajoc.201900209 |
| [8] |
Kommagalla, Y.; Srinivas, K.; Ramana, C. V. Chem.-Eur. J. 2014, 20, 7884.
doi: 10.1002/chem.201400401 pmid: 24838794 |
| [9] |
Srinivas, K.; Dangat, Y.; Kommagalla, Y.; Vanka, K.; Ramana, C. V. Chem.-Eur. J. 2017, 23, 7570.
doi: 10.1002/chem.201700643 pmid: 28370600 |
| [10] |
Bettadapur, K. R.; Lanke, V.; Prabhu, K. R. Org. Lett. 2015, 17. 4658.
doi: 10.1021/acs.orglett.5b01810 pmid: 26348371 |
| [11] |
Sherikar, M. S.; Kapanaiah, R.; Lanke, V.; Prabhu, K. R. Chem. Commun. 2018, 54, 12113.
doi: 10.1039/C8CC07006G |
| [12] |
Han, S. H.; Kim, S.; De, U.; Mishra, N. K.; Park, J.; Sharma, S.; Kwak, J. H.; Han, S.; Kim, H. S.; Kim, I. S. J. Org. Chem. 2016, 81, 12416.
doi: 10.1021/acs.joc.6b02577 |
| [13] |
Borah, A. J.; Shi, Z. Chem. Commun. 2017, 53, 3945.
doi: 10.1039/C7CC01274H |
| [14] |
Li, J.-F.; Zhao, R.-F.; Zhou, F.-Q.; She, M.-Y.; Zhang, J.; Yin, B.; Zhang, S.-Y.; Li, J.-L. Org. Chem. Front. 2019, 6, 2607.
doi: 10.1039/C8QO01338A |
| [15] |
Chen, X.; Zheng, G.; Li, Y.; Song, G.; Li, X. Org. Lett. 2017, 19, 6184.
doi: 10.1021/acs.orglett.7b03099 |
| [16] |
Lee, S. H.; Kundu, A.; Han, S. H.; Mishra, N. K.; Kim, K. S.; Choi, M. H.; Pandey, A. K.; Park, J. S.; Kim, H. S.; Kim, I. S. ACS Omega 2018, 3, 2661.
doi: 10.1021/acsomega.8b00179 |
| [17] |
Shang, R.; Ilies, L.; Nakamura, E. J. Am. Chem. Soc. 2016, 138, 10132.
doi: 10.1021/jacs.6b06908 pmid: 27487172 |
| [18] |
Santhoshkumar, R.; Mannathan, S.; Cheng, C. H. Org. Lett. 2014, 16, 4208.
doi: 10.1021/ol501904e pmid: 25099927 |
| [19] |
Li, G.; Wan, L.; Zhang, G.; Leow, D.; Spangler, J.; Yu, J. Q. J. Am. Chem. Soc. 2015, 137, 4391.
doi: 10.1021/ja5126897 |
| [20] |
Hu, Y.; Zhou, B.; Chen, H.; Wang, C. Angew. Chem., Int. Ed. 2018, 57, 12071.
doi: 10.1002/anie.201806287 |
| [21] |
Wang, C.; Zhang, Q. Green Synth. Catal. 2022, 3, 287.
|
| [22] |
Lanke, V.; Bettadapur, K. R.; Prabhu, K. R. Org. Lett. 2016, 18, 5496.
doi: 10.1021/acs.orglett.6b02698 |
| [23] |
Bakthadoss, M.; Kumar, P. V.; Reddy, T. S. Eur. J. Org. Chem. 2017, 2017, 4439.
doi: 10.1002/ejoc.201700513 |
| [24] |
Sk, M. R.; Bera, S. S.; Maji, M. S. Adv. Synth. Catal. 2019, 361, 585.
doi: 10.1002/adsc.201801385 |
| [25] |
Sk, M. R.; Maji, M. S. Org. Chem. Front. 2020, 7, 19.
doi: 10.1039/C9QO01164A |
| [26] |
Elumalai, K.; Leong, W. K. Tetrahedron Lett. 2018, 59, 113.
doi: 10.1016/j.tetlet.2017.11.058 |
| [27] |
(a) Li, C.; Wang, S. M.; Qin, H. L. Org. Lett. 2018, 20, 4699.
doi: 10.1021/acs.orglett.8b02037 |
|
(b) Bettadapur, K. R.; Sherikar, M. S.; Lanke, V.; Prabhu, K. R. Asian J. Org. Chem. 2018, 7, 1338.
doi: 10.1002/ajoc.201800193 |
|
| [28] |
Dana, S.; Giri, C. K.; Baidya, M. Org. Lett. 2021, 23, 6855.
doi: 10.1021/acs.orglett.1c02424 |
| [29] |
Hu, F.; Szostak, M. Chem. Commun. 2016, 52, 9715.
doi: 10.1039/C6CC04537E |
| [30] |
Kim, J.; Chang, S. Angew. Chem., Int. Ed. 2014, 53, 2203.
doi: 10.1002/anie.201310544 |
| [31] |
Kong, X.; Xu, B. Org. Lett. 2018, 20, 4495.
doi: 10.1021/acs.orglett.8b01770 |
| [32] |
Bera, S. S.; Sk, M. R.; Maji, M. S. Chem.-Eur. J. 2019, 25, 1806.
doi: 10.1002/chem.201805376 |
| [33] |
Kim, Y.; Park, J.; Chang, S. Org. Lett. 2016, 18, 1892.
doi: 10.1021/acs.orglett.6b00662 |
| [34] |
Song, Z.; Antonchick, A. P. Org. Biomol. Chem. 2016, 14, 4804.
doi: 10.1039/C6OB00926C |
| [35] |
Xu, L.; Tan, L.; Ma, D. J. Org. Chem. 2016, 81, 10476.
doi: 10.1021/acs.joc.6b01856 |
| [36] |
Hande, A. E.; Prabhu, K. R. J. Org. Chem. 2017, 82, 13405.
doi: 10.1021/acs.joc.7b02500 |
| [37] |
Lanke, V.; Prabhu, K. R. Chem. Commun. 2017, 53, 5117.
doi: 10.1039/C7CC00763A |
| [38] |
Chen, S.; Feng, B.; Zheng, X.; Yin, J.; Yang, S.; You, J. Org. Lett. 2017, 19, 2502.
doi: 10.1021/acs.orglett.7b00730 |
| [39] |
Shi, X.; Xu, W.; Wang, R.; Zeng, X.; Qiu, H.; Wang, M. J. Org. Chem. 2020, 85, 3911.
doi: 10.1021/acs.joc.9b03018 |
| [40] |
Wang, F.; Jin, L.; Kong, L.; Li, X. Org. Lett. 2017, 19, 1812.
doi: 10.1021/acs.orglett.7b00583 pmid: 28358202 |
| [41] |
Shi, P.; Wang, L.; Chen, K.; Wang, J.; Zhu, J. Org. Lett. 2017, 19, 2418.
doi: 10.1021/acs.orglett.7b00968 |
| [42] |
Yamamoto, T.; Yamakawa, T. RSC Adv. 2015, 5, 105829.
doi: 10.1039/C5RA19810K |
| [43] |
Ogiwara, Y.; Miyake, M.; Kochi, T.; Kakiuchi, F. Organometallics 2017, 36, 159.
doi: 10.1021/acs.organomet.6b00540 |
| [44] |
Suzuki, I.; Kondo, H.; Kochi, T.; Kakiuchi, F. J. Org. Chem. 2019, 84, 12975.
doi: 10.1021/acs.joc.9b01756 pmid: 31533418 |
| [45] |
Zhang, B.; Wang, H. W.; Kang, Y. S.; Zhang, P.; Xu, H. J.; Lu, Y.; Sun, W. Y. Org. Lett. 2017, 19.
|
| [46] |
Zhang, C.; Rao, Y. Org. Lett. 2015, 17, 4456.
doi: 10.1021/acs.orglett.5b02115 pmid: 26322534 |
| [47] |
Bruneau, C.; Gramage-Doria, R. Adv. Synth. Catal. 2016, 358, 3847.
doi: 10.1002/adsc.201600735 |
| [48] |
Paymode, D. J.; Ramana, C. V. J. Org. Chem. 2015, 80, 11551.
doi: 10.1021/acs.joc.5b01932 pmid: 26461428 |
| [49] |
Yang, Y.; Gao, P.; Zhao, Y.; Shi, Z. Angew. Chem., Int. Ed. 2017, 56, 3966.
doi: 10.1002/anie.201612599 |
| [50] |
Rago, A. J.; Dong, G. Green Synth. Catal. 2021, 2, 216.
|
| [51] |
Shibata, T.; Ryu, N.; Takano, H. Adv. Synth. Catal. 2015, 357, 1131.
doi: 10.1002/adsc.201401163 |
| [52] |
Shinde, V. S.; Mane, M. V.; Cavallo, L.; Rueping, M. Chem.-Eur. J. 2020, 26, 8308.
doi: 10.1002/chem.202001793 |
| [53] |
Zhou, S.; Wang, J.; Wang, L.; Song, C.; Chen, K.; Zhu, J. Angew. Chem., Int. Ed. 2016, 55, 9384.
doi: 10.1002/anie.201603943 |
| [54] |
Zhao, Y.; Li, S.; Zheng, X.; Tang, J.; She, Z.; Gao, G.; You, J. Angew. Chem., Int. Ed. 2017, 56, 4286.
doi: 10.1002/anie.201612147 |
| [55] |
Yu, Y.; Wu, Q.; Liu, D.; Hu, L.; Yu, L.; Tan, Z.; Zhu, G. J. Org. Chem. 2019, 84, 7449.
doi: 10.1021/acs.joc.9b00595 |
| [56] |
Zhou, B.; Hu, Y.; Liu, T.; Wang, C. Nat. Commun. 2017, 8, 1169.
doi: 10.1038/s41467-017-01262-4 |
| [57] |
Liu, T.; Hu, Y.; Yang, Y.; Wang, C. CCS Chem. 2020, 2, 749.
|
| [58] |
Huo, J.; Yang, Y.; Wang, C. Org. Lett. 2021, 23, 3384.
doi: 10.1021/acs.orglett.1c00857 |
| [59] |
Dethe, D. H.; C, B. N.; Bhat, A. A. J. Org. Chem. 2020, 85, 7565.
doi: 10.1021/acs.joc.0c00727 |
| [60] |
Yanagawa, M.; Harada, S.; Hirose, S.; Nemoto, T. Adv. Synth. Catal. 2021, 363, 2189.
doi: 10.1002/adsc.202100098 |
| [61] |
Sk, M. R.; Bera, S. S.; Maji, M. S. Org. Lett. 2018, 20, 134.
doi: 10.1021/acs.orglett.7b03440 |
| [62] |
Ali, S.; Huo, J.; Wang, C. Org. Lett. 2019, 21, 6961.
doi: 10.1021/acs.orglett.9b02554 |
| [63] |
Zhang, K.; Khan, R.; Chen, J.; Zhang, X.; Gao, Y.; Zhou, Y.; Li, K.; Tian, Y.; Fan, B. Org. Lett. 2020, 22, 3339.
doi: 10.1021/acs.orglett.0c00765 |
| [64] |
Lee, P. Y.; Liang, P.; Yu, W. Y. Org. Lett. 2017, 19, 2082.
doi: 10.1021/acs.orglett.7b00677 |
| [65] |
Zhang, J.; Wu, M.; Fan, J.; Xu, Q.; Xie, M. Chem. Commun. 2019, 55, 8102.
doi: 10.1039/C9CC03893K |
| [66] |
Wu, Q.; Mao, Y. J.; Zhou, K.; Wang, S.; Chen, L.; Xu, Z. Y.; Lou, S. J.; Xu, D. Q. Chem. Commun. 2021, 57, 4544.
doi: 10.1039/D1CC01047F |
| [67] |
Tan, X.; Massignan, L.; Hou, X.; Frey, J.; Oliveira, J. C. A.; Hussain, M. N.; Ackermann, L. Angew. Chem., Int. Ed. 2021, 60, 13264.
doi: 10.1002/anie.202017359 |
| [1] | 邹发凯, 王能中, 姚辉, 王慧, 刘明国, 黄年玉. 1β-/3R-芳基硫代糖的区域与立体选择性合成[J]. 有机化学, 2024, 44(2): 593-604. |
| [2] | 刘继宇, 李圣玉, 陈款, 朱茵, 张元. 三苯胺功能化有序介孔聚合物作为无金属光催化剂用于二硫化物合成[J]. 有机化学, 2024, 44(2): 605-612. |
| [3] | 杨爽, 房新强. 氮杂环卡宾催化实现的动力学拆分近期研究进展[J]. 有机化学, 2024, 44(2): 448-480. |
| [4] | 李路瑶, 贺忠文, 张振国, 贾振华, 罗德平. 三芳基碳正离子在有机合成中的应用[J]. 有机化学, 2024, 44(2): 421-437. |
| [5] | 陈宛婷, 钟雄威, 邢佳乐, 吴昌书, 高杨. C—N轴手性化合物的不对称催化合成研究进展[J]. 有机化学, 2024, 44(2): 349-377. |
| [6] | 黄净, 杨毅华, 张占辉, 刘守信. 酰胺键的绿色高效构建方法与技术进展[J]. 有机化学, 2024, 44(2): 409-420. |
| [7] | 刘杰, 韩峰, 李双艳, 陈天煜, 陈建辉, 徐清. 无过渡金属参与甲基杂环化合物与醇的选择性有氧烯基化反应[J]. 有机化学, 2024, 44(2): 573-583. |
| [8] | 梅青刚, 李清寒. 可见光促进C(3)(杂)芳硫基吲哚化合物的合成研究进展[J]. 有机化学, 2024, 44(2): 398-408. |
| [9] | 李洋, 董亚楠, 李跃辉. 经由N-硼基酰胺中间体的酰胺高效转化合成腈类化合物[J]. 有机化学, 2024, 44(2): 638-643. |
| [10] | 李思达, 崔鑫, 舒兴中, 吴立朋. 钛催化的烯烃制备1,1-二硼化合物[J]. 有机化学, 2024, 44(2): 631-637. |
| [11] | 童红恩, 郭宏宇, 周荣. 可见光促进惰性碳-氢键对羰基的加成反应进展[J]. 有机化学, 2024, 44(1): 54-69. |
| [12] | 董江湖, 宣良明, 王池, 赵晨熙, 王海峰, 严琼姣, 汪伟, 陈芬儿. 无过渡金属或无光催化剂条件下可见光促进喹喔啉酮C(3)—H官能团化研究进展[J]. 有机化学, 2024, 44(1): 111-136. |
| [13] | 李梦竹, 孟博莹, 兰文捷, 傅滨. 邻亚甲醌与硫叶立德反应合成2,3-二取代苯并二氢呋喃化合物[J]. 有机化学, 2024, 44(1): 195-203. |
| [14] | 姜权彬. 经由氮杂邻联烯醌中间体合成轴手性化合物的研究进展[J]. 有机化学, 2024, 44(1): 159-172. |
| [15] | 文思, 丁宇浩, 田青于, 葛进, 程国林. 铑(III)催化苯甲亚胺酸乙酯和CF3-亚胺氧锍叶立德C—H 活化/环化反应合成CF3-1H-苯并[de][1,8]萘吡啶[J]. 有机化学, 2024, 44(1): 291-300. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||