有机化学 ›› 2024, Vol. 44 ›› Issue (1): 70-84.DOI: 10.6023/cjoc202306005 上一篇 下一篇
综述与进展
赵红琼a, 于淼a, 宋冬雪a, 贾琦b, 刘颖杰a, 季宇彬a, 许颖a,*( )
)
收稿日期:2023-06-05
修回日期:2023-08-09
发布日期:2023-09-08
作者简介:基金资助:
Hongqiong Zhaoa, Miao Yua, Dongxue Songa, Qi Jiab, Yingjie Liua, Yubin Jia, Ying Xua( )
)
Received:2023-06-05
Revised:2023-08-09
Published:2023-09-08
Contact:
*E-mail: About author:Supported by:文章分享

羧酸是廉价易得、稳定性好且功能多样的分子, 羧酸脱羧羟基化提供了从稳定易得的羧酸原料通过良性单碳切除还原直接快速获得重要醇分子的途径, 醇类化合物作为重要功能性分子在各领域的应用随处可见, 因此在有机合成和自然界中是一种非常重要和有用的转化. 主要从过渡金属催化、光催化、电催化及其他类型催化方面, 分类总结了脱羧羟基化反应得到相应伯醇、仲醇和叔醇的研究进展, 并探讨了部分反应可能的机理和适用范围. 其中过渡金属催化出现较早, 生成叔醇产率较高, 但底物普适性不强, 而光催化反应条件温和, 环境污染小, 对生成伯仲叔醇均适用.
赵红琼, 于淼, 宋冬雪, 贾琦, 刘颖杰, 季宇彬, 许颖. 羧酸脱羧羟基化反应研究进展[J]. 有机化学, 2024, 44(1): 70-84.
Hongqiong Zhao, Miao Yu, Dongxue Song, Qi Jia, Yingjie Liu, Yubin Ji, Ying Xu. Progress on Decarboxylation and Hydroxylation of Carboxylic Acids[J]. Chinese Journal of Organic Chemistry, 2024, 44(1): 70-84.



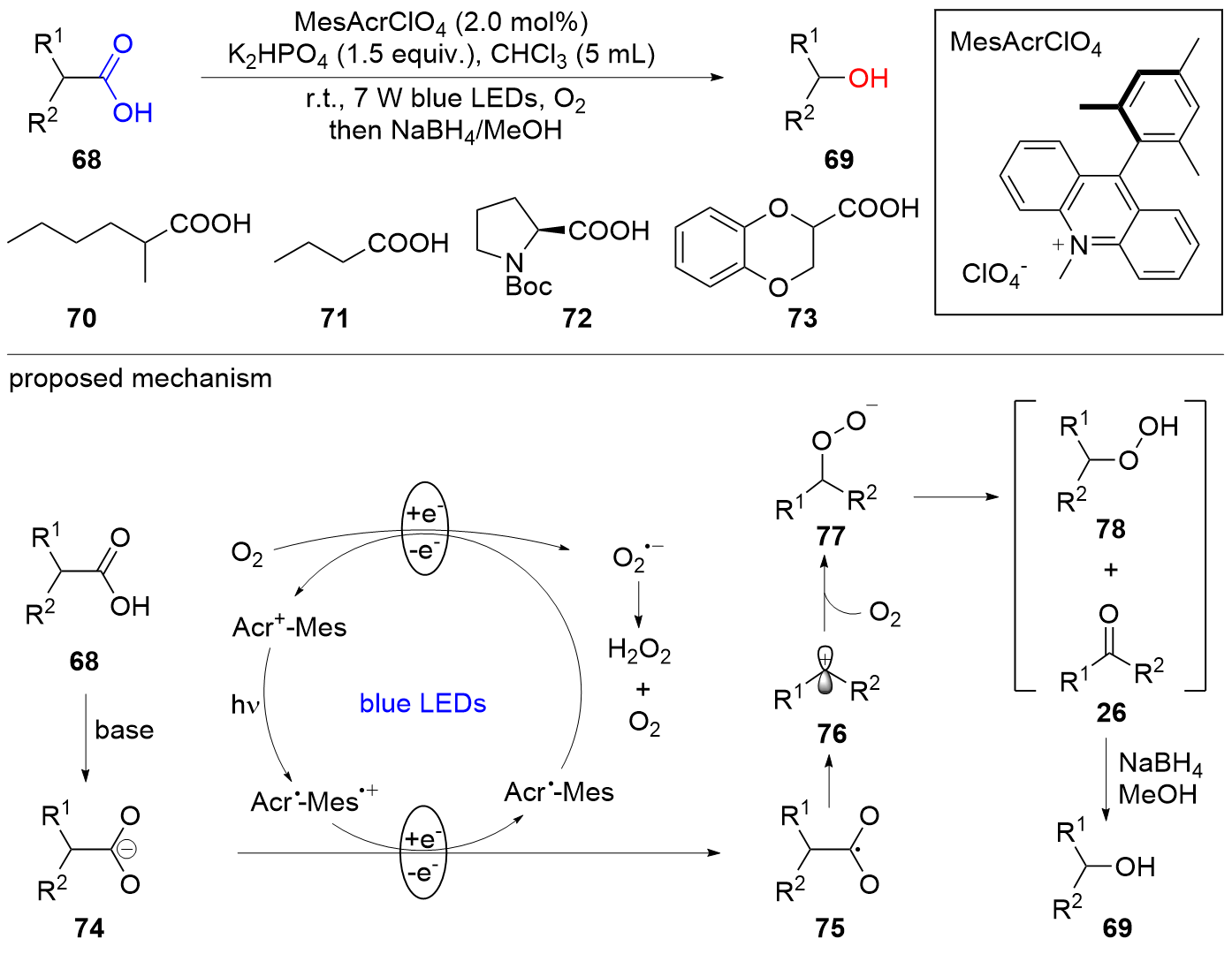
| [1] |
(a) Devine, P. N.; Howard, R. M.; Kumar, R.; Thompson, M. P.; Truppo, M. D.; Turner, N. Nat. Rev. Chem. 2018, 2, 409.
doi: 10.1038/s41570-018-0055-1 |
|
(b) Simić, S.; Zukić, E.; Schmermund, L.; Faber, K.; Winkler, C. K.; Kroutil, W. Chem. Rev. 2022, 122, 1052.
doi: 10.1021/acs.chemrev.1c00574 |
|
| [2] |
(a) Schwartz, R. E.; Helms, G. L.; Bolessa, E. A.; Wilson, K. E.; Giacobbe, R. A.; Tkacz, J. S.; Bills, G. F.; Liesch, J. M.; Zink, D. L.; Curotto, J. E.; Pramanik, B.; Onishi, J. C. Tetrahedron 1994, 50, 1675.
doi: 10.1016/S0040-4020(01)80843-7 |
|
(b) Coutrot, P.; Claudel, S.; Didierjean, C.; Grison, C. Bioorg. Med. Chem. Lett. 2006, 16, 417.
doi: 10.1016/j.bmcl.2005.09.068 |
|
|
(c) Corey, E. J.; Reichard, G. A. J. Am. Chem. Soc. 1992, 114, 10677.
doi: 10.1021/ja00052a096 |
|
|
(d) Uno, H.; Baldwin, J. E.; Russell, A. T. J. Am. Chem. Soc. 1994, 116, 2139.
doi: 10.1021/ja00084a062 |
|
| [3] |
Xu, S.-C.; Zhu, S.-J.; Bi, L.-W.; Chen, Y.-X.; Wang, J.; Lu, Y.-J.; Gu, Y.; Zhao, Z.-D. Chin. Chem. Lett. 2017, 28, 575.
doi: 10.1016/j.cclet.2016.11.020 |
| [4] |
Xu, X.-Z.; Zhang, F.; Huang, S.; Zhang, Z.-Q.; Ke, F. Chin. J. Org. Chem. 2020, 40, 2912 (in Chinese).
doi: 10.6023/cjoc202005004 |
|
(许秀枝, 张帆, 黄胜, 张志强, 柯方, 有机化学, 2020, 40, 2912.)
|
|
| [5] |
Wang, Y.-L.; Huang, Y.-B.; Xi, H.-P. Organic Chemistry, Chemical Industry Press, Beijing, 2020, p. 1 (in Chinese).
|
|
(王永丽, 黄永斌, 席会平, 有机化学, 化学工业出版社, 北京, 2020, p. 1.)
|
|
| [6] |
(a) Totah, R. A.; Hanzlik, R. P. J. Am. Chem. Soc. 2002, 124, 10000.
doi: 10.1021/ja020559u |
|
(b) Wo, J.; Kong, D.; Brock, N. L.; Xu, F.; Zhou, X.; Deng, Z.; Lin, S. ACS Catal. 2016, 6, 2831.
doi: 10.1021/acscatal.6b00154 |
|
|
(c) Zhang, Z.; Xie, S.; Cheng, B.; Zhai, H.; Li, Y. J. Am. Chem. Soc. 2019, 141, 7147.
doi: 10.1021/jacs.9b02362 |
|
| [7] |
(a) Beckett, A. H.; Rowland, M. J. Pharm. Pharmacol. 1965, 17, 628.
doi: 10.1111/j.2042-7158.1965.tb07575.x |
|
(b) Dring, L. G.; Smith, R. L.; Williams, R. T. Biochem. J. 1970, 116, 425.
doi: 10.1042/bj1160425 |
|
|
(c) El-Haj, B. M.; Ahmed, S. B. M. Molecules 2020, 25, 1937.
doi: 10.3390/molecules25081937 |
|
| [8] |
(a) Komuro, M.; Nagatsu, Y.; Higuchi, T.; Hirobe, M. Tetrahedron Lett. 1992, 33, 4949.
doi: 10.1016/S0040-4039(00)61242-X |
|
(b) Komuro, M.; Higuchi, T.; Hirobe, M. Bioorg. Med. Chem. 1995, 3, 55.
|
|
| [9] |
(a) Rodríguez, N.; Goossen, L. J. Chem. Soc. Rev. 2011, 40, 5030.
doi: 10.1039/c1cs15093f |
|
(b) Xuan, J.; Zhang, Z.; Xiao, W. Angew. Chem., Int. Ed. 2015, 54, 15632.
doi: 10.1002/anie.v54.52 |
|
|
(c) Moon, P. J.; Lundgren, R. J. ACS Catal. 2020, 10, 1742.
doi: 10.1021/acscatal.9b04956 |
|
|
(d) Zeng, Z.; Feceu, A.; Sivendran, N.; Gooßen, L. J. Adv. Synth. Catal. 2021, 363, 2678.
doi: 10.1002/adsc.v363.11 |
|
|
(e) Varenikov, A.; Shapiro, E.; Gandelman, M. Chem. Rev. 2021, 121, 412.
doi: 10.1021/acs.chemrev.0c00813 |
|
| [10] |
(a) Sakakibara, Y.; Ito, E.; Fukushima, T.; Murakami, K.; Itami, K. Chem.-Eur. J. 2018, 24, 9254.
doi: 10.1002/chem.v24.37 |
|
(b) Kong, D.; Moon, P. J.; Bsharat, O.; Lundgren, R. J. Angew. Chem., Int. Ed. 2020, 59, 1313.
doi: 10.1002/anie.v59.3 |
|
|
(c) Nguyen, V. T.; Nguyen, V. D.; Haug, G. C.; Vuong, N. T. H.; Dang, H. T.; Arman, H. D.; Larionov, O. V. Angew. Chem., Int. Ed. 2020, 59, 7921.
doi: 10.1002/anie.v59.20 |
|
|
(d) Narobe, R.; Murugesan, K.; Schmid, S.; König, B. ACS Catal. 2022, 12, 809.
doi: 10.1021/acscatal.1c05077 |
|
|
(e) Li, Q. Y.; Gockel, S. N.; Lutovsky, G. A.; DeGlopper, K. S.; Baldwin, N. J.; Bundesmann, M. W.; Tucker, J. W.; Bagley, S. W.; Yoon, T. P. Nat. Chem. 2022, 14, 94.
doi: 10.1038/s41557-021-00834-8 |
|
| [11] |
(a) Senaweera, S.; Cartwright, K. C.; Tunge, J. A. J. Org. Chem. 2019, 84, 12553.
doi: 10.1021/acs.joc.9b02092 |
|
(b) Martínez, Á. M.; Hayrapetyan, D.; van Lingen, T.; Dyga, M.; Gooßen, L. J. Nat. Commun. 2020, 11, 4407.
doi: 10.1038/s41467-020-18275-1 |
|
|
(c) Maeda, B.; Sakakibara, Y.; Murakami, K.; Itami, K. Org. Lett. 2021, 23, 5113.
doi: 10.1021/acs.orglett.1c01645 |
|
| [12] |
Anderson, J. M.; Kochi, J. K. J. Am. Chem. Soc. 1970, 92, 2450.
doi: 10.1021/ja00711a041 |
| [13] |
DeKlein, W. J.; Kooyman, E. C. J. Catal. 1965, 4, 626.
doi: 10.1016/0021-9517(65)90170-3 |
| [14] |
Anderson, J.; Kochi, J. K. J. Org. Chem. 1970, 35, 986.
doi: 10.1021/jo00829a026 |
| [15] |
Trahanovsky, W. S.; Cramer, J.; Brixius, D. W. J. Am. Chem. Soc. 1974, 96, 1077.
doi: 10.1021/ja00811a022 |
| [16] |
Komuro, M.; Nagatsu, Y.; Higuchi, T.; Hirobe, M. Tetrahedron Lett. 1992, 33, 4949.
doi: 10.1016/S0040-4039(00)61242-X |
| [17] |
(a) Kobayashi, H.; Higuchi, T.; Kaizu, Y.; Osada, H.; Aoki, M. Bull. Chem. Soc. Jpn. 1975, 48, 3137.
doi: 10.1246/bcsj.48.3137 |
|
(b) van der Made, A. W.; Hoppenbrouwer, E. J. H.; Nolte, R. J. M.; Drenth, W. Recl. Trav. Chim. Pays-Bas 1988, 107, 15.
doi: 10.1002/recl.v107:1 |
|
| [18] |
Tangestaninejad, S.; Mirkhani, V. J. Chem. Res., Synop. 1998, 820.
|
| [19] |
Mirkhani, V.; Tangestaninejad, S.; Moghadam, M.; Moghbel, M. Bioorg. Med. Chem. 2004, 12, 903.
|
| [20] |
Mirkhani, V.; Tangestaninejad, S.; Moghadam, M.; Karimian, Z. Bioorg. Med. Chem. Lett. 2003, 13, 3433.
doi: 10.1016/S0960-894X(03)00749-2 |
| [21] |
Haldar, P.; Ray, J. K. Tetrahedron Lett. 2008, 49, 3659.
doi: 10.1016/j.tetlet.2008.03.147 |
| [22] |
(a) Nair, V.; Panicker, S. B.; Nair, L. G.; George, T. G.; Augustine, A. Synlett 2003, 156.
|
|
(b) Nair, V.; Balagopal, L.; Rajan, R.; Mathew, J. Acc. Chem. Res. 2004, 37, 21.
doi: 10.1021/ar030002z |
|
|
(c) Nair, V.; Deepthi, A. Chem. Rev. 2007, 107, 1862.
doi: 10.1021/cr068408n |
|
|
(d) Fujioka, H.; Hirose, H.; Ohba, Y.; Murai, K.; Nakahara, K.; Kita, Y. Tetrahedron 2007, 63, 625.
doi: 10.1016/j.tet.2006.11.004 |
|
| [23] |
Yu, Q.; Zhou, D. L.; Liu, Y. Y.; Huang, X. J.; Song, C. L.; Ma, J. J.; Li, J. K. Org. Lett. 2023, 25, 47.
doi: 10.1021/acs.orglett.2c03741 |
| [24] |
(a) Wang, Z.; Zhu, L.; Yin, F.; Su, Z.; Li, Z.; Li, C. J. Am. Chem. Soc. 2012, 134, 4258.
doi: 10.1021/ja210361z |
|
(b) Yin, F.; Wang, Z.; Li, Z.; Li, C. J. Am. Chem. Soc. 2012, 134, 10401.
doi: 10.1021/ja3048255 |
|
|
(c) Liu, C.; Wang, X.; Li, Z.; Cui, L.; Li, C. J. Am. Chem. Soc. 2015, 137, 9820.
doi: 10.1021/jacs.5b06821 |
|
|
(d) Liu, X.; Wang, Z.; Cheng, X.; Li, C. J. Am. Chem. Soc. 2012, 134, 14330.
doi: 10.1021/ja306638s |
|
|
(e) Cui, L.; Chen, H.; Liu, C.; Li, C. Org. Lett. 2016, 18, 2188.
doi: 10.1021/acs.orglett.6b00802 |
|
|
(f) Tan, X.; Song, T.; Wang, Z.; Chen, H.; Cui, L.; Li, C. Org. Lett. 2017, 19, 1634.
doi: 10.1021/acs.orglett.7b00439 |
|
|
(g) Dong, Y.; Wang, Z.; Li, C. Nat. Commun. 2017, 8, 277.
doi: 10.1038/s41467-017-00376-z |
|
|
(h) Patel, N. R.; Flowers, R. A. J. Org. Chem. 2015, 80, 5834.
doi: 10.1021/acs.joc.5b00826 |
|
|
(l) Zhu, Y.; Li, X.; Wang, X.; Huang, X.; Shen, T.; Zhang, Y.; Sun, X.; Zou, M.; Song, S.; Jiao, N. Org. Lett. 2015, 17, 4702.
doi: 10.1021/acs.orglett.5b02155 |
|
|
(j) Tan, X.; Liu, Z.; Shen, H.; Zhang, P.; Zhang, Z.; Li, C. J. Am. Chem. Soc. 2017, 139, 12430.
doi: 10.1021/jacs.7b07944 |
|
| [25] |
(a) Gooßen, L. J.; Linder, C.; Rodríguez, N.; Lange, P. P.; Fromm, A. Chem. Commun. 2009, 46, 7173.
|
|
(b) Gooßen, L. J.; Rodríguez, N.; Linder, C.; Lange, P. P.; Fromm, A. ChemCatChem 2010, 2, 430.
doi: 10.1002/cctc.v2:4 |
|
|
(c) Li, Y.; Ge, L.; Muhammad, M. T.; Bao, H. Synthesis 2017, 49, 5263.
doi: 10.1055/s-0036-1590935 |
|
|
(d) Jian, W.; Ge, L.; Jiao, Y.; Qian, B.; Bao, H. Angew. Chem., Int. Ed. 2017, 56, 3650.
doi: 10.1002/anie.v56.13 |
|
| [26] |
Thorpe, W. G.; Kochi, J. K. J. Inorg. Nucl. Chem. 1971, 33, 3958.
doi: 10.1016/0022-1902(71)80307-X |
| [27] |
Kamijo, S.; Amaoka, Y.; Inoue, M. Tetrahedron Lett. 2011, 52, 4654.
doi: 10.1016/j.tetlet.2011.06.118 |
| [28] |
Patel, N. R.; Flowers, R. A. J. Org. Chem. 2015, 80, 5834.
doi: 10.1021/acs.joc.5b00826 |
| [29] |
Jayakanthan, K.; Madhusudanan, K. P.; Vankar, Y. D. Tetrahedron 2004, 60, 397.
doi: 10.1016/j.tet.2003.11.013 |
| [30] |
Keith, D. J.; Townsend, S. D. Carbohydr. Res. 2017, 442, 20.
doi: 10.1016/j.carres.2017.02.005 |
| [31] |
Phae-nok, S.; Kuhakarn, C.; Leowanawat, P.; Reutrakul, V.; Soorukram, D. Synlett 2022, 33, 1323.
doi: 10.1055/a-1792-7169 |
| [32] |
Sheldon, R. A.; Kochi, J. K. J. Am. Chem. Soc. 1968, 90, 6688.
doi: 10.1021/ja01026a022 |
| [33] |
(a) Barton, D. H. R.; Crich, D.; Motherwell, W. B. J. Chem. Soc., Chem. Commun. 1984, 242.
|
|
(b) Barton, D. H. R.; Crich, D.; Motherwell, W. B. Tetrahedron 1985, 41, 3901.
doi: 10.1016/S0040-4020(01)97173-X |
|
|
(c) Liu, C.; Wang, X.; Li, Z.; Cui, L.; Li, C. J. Am. Chem. Soc. 2015, 137, 9820.
doi: 10.1021/jacs.5b06821 |
|
| [34] |
Crich, D.; Quintero, L. Chem. Rev. 1989, 89, 1413.
doi: 10.1021/cr00097a001 |
| [35] |
Barton, D. H. R.; Gero, S. D.; Holliday, P.; Quiclet-Sire, B.; Zard, S. Z. Tetrahedron 1998, 54, 6751.
doi: 10.1016/S0040-4020(98)00337-8 |
| [36] |
Barton, D. H. R.; Zard, S. Z. Pure Appl. Chem. 1986, 58, 675.
doi: 10.1351/pac198658050675 |
| [37] |
Okada, K.; Okubo, K.; Oda, M. Tetrahedron Lett. 1992, 33, 83.
doi: 10.1016/S0040-4039(00)77679-9 |
| [38] |
Song, H.-T.; Ding, W.; Zhou, Q.-Q.; Liu, J.; Lu, L.-Q.; Xiao, W.-J. J. Org. Chem. 2016, 81, 7250.
doi: 10.1021/acs.joc.6b01360 |
| [39] |
Wang, G.-Z.; Shang, R.; Cheng, W.-M.; Fu, Y. Org. Lett. 2015, 17, 4830.
doi: 10.1021/acs.orglett.5b02392 |
| [40] |
(a) Ohkubo, K.; Suga, K.; Morikawa, K.; Fukuzumi, S. J. Am. Chem. Soc. 2003, 125, 12850.
doi: 10.1021/ja036645r |
|
(b) Kotani, H.; Ohkubo, K.; Fukuzumi, S. J. Am. Chem. Soc. 2004, 126, 15999.
doi: 10.1021/ja048353b |
|
| [41] |
(a) Cassani, C.; Bergonzini, G.; Wallentin, C.-J. Org. Lett. 2014, 16, 4228.
doi: 10.1021/ol5019294 |
|
(b) Chinzei, T.; Miyazawa, K.; Yasu, Y.; Koike, T.; Akita, M. RSC Adv. 2015, 5, 21297.
doi: 10.1039/C5RA01826A |
|
|
(c) Wu, X.-X.; Meng, C.-N.; Yuan, X.-Q.; Jia, X.-T.; Qian, X.-H.; Ye, J.-X. Chem. Commun. 2015, 51, 11864.
doi: 10.1039/C5CC04527D |
|
|
(d) Wang, K.; Meng, L.-G.; Zhang, Q.; Wang, L. Green Chem. 2016, 18, 2864.
doi: 10.1039/C5GC02550H |
|
| [42] |
(a) Su, Y.-J.; Zhang, L.-R.; Jiao, N. Org. Lett. 2011, 13, 2168.
doi: 10.1021/ol2002013 |
|
(b) Yi, H.; Bian, C.-L.; Hu, X.; Niu, L.-B.; Lei, A. Chem. Commun. 2015, 51, 14046.
doi: 10.1039/C5CC06015J |
|
|
(c) Jung, J.; Kim, J.; Park, G.; You, Y.-M.; Cho, E. J. Adv. Synth. Catal. 2016, 358, 74.
doi: 10.1002/adsc.v358.1 |
|
|
(d) Wang, H.-M.; Lu, Q.-Q.; Qian, C.H.; Liu, C.; Liu, W.; Chen, K.; Lei, A. Angew. Chem., Int. Ed. 2016, 55, 1094.
doi: 10.1002/anie.v55.3 |
|
| [43] |
Sakakibara, Y.; Cooper, P.; Murakami, K.; Itami, K. Chem.-Asian J. 2018, 13, 2410.
doi: 10.1002/asia.v13.17 |
| [44] |
(a) Ohkubo, K.; Suga, K.; Morikawa, K.; Fukuzumi, S. J. Am. Chem. Soc. 2003, 125, 12850.
doi: 10.1021/ja036645r |
|
(b) Ohkubo, K.; Mizushima, K.; Iwata, R.; Souma, K.; Suzuki, N. Fukuzumi, S. Chem. Commun. 2010, 46, 601.
doi: 10.1039/B920606J |
|
|
(c) Yi, H.; Bian, C.; Hu, X.; Niu, L.; Lei, A. Chem. Commun. 2015, 51, 14046.
doi: 10.1039/C5CC06015J |
|
| [45] |
Zheng, C.; Wang, Y.-T.; Xu, Y.-R.; Chen, Z.; Chen, G.-Y.; Liang, S.-H. Org. Lett. 2018, 20, 4824.
doi: 10.1021/acs.orglett.8b01885 |
| [46] |
Shirase, S.; Tamaki, S.; Shinohara, K.; Hirosawa, K.; Tsurugi, H.; Satoh, T.; Mashima, K. J. Am. Chem. Soc. 2020, 142, 5668.
doi: 10.1021/jacs.9b12918 |
| [47] |
Sheldon, R. A.; Kochi, J. K. J. Am. Chem. Soc. 1968, 90, 6688.
doi: 10.1021/ja01026a022 |
| [48] |
Yatham, V. R.; Bellotti, P.; König, B. Chem. Commun. 2019, 55, 3489.
doi: 10.1039/C9CC00492K |
| [49] |
(a) Partenheimer, W. J. Mol. Catal. A: Chem. 2003, 206, 105.
doi: 10.1016/S1381-1169(03)00407-2 |
|
(b) Hermans, I.; Peeters, J.; Vereecken, L.; Jacobs, P. A. ChemPhysChem 2007, 8, 2678.
doi: 10.1002/cphc.v8:18 |
|
|
(c) Wang, X.; Cao, X.; Hu, X.; Li, G.; Zhu, L.; Hu, C. J. Mol. Catal. A: Chem. 2012, 357, 1.
doi: 10.1016/j.molcata.2011.12.005 |
|
| [50] |
Khan, S. N.; Zaman, M. K.; Li, R.; Sun, Z. J. Org. Chem. 2020, 85, 5019.
doi: 10.1021/acs.joc.0c00312 |
| [51] |
Li, P.; Zbieg, J. R.; Terrett, J. A. ACS Catal. 2021, 11, 10997.
doi: 10.1021/acscatal.1c03251 |
| [52] |
Coleman, J. P.; Lines, R.; Utley, J. H. P.; Weedon, B. C. L. J. Chem. Soc., Perkin Trans. 2 1974, 1064.
|
| [53] |
Xiang, J.; Shang, M.; Kawamata, Y.; Lundberg, H.; Reisberg, S.H.; Chen, M.; Mykhailiuk, P.; Beutner, G.; Collins, M. R.; Davies, A.; Del Bel, M.; Gallego, G. M.; Spangler, J. E.; Starr, J.; Yang, S.; Blackmond, D. G.; Baran, P. S. Nature 2019, 573, 398.
doi: 10.1038/s41586-019-1539-y |
| [54] |
(a) Boto, A.; Hernández, R.; Suárez, E. Tetrahedron Lett. 1999, 40, 5945.
doi: 10.1016/S0040-4039(99)01180-6 |
|
(b) Boto, A.; Hernández, R.; Suárez, E. Tetrahedron Lett. 2000, 41, 2495.
doi: 10.1016/S0040-4039(00)00188-X |
|
|
(c) Boto, A.; Hernández, R.; Suárez, E. J. Org. Chem. 2000, 65, 4930.
doi: 10.1021/jo000356t |
|
| [55] |
Yamamoto, S.; Katagiri, M.; Maeno, H.; Hayaiahi, O. J. Biol. Chem. 1965, 240, 3408.
doi: 10.1016/S0021-9258(18)97232-7 |
| [56] |
Katagiri, M.; Maeno, H.; Yamamoto, S.; Hayaishi, O.; Kitano, T.; Oae, S. J. Biol. Chem. 1965, 240, 3414.
doi: 10.1016/S0021-9258(18)97233-9 |
| [57] |
Katagiri, M.; Takemori, S.; Suzuki, K.; Yasuda, H. J. Biol. Chem. 1966, 241, 5675.
doi: 10.1016/S0021-9258(18)96397-0 |
| [58] |
Uemura, T.; Kita, A.; Watanabe, Y.; Adachi, M.; Kuroki, R.; Morimoto, Y. Biochem. Biophys. Res. Commun. 2016, 469, 158.
doi: 10.1016/j.bbrc.2015.11.087 |
| [1] | 刘继宇, 李圣玉, 陈款, 朱茵, 张元. 三苯胺功能化有序介孔聚合物作为无金属光催化剂用于二硫化物合成[J]. 有机化学, 2024, 44(2): 605-612. |
| [2] | 刘杰, 韩峰, 李双艳, 陈天煜, 陈建辉, 徐清. 无过渡金属参与甲基杂环化合物与醇的选择性有氧烯基化反应[J]. 有机化学, 2024, 44(2): 573-583. |
| [3] | 梅青刚, 李清寒. 可见光促进C(3)(杂)芳硫基吲哚化合物的合成研究进展[J]. 有机化学, 2024, 44(2): 398-408. |
| [4] | 张勇, 田志高, 黄琳, 侯秋飞, 范红红, 汪万强. α-氰醇甲磺酸酯在合成α-氨基腈类化合物中的应用[J]. 有机化学, 2024, 44(2): 561-572. |
| [5] | 陶苏艳, 项紫欣, 白俊杰, 万潇, 万小兵. 亚硝酸叔丁酯参与的酰胺水解反应[J]. 有机化学, 2024, 44(2): 550-560. |
| [6] | 童红恩, 郭宏宇, 周荣. 可见光促进惰性碳-氢键对羰基的加成反应进展[J]. 有机化学, 2024, 44(1): 54-69. |
| [7] | 董江湖, 宣良明, 王池, 赵晨熙, 王海峰, 严琼姣, 汪伟, 陈芬儿. 无过渡金属或无光催化剂条件下可见光促进喹喔啉酮C(3)—H官能团化研究进展[J]. 有机化学, 2024, 44(1): 111-136. |
| [8] | 朱彦硕, 王红言, 舒朋华, 张克娜, 王琪琳. 烷氧自由基引发1,5-氢原子转移实现C(sp3)—H键官能团化的研究进展[J]. 有机化学, 2024, 44(1): 1-17. |
| [9] | 王化坤, 任晓龙, 宣宜宁. 卤盐催化的α,β-环氧羧酸酯与异氰酸酯[3+2]环加成反应研究[J]. 有机化学, 2024, 44(1): 251-258. |
| [10] | 金玉坤, 任保轶, 梁福顺. 可见光介导的三氟甲基的选择性C-F键断裂及其在偕二氟类化合物合成中的应用[J]. 有机化学, 2024, 44(1): 85-110. |
| [11] | 蒋宜欣, 唐伯孝, 毛海波, 陈雪霞, 俞洋杰, 全翠英, 徐昭阳, 石金慧, 刘益林. 水-聚乙二醇(PEG-200)中烯烃与碘代芳烃绿色可循环无负载偶联反应的研究[J]. 有机化学, 2023, 43(9): 3210-3215. |
| [12] | 鄢伯钰, 吴阶良, 邓金飞, 陈丹, 叶秀深, 姚秋丽. 光诱导醇的直接脱羟基衍生化研究进展[J]. 有机化学, 2023, 43(9): 3055-3066. |
| [13] | 高晓阳, 翟锐锐, 陈训, 王烁今. 碳酸亚乙烯酯参与C—H键活化反应的研究进展[J]. 有机化学, 2023, 43(9): 3119-3134. |
| [14] | 王灵娜, 刘晓庆, 林钢, 金泓颖, 焦民均, 刘雪粉, 罗书平. 光促进双(4-二苯甲酮)苯醚催化C(sp3)—H键活化构建C—S键[J]. 有机化学, 2023, 43(8): 2848-2854. |
| [15] | 赵瑜, 张凯, 白育斌, 张琰图, 史时辉. 无金属条件下可见光催化与溴盐协同促进烯烃的氢硅化反应研究[J]. 有机化学, 2023, 43(8): 2837-2847. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||