有机化学 ›› 2019, Vol. 39 ›› Issue (10): 2796-2801.DOI: 10.6023/cjoc201907038 上一篇 下一篇
研究论文
收稿日期:2019-07-26
修回日期:2019-08-22
发布日期:2019-09-05
通讯作者:
马献涛
E-mail:xiantaoma@126.com
基金资助:
Ma Xiantao*( ), Zhou Kunjie, Ren Mengjuan, Wang Mengyu, Yu Jing
), Zhou Kunjie, Ren Mengjuan, Wang Mengyu, Yu Jing
Received:2019-07-26
Revised:2019-08-22
Published:2019-09-05
Contact:
Ma Xiantao
E-mail:xiantaoma@126.com
Supported by:文章分享
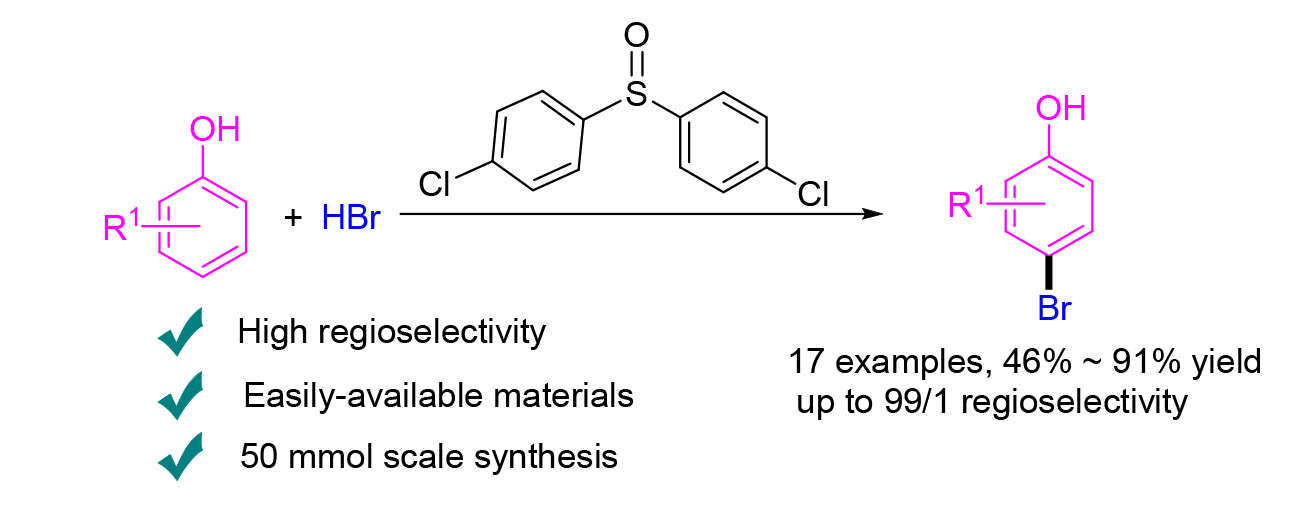
报道了苯酚与廉价易得的氢溴酸的区域选择性溴化反应. 研究发现使用含有较大取代基的亚砜取代广为使用的二甲亚砜作为氧化剂, 可以极大地提高反应的区域选择性, 以中等至优秀的收率、高达99/1的区域选择性得到预期的溴代苯酚产物. 该方法可以很容易放大到50 mmol级别, 并且通过萃取与重结晶分离技术即可得到预期的溴代苯酚产物.
马献涛, 周坤洁, 任梦娟, 王梦雨, 于静. 立体位阻效应导致的苯酚的区域选择性溴化[J]. 有机化学, 2019, 39(10): 2796-2801.
Ma Xiantao, Zhou Kunjie, Ren Mengjuan, Wang Mengyu, Yu Jing. Steric Hindrance Effect Leading to Regioselective Bromination of Phenols with HBr[J]. Chinese Journal of Organic Chemistry, 2019, 39(10): 2796-2801.
| Entry | R (2) | Solvent | 3ab/% | 3a/4ac |
|---|---|---|---|---|
| 1d | Me (2a) | DMSO | 25 | 61/39 |
| 2 | Me (2a) | DMSO | 55 | 69/31 |
| 3 | Me (2a) | MeCN | 80 | 89/11 |
| 4 | n-Bu (2b) | MeCN | 75 | 93/7 |
| 5 | Bn (2c) | MeCN | 82 | 98/2 |
| 6 | Ph (2d) | MeCN | 86 | 95/5 |
| 7 | 4-MeC6H4 (2e) | MeCN | 87 | 96/4 |
| 8 | 4-ClC6H4 (2f) | MeCN | 91 | 97/3 |
| 9 | 4-ClC6H4 (2f) | EtOAc | 84 | 94/6 |
| 10 | 4-ClC6H4 (2f) | DMF | 0 | — |
| 11 | 4-ClC6H4 (2f) | CHCl3 | 41 | 62/38 |
| Entry | R (2) | Solvent | 3ab/% | 3a/4ac |
|---|---|---|---|---|
| 1d | Me (2a) | DMSO | 25 | 61/39 |
| 2 | Me (2a) | DMSO | 55 | 69/31 |
| 3 | Me (2a) | MeCN | 80 | 89/11 |
| 4 | n-Bu (2b) | MeCN | 75 | 93/7 |
| 5 | Bn (2c) | MeCN | 82 | 98/2 |
| 6 | Ph (2d) | MeCN | 86 | 95/5 |
| 7 | 4-MeC6H4 (2e) | MeCN | 87 | 96/4 |
| 8 | 4-ClC6H4 (2f) | MeCN | 91 | 97/3 |
| 9 | 4-ClC6H4 (2f) | EtOAc | 84 | 94/6 |
| 10 | 4-ClC6H4 (2f) | DMF | 0 | — |
| 11 | 4-ClC6H4 (2f) | CHCl3 | 41 | 62/38 |
| [1] | Fusetani, N.; Matsunaga, S. Chem. Rev. 1993, 93, 1793. |
| (b) Segraves, E. N.; Shah, R. R.; Segraves, N. L.; Johnson, T. A.; Whitman, S.; Sui, J. K.; Kenyon, V. A.; Cichewicz, R. H.; Crews, P.; Holman, T.R. J. Med. Chem. 2004, 47, 4060. | |
| (c) Akai, S.; Kakiguchi, K.; Nakamura, Y.; Kuriwaki, I.; Dohi, T.; Harada, S.; Kubo, O.; Morita, N.; Kita, Y. Angew. Chem., Int. Ed. 2007, 46, 7458. | |
| (d) Qian, S.; Ma, Y.; Gao, S.; Luo, J. Chin. J. Org. Chem. 2018, 38, 1930.(in Chinese). | |
| ( 钱少平, 马尧睿, 高姗姗, 骆钧飞, 有机化学, 2018, 38, 1930.) | |
| (e) Zhou, P.; Hou, A.; Wang, Y. Chin. J. Org. Chem. 2018, 38, 156(in Chinese). | |
| ( 周鹏飞, 侯爱君, 王洋, 有机化学, 2018, 38, 156.) | |
| [2] | For reviews:see: (a) Smith, K.; El-HitiI, G.A. Curr. Org. Synth. 2004, 1, 253. |
| (b) Saikia, A. J.; Borah, P.P. Chem. Rev. 2016, 116, 6837. | |
| [3] | For a review see:(a) Luo, J.; Xu, X.; Zhao, Y.; Liang, H. Chin. J. Org. Chem. 2017, 37, 2873 (in Chinese). |
| ( 骆钧飞, 徐星, 赵延超, 梁洪泽, 有机化学, 2017, 37, 2873 ) | |
| For selected recent reports, see: (b) Okada, Y.; Yokozawa, M.; Akiba, M.; Oishi, K.; O-kawa, K.; Akeboshi, T.; Kawamura, Y.; Inokuma, S.; Nakamura, Y.; Nishimura, J. Org. Biomol. Chem. 2003, 1, 2506. | |
| (c) Bovonsombat, P.; Ali, R.; Khan, C.; Leykajarakul, J.; Pla-on, K.; Aphimanchindakul, S.; Pungcharoenpong, N.; Timsuea, N.; Arunrat, A.; Punpongjareorn, N. Tetrahedron. 2010, 66, 6928. | |
| (d) Racys, D. T.; Warrilow, C. E.; Pimlott, S. L.; Sutherland, A. Org. Lett. 2015, 17, 4782. | |
| (e) Nishimura, J.; Tang, R.-J.; Milcent, T.; Crousse, B. J. Org. Chem. 2018, 83, 930. | |
| [4] | For a review, see: Vaillancourt, F. H.; Yeh, E.; Vosburg, D. A.; Garneau-Tsodikova, S.; Walsh, C.T. Chem. Rev. 2006, 106, 3364. |
| [5] | For reviews, see: (a) Podgoršek, A.; Zupan, M.; Iskra, J. Angew. Chem., Int. Ed. 2009, 48, 8424. |
| (b) Zhang, G.; Wang, Y.; Ding, C.; Liu, R.; Liang, X. Chin. J. Org. Chem. 2011, 31, 804 (in Chinese). | |
| For selected recent reports, see: (c) Werf, A.; Selander, N. Org. Lett. 2015, 17, 6210. | |
| For selected recent reports, see: (c) Werf, A.; Selander, N. Org. Lett. 2015, 17, 6210. | |
| (d) Satkar, Y.; Ramadoss, V.; Nahide, P. D.; García-Medina, E.; Juárez-Ornelas, K. A.; Alonso-Castro, A. J.; Chávez-Rivera, R.; Jiménez-Halla, J. O. C.; Solorio-Alvarado, C.R. RSC Adv. 2018, 8, 17806. | |
| (e) Sorabad, G. S.; Maddani, M.R. New J. Chem. 2019, 43, 6563. | |
| (f) Walter, C.; Fallows, N.; Kesharwani, T. ACS Omega, 2019, 4, 6538. | |
| (g) Semwal, R.; Ravi, C.; Kumar, R.; Meena, R.; Adimurthy, S. J. Org. Chem. 2019, 84, 792. | |
| (h) Satkar, Y.; Yera-Ledesma, L. F.; Mali, N.; Patil, D.; Navarro-Santos, P.; Segura-Quezada, L. A.; Ramírez-Morales, P. I.; Solorio-Alvarado, C.R. J. Org. Chem. 2019, 84, 4149. | |
| (i) Segura-Quezada, A.; Satkar, Y.; Patil, D.; Mali, N.; Wrobel, K.; González, G.; Zárraga, R.; Ortiz-Alvarado, R.; Solorio-Alvarado, C.R. Tetrahedron Lett. 2019, 60, 1551. | |
| [6] | For selected recent reports, see: (a) Mal, K.; Sharma, A.; Maulik, P. R.; Das, I. . Chem.-Eur. J 2013, 20, 662. |
| (b) Liu, C.; Dai, R.; Yao, G.; Deng, Y.J. Chem. Res. 2014, 38, 593. | |
| (c) Song, S.; Li, X.; Sun, X.; Yuan, Y.; Jiao, N. Green Chem. 2015, 17, 3285. | |
| (d) Karki, M.; Magolan, J. J. Org. Chem. 2015, 80, 3701. | |
| (e) Mal, K.; Kaur, A.; Haque, F.; Das, I. J. Org. Chem. 2015, 80, 640. | |
| (f) Sorabad, G. S.; Maddani, M.R. New J. Chem. 2019, 43, 6563. | |
| [7] | (a) Pandit, P. K.; Gayen, S.; Khamarui, S.; Chatterjee, N.; Maiti, D.K. Chem. Commun. 2011, 47, 6933. |
| (b) Iskra, J.; Murphree, S.S. Tetrahedron Lett. 2017, 58, 645. | |
| (c) Xin, H.; Yang, S.; An, B.; An, Z. RSC Adv. 2017, 7, 13467. | |
| (d) Tomizuka, A.; Moriyama, K. Adv. Synth. Catal. 2019, 361, 1447. | |
| (e) Xin, H.; Hu, L.; Yu, J.; Sun, W.; An, Z. Catal. Commun. 2017, 93, 1. | |
| (f) Kajita, H.; Togni, A. ChemistrySelect. 2017, 2, 1117. | |
| (g) Cao, L.; Liu, B.; Liu, W.; Yao, G.; Cheng, Q. Chin. J. Org. Chem. 2011, 31, 2178.(in Chinese). | |
| ( 曹志凌, 刘冰, 刘玮炜, 姚国伟, 程青芳, 有机化学, 2011, 31, 2178.) | |
| [8] | Song, S.; Sun, X.; Li, X.; Yuan, Y.; Jiao, N. Org. . Lett 2015, 17, 2886. |
| [9] |
For reviews, see: (a) Huang, Z.; Lumb, J.-P. ACS Catal. 2019, 9, 521.
doi: 10.1021/acscatal.8b04098 |
|
(b) Chen, Z.; Wang, B.; Zhang, J.; Yu, W.; Liu, Z.; Zhang, Y. Org. Chem. Front. 2015, 2, 1107.
doi: 10.1021/acscatal.8b04098 |
|
|
(c) Yanagi, T.; Nogi, K.; Yorimitsu, H. Tetrahedron Lett. 2018, 59, 2951.
doi: 10.1021/acscatal.8b04098 |
|
| [10] | (a) Ma, X.-T.; Tian, S.-K. Adv. Synth. Catal. 2013, 355, 337. |
| (b) Ma, X.; Yu, J.; Jiang, M.; Wang, M.; Tang, L.; Wei, M.; Zhou, Q. Eur. J. Org. Chem. 2019,4593. | |
| [11] | Chauhan and coworkers reported a regioselective bromination of phenol with HBr at room temperature. The target 4-bromophenol could be obtained in 89% yield, but no experimental details could be found in the literature, see: Srivastava, S. K.; Chauhan P. M. S.; Bhaduri, A. P. Chem. Commun.1996, 2679 for details. We attempted for some times, but the target 3a was obtained only in low yield by using DMSO as a solvent at room temperature. |
| [12] | Our experimental results are consistent with Jiao’s observation, ie the use of stoichiometric DMSO as the oxidant instead of as the solvent can greatly improve the reaction efficiency and selectivity, see Ref. [8]. |
| [13] | Kakarla, R.; Dulina, R. G.; Hatzenbuhler, N. T.; Hui, Y. W.; Sofia, M.J. J. Org. Chem. 1996, 61, 8347. |
| [14] |
Choudhury, L. H.; Parvin, T.; Khan, A. T. Tetrahedron 2009, 65, 9513.
doi: 10.1016/j.tet.2009.07.052 |
| [15] | Ghiaci, M.; Sedaghat, M. E.; Ranjbari, S.; Gil, A. Appl. Catal. A: Gen. 2010, 384, 18. |
| [16] |
Mabic, S.; Lepoittevin, J.-P. Tetrahedron Lett. 1995, 36, 1705.
doi: 10.1016/0040-4039(95)00050-M |
| [17] |
Lou, S.-J.; Chen, Q.; Wang, Y.-F.; Xu, D.-Q.; Du, X.-H.; He, J.-Q.; Mao, Y.-J.; Xu, Z.-Y. ACS Catal. 2015, 5, 2846.
doi: 10.1021/acscatal.5b00306 |
| [18] |
Xiong, X.; Yeung, Y.-Y. ACS Catal. 2018, 8, 4033.
doi: 10.1021/acscatal.8b00327 |
| [19] | Carrigan, M. D.; Sarapa, D.; Smith, R. C.; Wieland, L. C.; Mohan, R.S. J. Org. Chem. 2002, 67, 1027. |
| [20] | Yang, Y.; Lin, Y.; Rao, Y. Org. Lett. 2012, 14, 2874. |
| [21] | Diemer, V.; Begaud, M.; Leroux, F. R.; Colobert, F . Eur. J. Org. Chem. 2011,341. |
| [22] |
Kajita, H.; Togni, A. ChemistrySelect 2017, 2, 1117.
doi: 10.1002/slct.201700024 |
| [23] | Kerr, D. J.; Willis, A. C.; Flynn, B.L. Org. Lett. 2004, 6, 457. |
| [24] | Liu, Y.; Kim, J.; Seo, H.; Park, S.; Chae, J. Adv. Synth. Catal. 2015, 357, 2205. |
| [1] | 张素珍, 张文文, 杨慧, 顾庆, 游书力. 铑催化2-烯基苯酚与炔烃的对映体选择性螺环化反应[J]. 有机化学, 2023, 43(8): 2926-2933. |
| [2] | 田钰, 张娟, 高文超, 常宏宏. 二甲亚砜作为甲基化试剂在有机合成中的应用[J]. 有机化学, 2023, 43(7): 2391-2406. |
| [3] | 户晓兢, 郭斐翔, 朱润青, 周柄棋, 张涛, 房立真. 对烷氧基酚的合成及其去芳构化后的合成应用[J]. 有机化学, 2023, 43(6): 2239-2244. |
| [4] | 李春生, 连晓琪, 陈莲芬. 铜催化亚砜叶立德与邻苯二胺[4+2]环加成反应[J]. 有机化学, 2023, 43(4): 1492-1498. |
| [5] | 肖朵朵, 张建涛, 周鹏, 刘卫兵. 无金属条件下芳基酮与二甲亚砜的α-C(sp3)—H亚甲基化反应合成γ-酮亚砜[J]. 有机化学, 2023, 43(11): 3900-3906. |
| [6] | 张建涛, 张聪, 郑梓栋, 周鹏, 刘卫兵. 亚砜叶立德参与构建五/六元氮杂环的反应研究进展[J]. 有机化学, 2022, 42(9): 2745-2759. |
| [7] | 李文娟, 张睿, 蔡志华, 韩小强, 何林, 代斌. 苯炔[3+2]环加成反应构建三氟甲基取代的苯并环状亚砜亚胺衍生物及其杀棉蚜活性研究[J]. 有机化学, 2022, 42(9): 2832-2839. |
| [8] | 曹廷舒, 魏向阳, 罗敏, 汪逸飞, 潘子俊, 徐程, 殷国栋. 醋酸碘苯促进的脱氢氧化反应合成2-硫芳(烷)基苯酚及10H-吩噻嗪[J]. 有机化学, 2022, 42(7): 2079-2088. |
| [9] | 孙鑫浩, 段学伦, 宋汪泽, 姜文凤. 布朗斯特酸催化合成亚砜亚胺基二氢吡喃酮类衍生物[J]. 有机化学, 2022, 42(2): 487-497. |
| [10] | 范铃洁, 周涛, 杨旭, 江梦雪, 胡信全, 史炳锋. 钯催化的不对称碳氢键烯基化动力学拆分2-(芳基亚磺酰基)吡啶[J]. 有机化学, 2022, 42(10): 3405-3418. |
| [11] | 张涛, 李尚达, 周春林, 王新超, 张孟, 高泽众, 李纲. 以芳基碘为碘化试剂的苯酚衍生物的位点选择性C—H键碘化反应[J]. 有机化学, 2021, 41(9): 3511-3520. |
| [12] | 朱海梦, 王超, 宗利利. 亚砜化合物的生物活性研究和不对称合成进展[J]. 有机化学, 2021, 41(9): 3431-3447. |
| [13] | 舒赛, 黄志斌, 陈宇杰, 杨闪, 蒋雅琦琪, 张静宇, 赵应声. 铑催化的吲哚与亚砜型叶立德的[4+2]环化反应构建二氢嘧啶并吲哚酮衍生物[J]. 有机化学, 2021, 41(8): 3171-3179. |
| [14] | 王兴越, 许昌林, 关宏宇, 林觅, 黄鹏. 无外加溶剂条件下二甲氨基硫代甲酰氯对亚砜的脱氧还原[J]. 有机化学, 2021, 41(8): 3330-3334. |
| [15] | 李倩, 杨丽, 刘伟, 王天昀, 朱月杰, 杜正银. 乙酸铵催化的酚与多聚甲醛的甲酰化反应研究[J]. 有机化学, 2021, 41(5): 2038-2044. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||