有机化学 ›› 2023, Vol. 43 ›› Issue (3): 873-891.DOI: 10.6023/cjoc202301004 上一篇 下一篇
所属专题: 中国女科学家专辑
综述与进展
收稿日期:2023-01-05
修回日期:2023-02-17
发布日期:2023-02-22
通讯作者:
汪君
Received:2023-01-05
Revised:2023-02-17
Published:2023-02-22
Contact:
Jun Wang
文章分享

硫代黄烷酮类化合物是黄酮类化合物的硫对应物, 在医药、材料科学和有机合成等领域有着广泛的应用. 因此, 发展高效的合成方法以获取结构多样的硫代黄烷酮类化合物具有重要的研究意义. 将按照硫代黄烷酮类化合物的分类, 对其合成方法和反应机理的关键步骤进行阐述, 并展望该研究领域的未来发展前景.
蒙玲, 汪君. 硫代黄烷酮类衍生物的合成研究进展[J]. 有机化学, 2023, 43(3): 873-891.
Ling Meng, Jun Wang. Research Progress on Synthesis of Thioflavonoids[J]. Chinese Journal of Organic Chemistry, 2023, 43(3): 873-891.
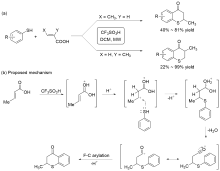
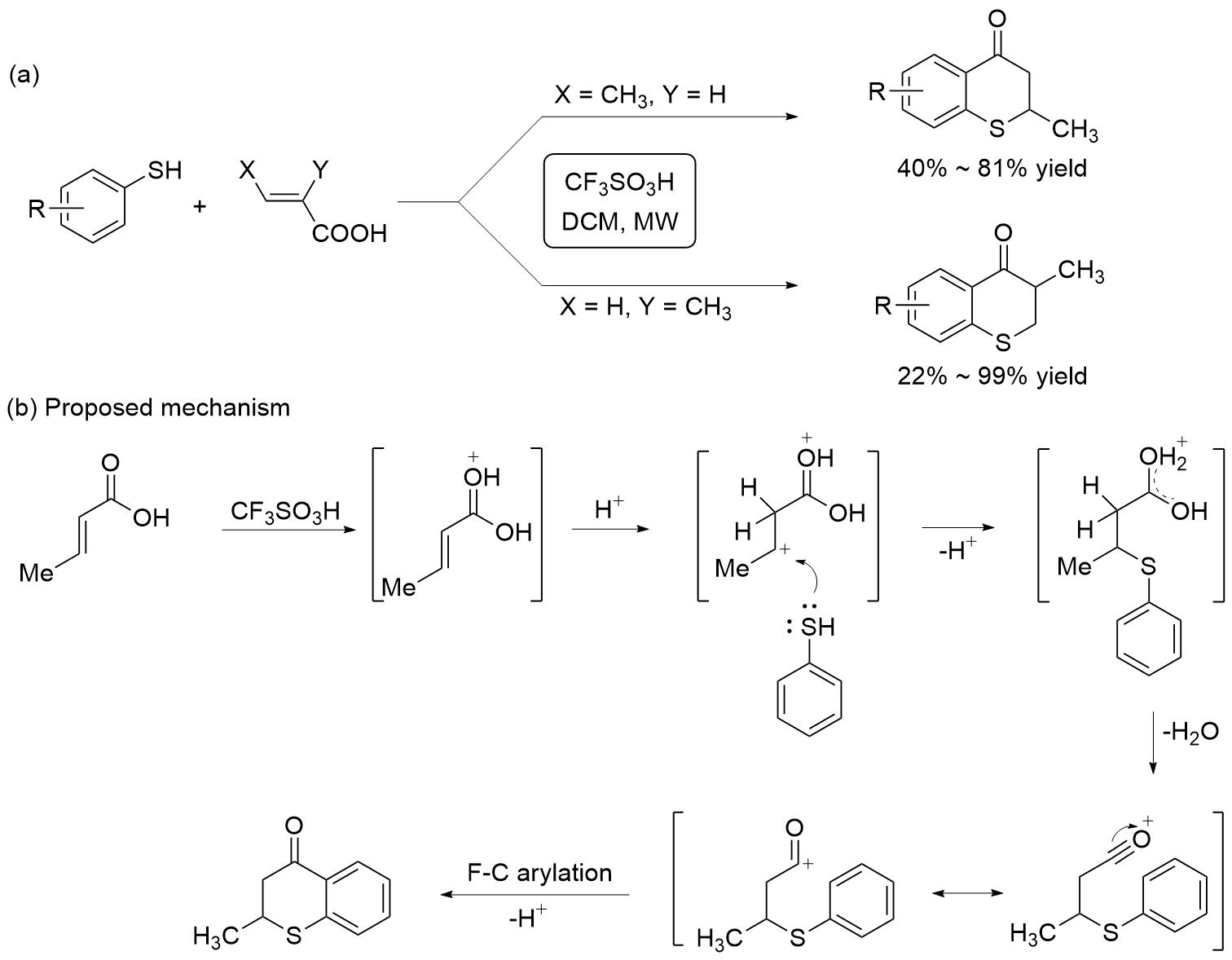
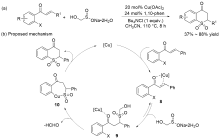
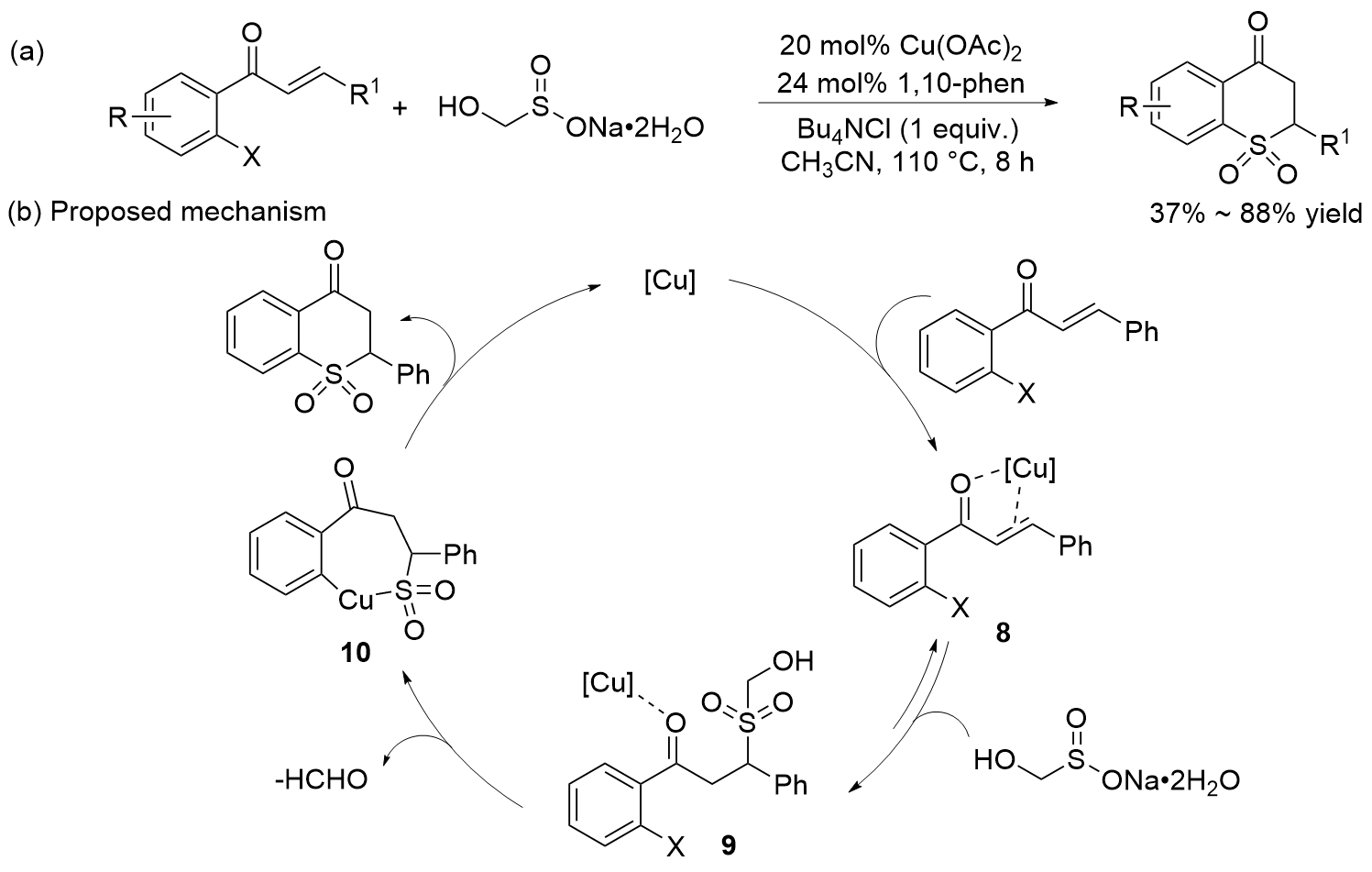

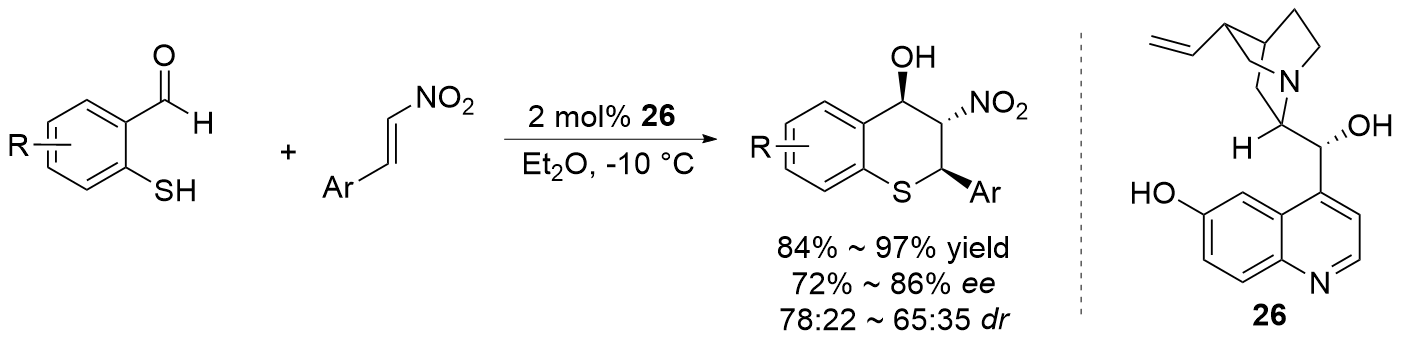


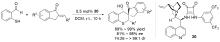
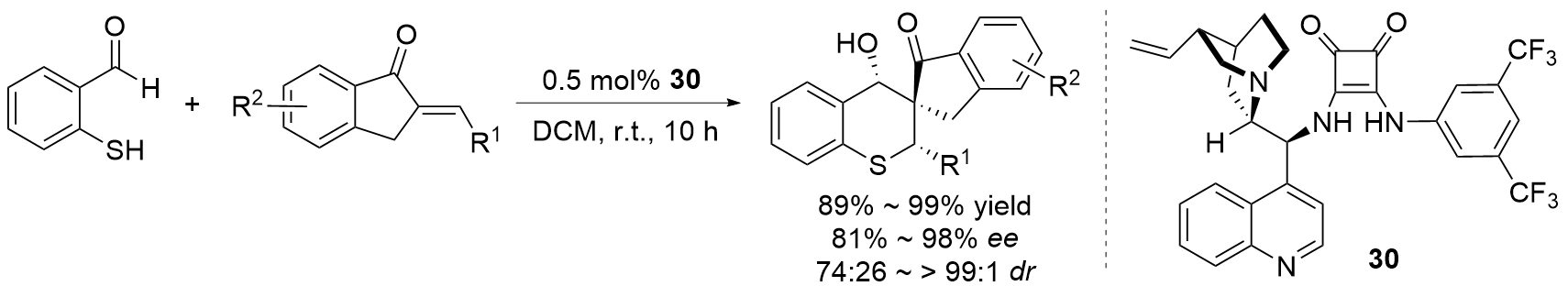

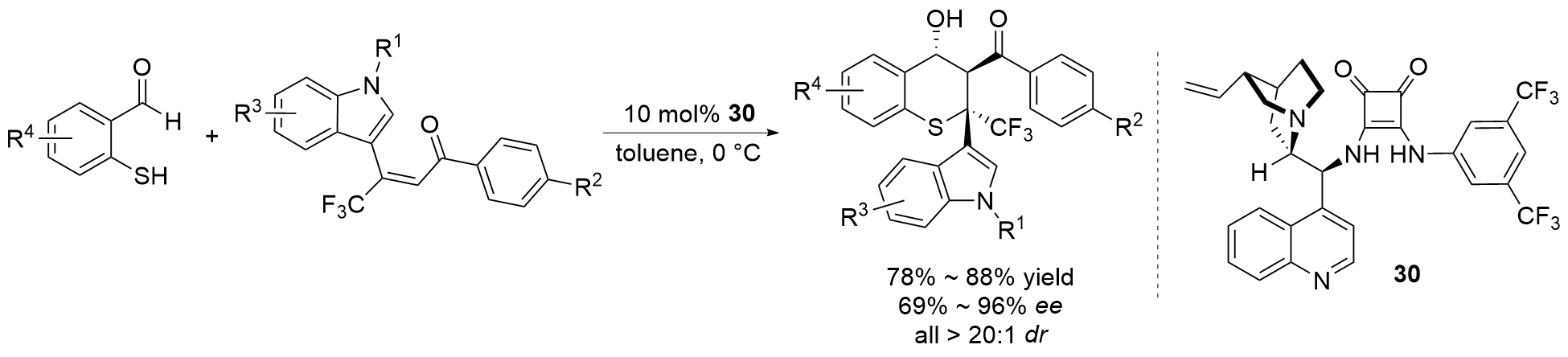
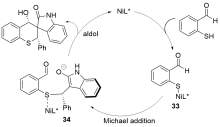
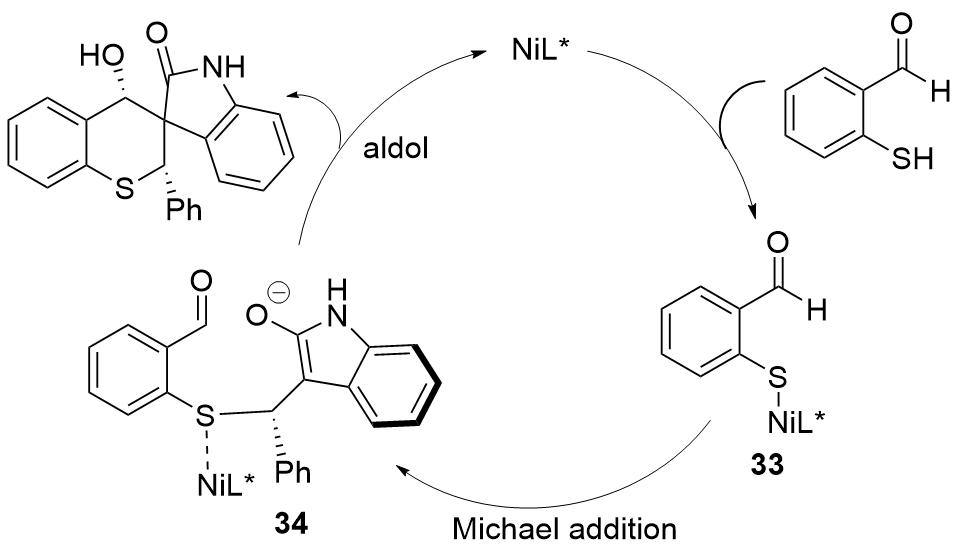
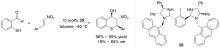
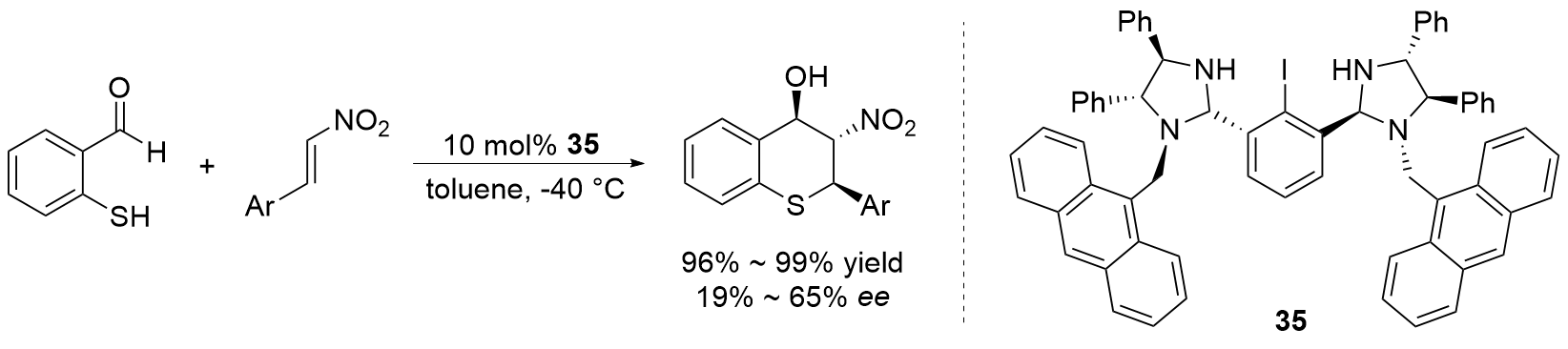

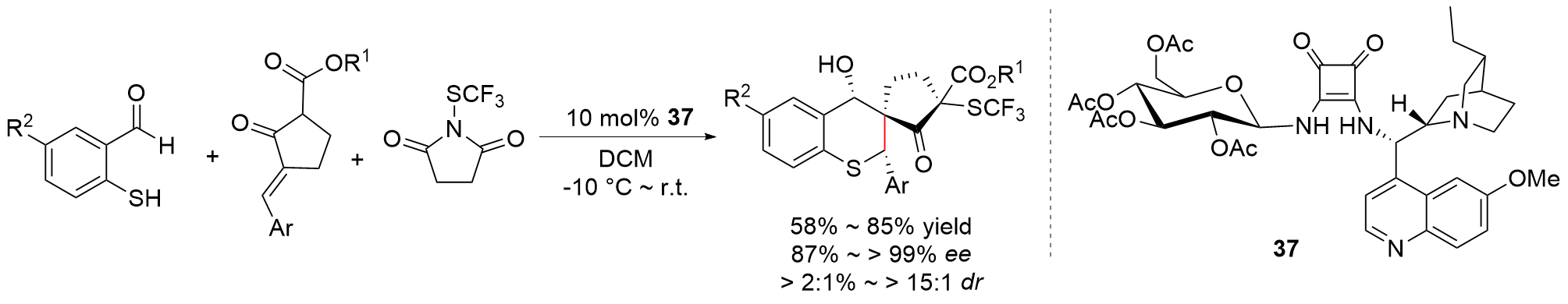
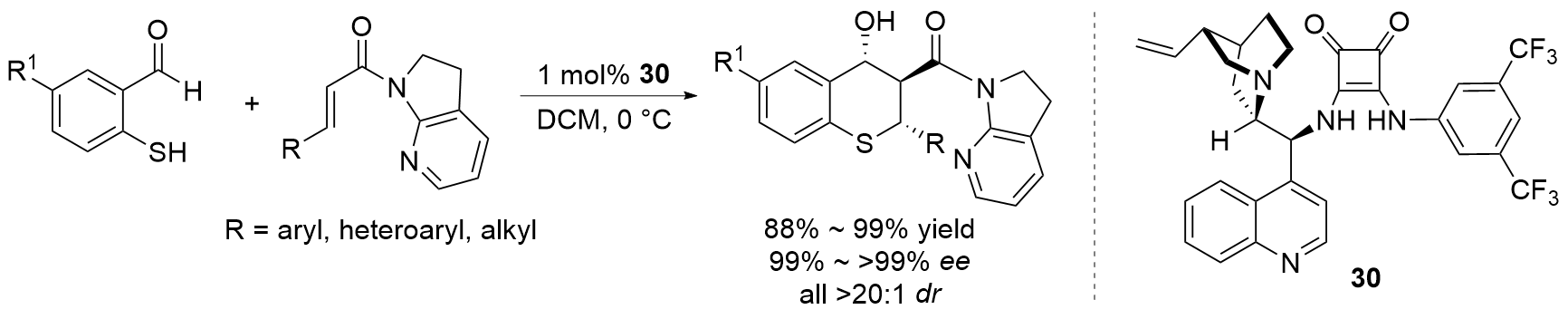
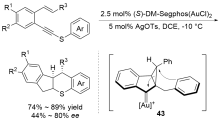
| [27] |
Paladhi, S.; Liu, Y.; Kumar, B. S.; Jung, M.-J.; Park, S. Y.; Yan, H.; Song, C. E. Org. Lett. 2017, 19, 3279.
doi: 10.1021/acs.orglett.7b01429 |
| [28] |
Li, Y.-P.; Li, Z.-Q.; Zhou, B.; Li, M.-L.; Xue, X.-S.; Zhu, S.-F.; Zhou, Q.-L. ACS Catal. 2019, 9, 6522.
doi: 10.1021/acscatal.9b01502 |
| [29] |
Chen, C.-Y.; Yang, C.-H.; Hu, W.-P.; Vandavasi, J. K.; Chunga, M.-I.; Wang, J.-J. RSC Adv. 2013, 3, 2710.
doi: 10.1039/c2ra22799a |
| [30] |
Muthupandi, P.; Sundaravelu, N.; Sekar, G. J. Org. Chem. 2017, 82, 1936.
doi: 10.1021/acs.joc.6b02740 pmid: 28125776 |
| [31] |
Le, T. T. H.; Youhei, C.; Le, Q. H.; Nguyen, T. B.; Mac, D. H. Org. Biomol. Chem. 2019, 17, 6355.
doi: 10.1039/C9OB01060B |
| [32] |
Velasco, N.; Suárez, A.; Martínez-Lara, F.; Fernández-Rodríguez, M. Á.; Sanz, R.; Suárez-Pantiga, S. J. Org. Chem. 2021, 86, 7078.
doi: 10.1021/acs.joc.1c00333 |
| [33] |
Wang, W.; Li, H.; Wang, J.; Zu, L. J. Am. Chem. Soc. 2006, 128, 10354.
pmid: 16895386 |
| [34] |
Rios, R.; Sundén, H.; Ibrahem, I.; Zhao, G.-L.; Eriksson, L.; Córdova, A. Tetrahedron Lett. 2006, 47, 8547.
doi: 10.1016/j.tetlet.2006.09.135 |
| [35] |
Zu, L.; Wang, J.; Li, H.; Xie, H.; Jiang, W.; Wang, W. J. Am. Chem. Soc. 2007, 129, 1036.
doi: 10.1021/ja067781+ |
| [36] |
Zu, L.; Xie, H.; Li, H.; Wang, J.; Jiang, W.; Wang, W. Adv. Synth. Catal. 2007, 349, 1882.
doi: 10.1002/(ISSN)1615-4169 |
| [37] |
Zhao, G.-L.; Vesely, J.; Rios, R.; Ibrahem, I.; Sundén, H.; Córdova, A. Adv. Synth. Catal. 2008, 350, 237.
doi: 10.1002/(ISSN)1615-4169 |
| [38] |
Dodda, R.; Goldman, J. J.; Mandal, T.; Zhao, C.-G.; Broker, G. A.; Tiekink, E. R. T. Adv. Synth. Catal. 2008, 350, 537.
doi: 10.1002/adsc.v350:4 |
| [39] |
Dong, X.-Q.; Fang, X.; Tao, H.-Y.; Zhou, X.; Wang, C.-J. Chem. Commun. 2012, 48, 7238.
doi: 10.1039/c2cc31891a |
| [40] |
Choudhurya, A. R.; Mukherjee, S. Adv. Synth. Catal. 2013, 355, 1989.
doi: 10.1002/adsc.v355.10 |
| [41] |
Arai, T.; Yamamoto, Y. Org. Lett. 2014, 16, 1700.
doi: 10.1021/ol500361w |
| [42] |
Zhao, B.-L.; Du, D.-M. Asian J. Org. Chem. 2015, 4, 778.
doi: 10.1002/ajoc.v4.8 |
| [43] |
Zhu, Y.; Dong, Z.; Cheng, X.; Zhong, X.; Liu, X.; Lin, L.; Shen, Z.; Yang, P.; Li, Y.; Wang, H.; Yan, W.; Wang, K.; Wang, R. Org. Lett. 2016, 18, 3546.
doi: 10.1021/acs.orglett.6b01498 |
| [44] |
Ahlemeyer, N. A.; Birman, V. B. Org. Lett. 2016, 18, 3454.
doi: 10.1021/acs.orglett.6b01639 pmid: 27384085 |
| [45] |
Arai, T.; Miyazaki, T.; Ogawa, H.; Masu, H. Org. Lett. 2016, 18, 5824.
doi: 10.1021/acs.orglett.6b02783 |
| [46] |
Arai, T.; Suzuki, T.; Inoue, T.; Kuwano, S. Synlett 2017, 28, 122.
doi: 10.1055/s-0036-1588614 |
| [47] |
Simlandy, A. K.; Mukherjee, S. J. Org. Chem. 2017, 82, 4851.
doi: 10.1021/acs.joc.7b00579 pmid: 28388053 |
| [48] |
Zhao, B.-L.; Du, D.-M. Org. Lett. 2017, 19, 1036.
doi: 10.1021/acs.orglett.6b03846 |
| [49] |
Zhang, Y.-P.; You, Y.; Zhao, J.-Q.; Zhang, X.-M.; Xu, X.-Y.; Yuan, W.-C. J. Org. Chem. 2019, 84, 7984.
doi: 10.1021/acs.joc.9b00837 |
| [50] |
Wang, M.-M.; Jeon, S.; Waser, J. Org. Lett. 2020, 22, 9123.
doi: 10.1021/acs.orglett.0c03528 |
| [51] |
Sundaravelu, N.; Nandy, A.; Sekar, G. Org. Lett. 2021, 23, 3115.
doi: 10.1021/acs.orglett.1c00806 pmid: 33826352 |
| [52] |
Ji, K.; Lu, K.; Huang, J.; Li, Z.-H.; Ke, H.; Chen, Z.-M. Org. Lett. 2021, 23, 8028.
doi: 10.1021/acs.orglett.1c03043 |
| [53] |
Ji, K.; Lu, K.; Huang, J.; Li, Z.-H.; Ding, T.-M.; Chen, Z.-M. Chem. Commun. 2021, 57, 12639.
doi: 10.1039/D1CC05383C |
| [54] |
Zaitseva, E. R.; Sokolov, A. I.; Mikhaylov, A. A.; Baleeva, N. S.; Baranov, M. S.; Smirnov, A. Y. Chem. Heterocycl. Compd. 2022, 58, 477.
doi: 10.1007/s10593-022-03115-5 |
| [55] |
Fukamizu, K.; Miyake, Y.; Nishibayashi, Y. J. Am. Chem. Soc. 2008, 130, 10498.
doi: 10.1021/ja8038745 pmid: 18642916 |
| [56] |
Wang, X.-F.; An, J.; Zhang, X.-X.; Tan, F.; Chen, J.-R.; Xiao, W.-J. Org. Lett. 2011, 13, 808.
doi: 10.1021/ol1031188 |
| [57] |
Lu, H.; Zhang, J.-L.; Liu, J.-Y.; Li, H.-Y.; Xu, P.-F. ACS Catal. 2017, 7, 7797.
doi: 10.1021/acscatal.7b02651 |
| [58] |
Ahlemeyer, N. A.; Streff, E. V.; Muthupandi, P.; Birman, V. B. Org. Lett. 2017, 19, 6486.
doi: 10.1021/acs.orglett.7b03044 pmid: 29200308 |
| [59] |
Mo, Y.; Zhang, X.; Yao, Y.; Duan, C.; Ye, L.; Shi, Z.; Zhao, Z.; Li, X. J. Org. Chem. 2021, 86, 4448.
doi: 10.1021/acs.joc.0c02878 |
| [60] |
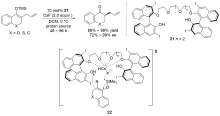
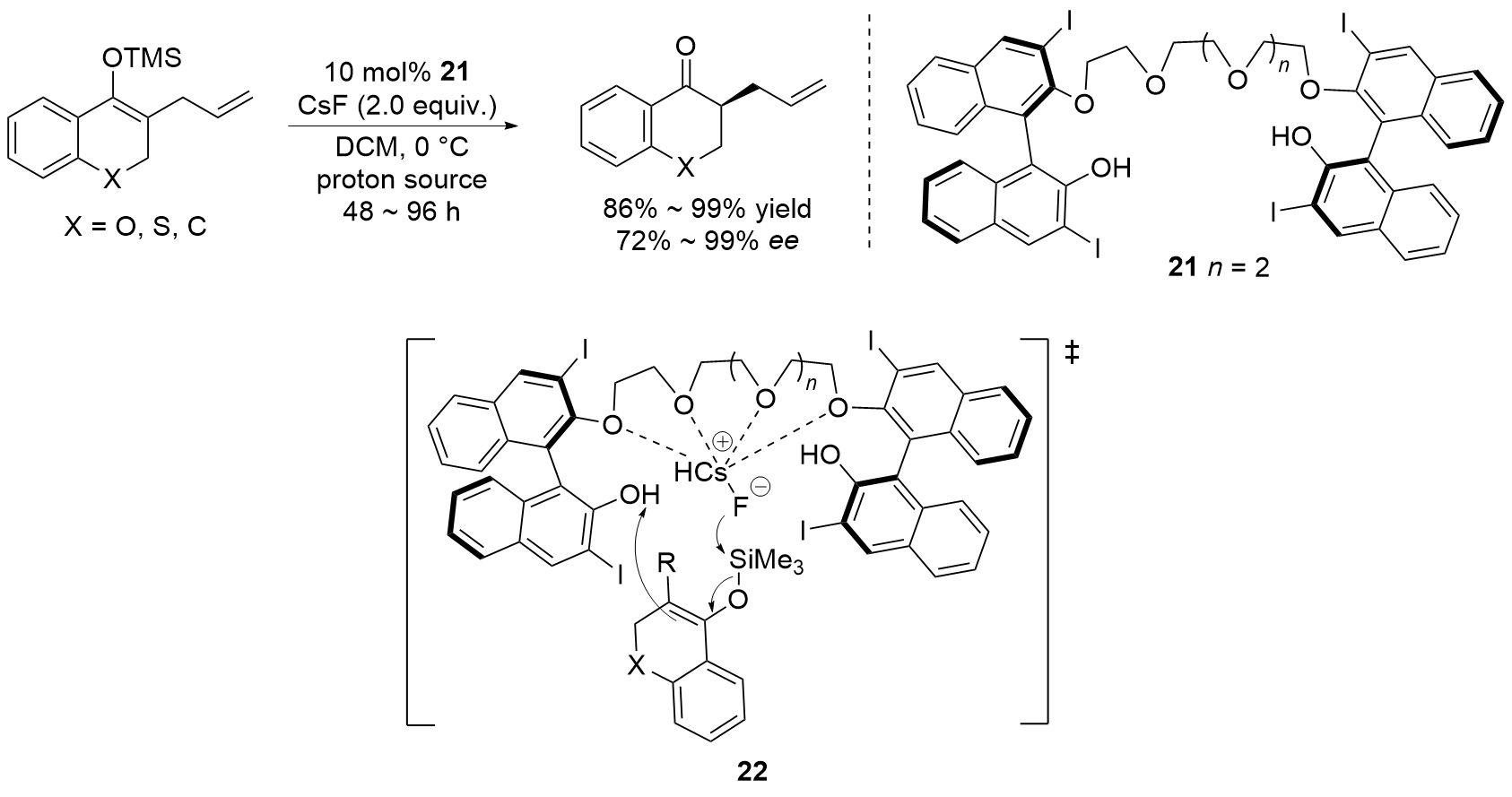
(a) Gu, X.; Meng, L.; Li, M.; Wang, J. Org. Chem. Front. 2021, 8, 1563.
doi: 10.1039/D1QO00030F |
| [1] |
(a) Eds.: Andersen, Ø. M.; Markham, K. R. Flavonoids: Chemistry, Biochemistry and Applications, Taylor & Francis, London, 2006.
|
|
(b) Yan, X.; Liu, H.-Q.; Zou, Y.-Q.; Ren, Z.-H. Chin. J. Org. Chem. 2008, 28, 1534. (in Chinese)
|
|
|
(延玺, 刘会青, 邹永青, 任占华, 有机化学, 2008, 28, 1534.)
|
|
|
(c) Shao, T.; Li, X.; Qi, C.; Chen, G.; Song, X.; Han, C.; Zheng, C. Chin. J. Org. Chem. 2018, 38, 710. (in Chinese)
doi: 10.6023/cjoc201709008 |
|
|
(邵泰明, 李小宝, 祁翠翠, 陈光英, 宋小平, 韩长日, 郑彩娟, 有机化学, 2018, 38, 710.)
doi: 10.6023/cjoc201709008 |
|
|
(d) Yang, Q.; Wang, Z.; Hor, C. H. H.; Xiao, H.; Bian, Z.; Wang, J. Sci. Adv. 2022, 8, DOI: 10.1126/sciadv.abm9603.
doi: 10.1126/sciadv.abm9603 |
|
| [2] |
(a) Brown, M. J.; Carter, P. S.; Fenwick, A. E.; Fosberry, A. P.; Hamprecht, D. W.; Hibbs, M. J.; Jarvest, R. L.; Mensah, L.; Milner, P. H.; O’Hanlon, P. J.; Pope, A. J.; Richardson, C. M.; West, A.; Witty, D. R. Bioorg. Med. Chem. Lett. 2002, 12, 3171.
doi: 10.1016/S0960-894X(02)00604-2 pmid: 29626799 |
|
(b) Zimmer, L.; Fournet, G.; Joseph, B.; Guillaumet, G.; Le Bars, D. Nucl. Med. Biol. 2003, 30, 541.
pmid: 29626799 |
|
|
(c) Kanbe, Y.; Kim, M. H.; Nishimoto, M.; Ohtake, Y.; Tsunenari, T.; Taniguchi, K.; Ohizumi, I.; Kaiho, S.; Nabuchi, Y.; Kawata, S.; Morikawa, K.; Jo, J. C.; Kwon, H. A.; Lim, H. S.; Kim, H. Y. Bioorg. Med. Chem. Lett. 2006, 16, 4090.
doi: 10.1016/j.bmcl.2006.04.090 pmid: 29626799 |
|
|
(d) Dalla Via, L.; Magno, S. M.; Gia, O.; Marini, A. M.; Da Settimo, F.; Salerno, S.; La Motta, C.; Simorini, F.; Taliani, S.; Lavecchia, A.; Di Giovanni, C.; Brancato, G.; Barone, V.; Novellino, E. J. Med. Chem. 2009, 52, 5429.
doi: 10.1021/jm900627v pmid: 29626799 |
|
|
(e) Han, X.; Zhong, Y.; Li, S.; Liang, G.; Zhou, G.; Wang, X.; Chen, B.; Song, Y. L. Chem. Pharm. Bull. 2016, 64, 1411.
doi: 10.1248/cpb.c16-00366 pmid: 29626799 |
|
|
(f) Urbatzka, R.; Freitas, S.; Palmeira, A.; Almeida, T.; Moreira, J.; Azevedo, C.; Afonso, C.; Correia-da-Silva, M.; Sousa, E.; Pinto, M.; Vasconcelos, V. Eur. J. Med. Chem. 2018, 151, 272.
doi: S0223-5234(18)30279-4 pmid: 29626799 |
|
| [3] |
(a) Nussbaumer, P.; Lehr, P.; Billich, A. J. Med. Chem. 2002, 45, 4310.
pmid: 12213072 |
|
(b) Horvath, A.; Nussbaumer, P.; Wolff, B.; Billich, A. J. Med. Chem. 2004, 47, 4268.
doi: 10.1021/jm0407916 pmid: 12213072 |
|
|
(c) Kataoka, T.; Watanabe, S.; Mori, E.; Kadomoto, R.; Tanimura, S.; Kohno, M. Bioorg. Med. Chem. 2004, 12, 2397.
doi: 10.1016/j.bmc.2004.02.002 pmid: 12213072 |
|
| [4] |
(a) Kitani, S.; Sugawara, K.; Tsutsumi, K.; Morimoto, T.; Kakiuchi, K. Chem. Commun. 2008, 2103.
pmid: 30023661 |
|
(b) Hikage, S.; Nishiyama, Y.; Sasaki, Y.; Tanimoto, H.; Morimoto, T.; Kakiuchi, K. ACS Omega 2017, 2, 2300.
doi: 10.1021/acsomega.7b00250 pmid: 30023661 |
|
| [5] |
(a) Quaglia, W.; Giannella, M.; Piergentili, A.; Pigini, M.; Brasili, L.; Di Toro, R.; Rossetti, L.; Spampinato, S.; Melchiorre, C. J. Med. Chem. 1998, 41, 1557.
pmid: 9572880 |
| [60] |
(b) Yang. Q.; Li, S.; Wang, J. ChemCatChem 2020, 12, 3202.
doi: 10.1002/cctc.v12.12 |
| [61] |
Virumbrales, C.; El-Remaily, M. A. E. A. A. A.; Suárez-Pantiga, S.; Fernández-Rodríguez, M. A.; Rodríguez, F.; Sanz, R. Org. Lett. 2022, 24, 8077.
doi: 10.1021/acs.orglett.2c03411 |
| [5] |
(b) Liu, R.; Mabury, S. A. Environ. Sci. Technol. 2018, 52, 10089.
doi: 10.1021/acs.est.8b02457 pmid: 9572880 |
|
(c) Zhan, T.; Pan, L.; Liu, Z.; Chen, J.; Ge, Z.; Lu, L.; Zhang, X.; Cui, S.; Zhang, C.; Liu, W.; Zhuang, S. Environ. Sci. Technol. 2018, 52, 11904.
pmid: 9572880 |
|
|
(d) Li, J.; Lam, J. C. W.; Li, W.; Du, B.; Chen, H.; Zeng, L. Environ. Sci. Technol. 2019, 53, 10969.
doi: 10.1021/acs.est.9b03127 pmid: 9572880 |
|
| [6] |
Weerasekare, G. M.; Berlin, K. D.; Sunkara, H.; Ford, W. T. Phosphorus Sulfur 2003, 178, 993.
doi: 10.1080/10426500307852 |
| [7] |
Liu, J.; Hu, T.; Li, Z.; Wei, X.; Hu, X.; Gao, H.; Liu, G.; Yi, Y.; Yamada-Takamura, Y.; Lee, C. S.; Wang, P.; Wang, Y. J. Phys. Chem. Lett. 2019, 10, 1888.
doi: 10.1021/acs.jpclett.9b00512 |
| [8] |
(a) Nibbs, A. E.; Scheidt, K. A. Eur. J. Org. Chem. 2012, 2012, 449.
doi: 10.1002/ejoc.v2012.3 |
|
(b) Meng, L.; Wang, J. Synlett 2016, 27, 656.
doi: 10.1055/s-00000083 |
|
|
(c) Yang, Q.; Guo, R.; Wang, J. Asian J. Org. Chem. 2019, 8, 1742.
doi: 10.1002/ajoc.v8.10 |
|
|
(d) Xiong, L.; Hu, H.; Wei, C.; Yu, B. Eur. J. Org. Chem. 2020, 2020, 1588.
doi: 10.1002/ejoc.201901581 |
|
|
(e) He, Q.-J.; So, C.-M.; Bian, Z.-X.; Hayashi, T.; Wang, J. Chem. Asian. J. 2015, 10, 540.
doi: 10.1002/asia.201403290 |
|
|
(f) Lyu, L.-Y.; Jin, M. Y.; He, Q.-J.; Xie. H.; Bian, Z.-X.; Wang, J. Org. Biomol. Chem. 2016, 14, 8088.
doi: 10.1039/C6OB01355D |
|
|
(g) Yang, Q.; Wang, Y.; Luo, S.; Wang, J. Angew. Chem., Int. Ed. 2019, 58, 5343.
doi: 10.1002/anie.v58.16 |
|
|
(h) Cai, B.; Yang, Q.; Meng, L.; Wang, J. Chin. J. Chem. 2021, 39, 1606.
doi: 10.1002/cjoc.v39.6 |
|
|
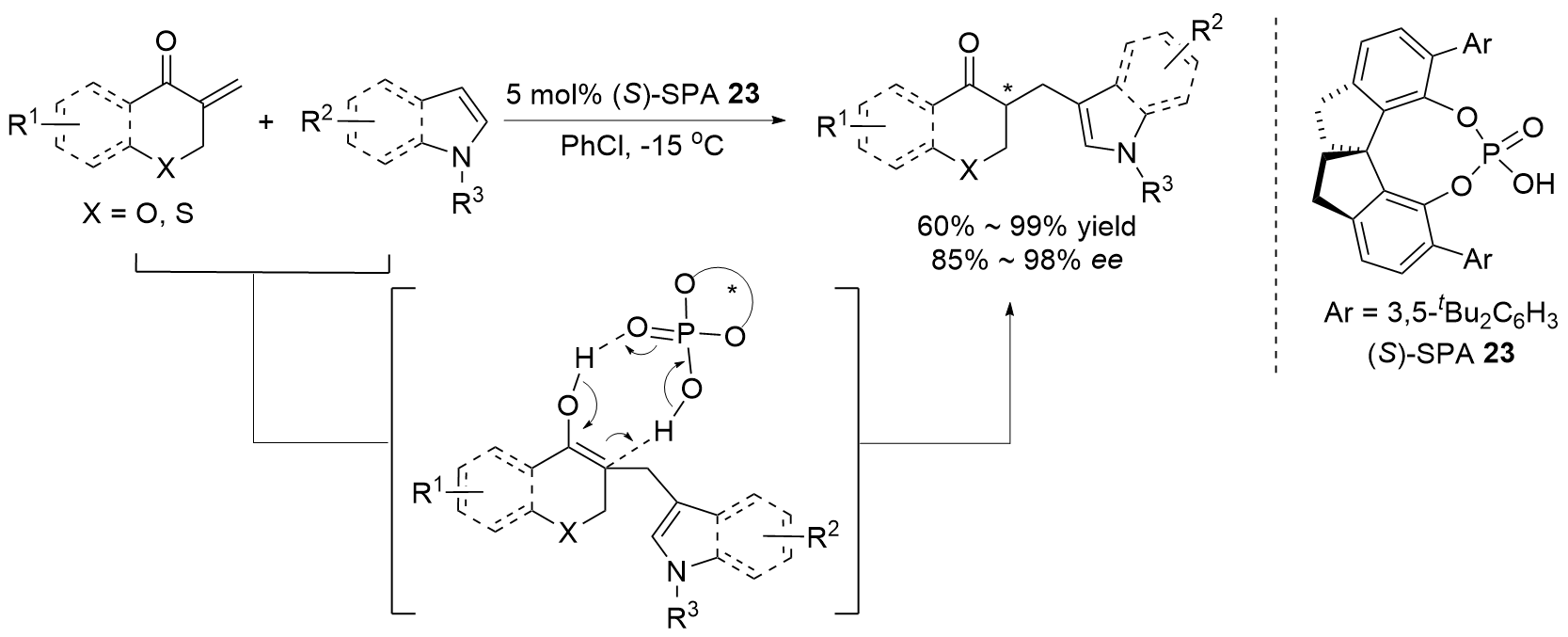
(g) Meng, L.; Liu, H.; Lin, Z.; Wang, J. Org. Lett. 2022, 24, 5890.
doi: 10.1021/acs.orglett.2c01922 |
|
| [9] |
(a) Schneller, S. W. InAdvances in Heterocyclic Chemistry, Vol.18, Eds.: Katritzky, A. R.; Boulton, A. J., United States, 1975, pp. 59-97.
|
|
(b) Bondock, S.; Metwally, M. A. J. Sulfur Chem. 2008, 29, 623.
doi: 10.1080/17415990802382882 |
|
| [10] |
(a) Dike, S. Y.; Ner, D. H.; Kumar, A. Bioorg. Med. Chem. Lett. 1991, 1, 383.
doi: 10.1016/S0960-894X(00)80260-7 pmid: 10956195 |
|
(b) van Vliet, L. A.; Rodenhuis, N.; Dijkstra, D.; Wikstrom, H.; Pugsley, T. A.; Serpa, K. A.; Meltzer, L. T.; Heffner, T. G.; Wise, L. D.; Lajiness, M. E.; Huff, R. M.; Svensson, K.; Sundell, S.; Lundmark, M. J. Med. Chem. 2000, 43, 2871.
pmid: 10956195 |
|
|
(c) Choi, E. J.; Lee, J. I.; Kim, G. H. Int. J. Mol. Med. 2012, 29, 252.
pmid: 10956195 |
|
|
(d) Song, J.; Jones, L. M.; Chavarria, G. E.; Charlton-Sevcik, A. K.; Jantz, A.; Johansen, A.; Bayeh, L.; Soeung, V.; Snyder, L. K.; Lade, S. D., Jr.; Chaplin, D. J.; Trawick, M. L.; Pinney, K. G. Bioorg. Med. Chem. Lett. 2013, 23, 2801.
doi: 10.1016/j.bmcl.2012.12.025 pmid: 10956195 |
|
|
(e) Song, Y. L.; Wu, F.; Zhang, C. C.; Liang, G. C.; Zhou, G.; Yu, J. J. Bioorg. Med. Chem. Lett. 2015, 25, 259.
doi: 10.1016/j.bmcl.2014.11.056 pmid: 10956195 |
|
| [11] |
(a) Clayton, S. E.; Gabbutt, C. D.; Hepworth, J. D.; Heron, B. M. Tetrahedron 1993, 49, 939.
doi: 10.1016/S0040-4020(01)80335-5 |
|
(b) Kumar, P.; Rao, A. T.; Pandey, B. Synth. Commun. 1994, 24, 3297.
doi: 10.1080/00397919408010253 |
|
|
(c) Konieczny, M. K.; Horowska, B.; Kunikowski, A.; Konopa, J.; Wierzba, K.; Yamada, Y.; Asao, T. J. Org. Chem. 1999, 64, 359.
doi: 10.1021/jo980586w |
|
|
(d) Cui, D.-M.; Kawamura, M.; Shimada, S.; Hayashi, T.; Tanaka, M. Tetrahedron Lett. 2003, 44, 4007.
doi: 10.1016/S0040-4039(03)00855-4 |
|
|
(e) Li, J.; Li, H.; Li, H.; Xiao, L. J. Chem. Res. 2004, 6, 394.
|
|
| [12] |
Vaghoo, H.; Prakash, G. K. S.; Narayanan, A.; Choudhary, R.; Paknia, F.; Mathew, T.; Olah, G. A. Org. Lett. 2015, 17, 6170.
doi: 10.1021/acs.orglett.5b03172 |
| [13] |
Sangeetha, S.; Muthupandi, P.; Sekar, G. Org. Lett. 2015, 17, 6006.
doi: 10.1021/acs.orglett.5b02977 |
| [14] |
Bouisseau, A.; Glancy, J.; Willis, M. C. Org. Lett. 2016, 18, 5676.
pmid: 27779887 |
| [15] |
Guo, F.; Jeffries, M. C.; Graves, B. N.; Graham, S. A.; Pollard, D. A.; Pang, G.; Chen, H. Y. Tetrahedron 2017, 73, 5745.
doi: 10.1016/j.tet.2017.08.012 |
| [16] |
Chen, X.-L.; Tang, B.-C.; He, C.; Ma, J.-T.; Zhuang, S.-Y.; Wu, Y.-D.; Wu, A.-X. Chem. Commun. 2020, 53, 13653.
|
| [17] |
Nandy, A.; Sekar, G. J. Org. Chem. 2022, 87, 7536.
doi: 10.1021/acs.joc.2c00425 |
| [18] |
Meng, L.; Jin, M. Y.; Wang, J. Org. Lett. 2016, 18, 4986.
doi: 10.1021/acs.orglett.6b02453 |
| [19] |
Luo, S.; Meng, L.; Yang, Q.; Wang, J. Synlett 2018, 29, 2071.
doi: 10.1055/s-0037-1610225 |
| [20] |
Vila, C.; Hornillos, V.; Fananas-Mastral, M.; Feringa, B. L. Chem. Commun. 2013, 49, 5933.
doi: 10.1039/c3cc43105c |
| [21] |
Trost, B. M.; Gnanamani, E.; Kalnmals, C. A.; Hung, C.; Tracy, J. S. J. Am. Chem. Soc. 2019, 141, 1489.
doi: 10.1021/jacs.8b13367 |
| [22] |
Meng, L.; Ngai, K. Y.; Chang, X.; Lin, Z.; Wang, J. Org. Lett. 2020, 22, 1155.
doi: 10.1021/acs.orglett.0c00005 |
| [23] |
Zhao, D.; Beiring, B.; Glorius, F. Angew. Chem., Int. Ed. 2013, 52, 8454.
doi: 10.1002/anie.v52.32 |
| [24] |
Xiong, D.; Zhou, W.; Lu, Z.; Zeng, S.; Wang, J. Chem. Commun. 2017, 53, 6844.
doi: 10.1039/C7CC03939E |
| [25] |
Kerr, M. S.; de Alaniz, J. R.; Rovis, T. J. Am. Chem. Soc. 2002, 124, 10298.
doi: 10.1021/ja027411v |
| [26] |
Li, W.; Liu, X.; Hao, X.; Hu, X.; Chu, Y.; Cao, W.; Qin, S.; Hu, C.; Lin, L.; Feng, X. J. Am. Chem. Soc. 2011, 133, 15268.
doi: 10.1021/ja2056159 |
| [1] | 刘杰, 韩峰, 李双艳, 陈天煜, 陈建辉, 徐清. 无过渡金属参与甲基杂环化合物与醇的选择性有氧烯基化反应[J]. 有机化学, 2024, 44(2): 573-583. |
| [2] | 于士航, 刘嘉威, 安碧玉, 边庆花, 王敏, 钟江春. 黑腹尼虎天牛接触性信息素的不对称合成[J]. 有机化学, 2024, 44(1): 301-308. |
| [3] | 王化坤, 任晓龙, 宣宜宁. 卤盐催化的α,β-环氧羧酸酯与异氰酸酯[3+2]环加成反应研究[J]. 有机化学, 2024, 44(1): 251-258. |
| [4] | 赵红琼, 于淼, 宋冬雪, 贾琦, 刘颖杰, 季宇彬, 许颖. 羧酸脱羧羟基化反应研究进展[J]. 有机化学, 2024, 44(1): 70-84. |
| [5] | 高晓阳, 翟锐锐, 陈训, 王烁今. 碳酸亚乙烯酯参与C—H键活化反应的研究进展[J]. 有机化学, 2023, 43(9): 3119-3134. |
| [6] | 王玉超, 刘晋彪, 何智涛. 钯催化共轭二烯的不对称氢官能团化[J]. 有机化学, 2023, 43(8): 2614-2627. |
| [7] | 陈新强, 张敬. 伯醇的脱羟甲基反应的研究进展[J]. 有机化学, 2023, 43(8): 2711-2719. |
| [8] | 陈玉琢, 孙红梅, 王亮, 胡方芝, 李帅帅. 基于α-氢迁移策略构建杂环骨架的研究进展[J]. 有机化学, 2023, 43(7): 2323-2337. |
| [9] | 宋亭谕, 李冉, 黄利华, 贾世琨, 梅光建. N—N单键阻转异构体的催化不对称合成[J]. 有机化学, 2023, 43(6): 1977-1990. |
| [10] | 罗诚, 尹艳丽, 江智勇. P-手性膦氧化物的不对称合成研究进展[J]. 有机化学, 2023, 43(6): 1963-1976. |
| [11] | 徐光利, 许静, 徐海东, 崔香, 舒兴中. 过渡金属催化烯烃和炔烃合成1,3-共轭二烯化合物研究进展[J]. 有机化学, 2023, 43(6): 1899-1933. |
| [12] | 户晓兢, 郭斐翔, 朱润青, 周柄棋, 张涛, 房立真. 对烷氧基酚的合成及其去芳构化后的合成应用[J]. 有机化学, 2023, 43(6): 2239-2244. |
| [13] | 孔德亮, 戴闻, 赵怡玲, 陈艺林, 朱红平. 脒基胺硼基硅宾与单酮和二酮的氧化环加成反应研究[J]. 有机化学, 2023, 43(5): 1843-1851. |
| [14] | 庞明杨, 常宏宏, 冯璋, 张娟. 过渡金属催化吲哚的串联去芳构化反应研究进展[J]. 有机化学, 2023, 43(4): 1271-1291. |
| [15] | 贾海瑞, 邱早早. 过渡金属催化硼-氢键活化合成含硼-杂原子键邻碳硼烷衍生物的研究进展[J]. 有机化学, 2023, 43(3): 1045-1068. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||
