有机化学 ›› 2023, Vol. 43 ›› Issue (8): 2711-2719.DOI: 10.6023/cjoc202303009 上一篇 下一篇
综述与进展
收稿日期:2023-03-04
修回日期:2023-04-04
发布日期:2023-04-13
基金资助:Received:2023-03-04
Revised:2023-04-04
Published:2023-04-13
Contact:
*E-mail: Supported by:文章分享
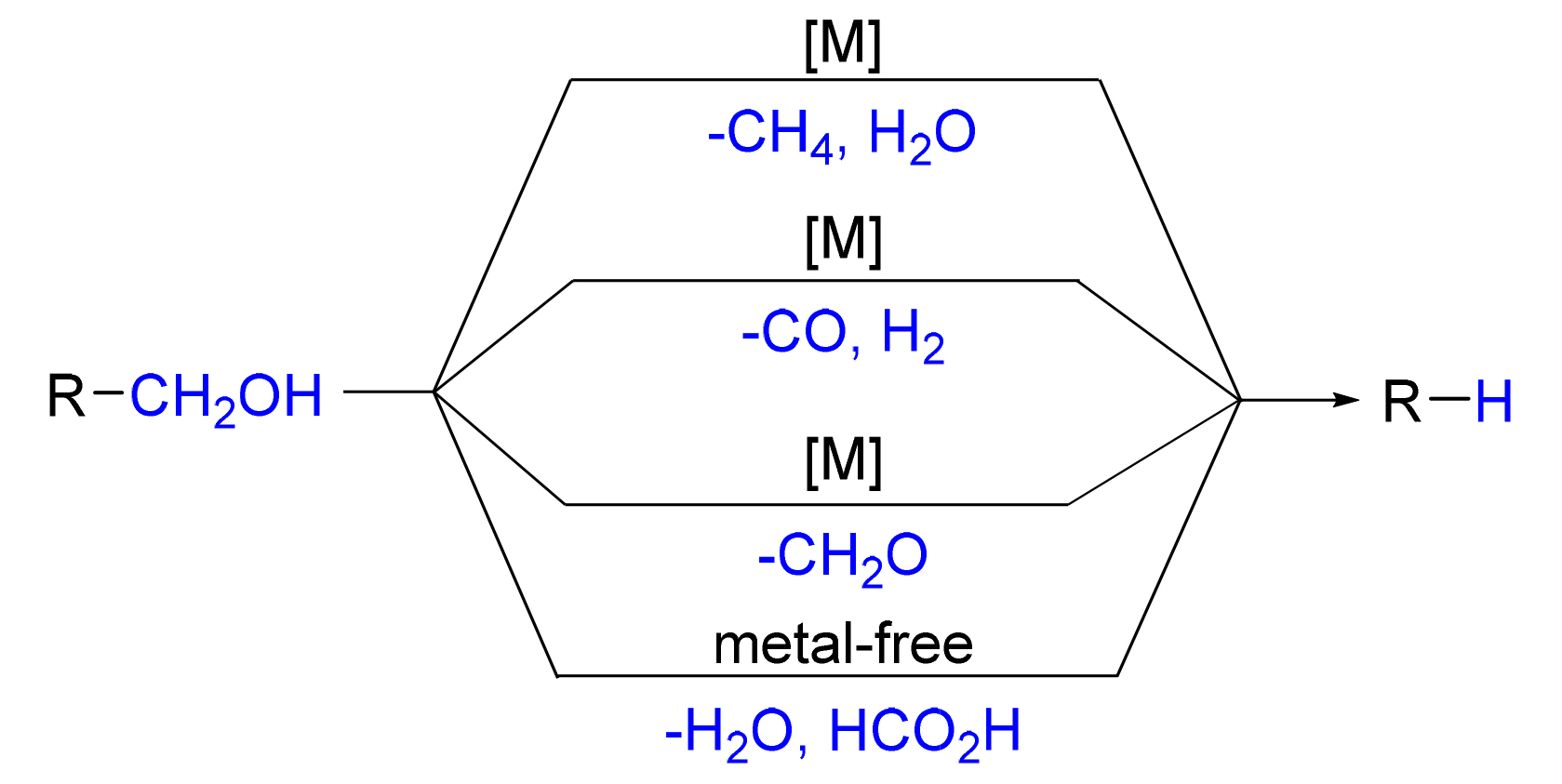
伯醇来源广泛且廉价易得, 是生产各种化学品, 如农用化学品、食品添加剂、香料和药物等的重要化工原料. 伯醇的脱羟甲基反应是一种利用伯醇制备少一个碳原子的碳氢化合物的方法, 在生物质降解和药物合成等方面有着广泛的应用, 引起了有机化学家的关注. 根据反应类型综述了伯醇的脱羟甲基反应的发展, 根据反应特点分为四个部分综述: 过渡金属催化脱羟甲基转化为甲烷和水的反应、过渡金属催化脱羟甲基转化为一氧化碳和氢气的反应、过渡金属催化脱羟甲基转化为甲醛的反应、无过渡金属脱羟甲基转化为甲酸和水的反应. 主要从反应体系、适用范围、反应机理等方面阐述了伯醇的脱羟甲基反应的研究进展.
陈新强, 张敬. 伯醇的脱羟甲基反应的研究进展[J]. 有机化学, 2023, 43(8): 2711-2719.
Xinqiang Chen, Jing Zhang. Progress in the Study of Dehydroxymethylation of Primary Alcohol[J]. Chinese Journal of Organic Chemistry, 2023, 43(8): 2711-2719.
| [1] |
Lutz, M. D. R.; Morandi, B. Chem. Rev. 2021, 121, 300.
doi: 10.1021/acs.chemrev.0c00154 |
| [2] |
Dong, X.-J.; Jin, W.-W.; Liu, C.-J. Chin. J. Org. Chem. 2020, 40, 1860. (in Chinese)
doi: 10.6023/cjoc202002038 |
|
( 董晓娟, 金伟伟, 刘晨江, 有机化学, 2020, 40, 1860.)
doi: 10.6023/cjoc202002038 |
|
| [3] |
Contente, M. L.; Paradisi, F. Nat. Catal. 2018, 1, 452.
doi: 10.1038/s41929-018-0082-9 |
| [4] |
Ahn, Y.; Ko, S.-B.; Kim, M.-J.; Park, J. Coord. Chem. Rev. 2008, 252, 647.
doi: 10.1016/j.ccr.2007.09.009 |
| [5] |
Modak, A.; Maiti, D. Org. Biomol. Chem. 2016, 14, 21.
doi: 10.1039/C5OB01949D |
| [6] |
Zeng, H.; Yu, J.; Li, C. J. Chem. Commun. 2020, 56, 1239.
doi: 10.1039/C9CC09347H |
| [7] |
Zhang, S.-X.; Li, X.-R.; Li, W.-X.; Rao, W.-D.; Ge, D.-H.; Shen, Z.-L.; Chu, X.-Q. Chin. J. Org. Chem. 2022, 42, 235. (in Chinese)
doi: 10.6023/cjoc202107048 |
|
( 张斯旋, 李祥瑞, 李文欣, 饶卫东, 葛丹华, 沈志良, 褚雪强, 有机化学, 2022, 42, 235.)
doi: 10.6023/cjoc202107048 |
|
| [8] |
Xue, X.; Weng, Y.; Yang, S.; Meng, S.; Sun, Q.; Zhang, Y. RSC Adv. 2021, 11, 6163.
doi: 10.1039/D0RA08329A |
| [9] |
Surisetty, V. R.; Dalai, A. K.; Kozinski, J. Appl. Catal., A 2011, 404, 1.
|
| [10] |
Norjannah, B.; Ong, H. C.; Masjuki, H. H.; Juan, J. C.; Chong, W. T. RSC Adv. 2016, 6, 60034.
doi: 10.1039/C6RA08062F |
| [11] |
Chen, B.-S.; Ribeiro de Souza, F. Z. RSC Adv. 2019, 9, 2102.
doi: 10.1039/C8RA09004A |
| [12] |
Tian, Z.-W.; Da, W.-M.; Wang, L.; Yang, Y.-S.; Wei, M. Acta Chim. Sinica 2022, 80, 1322. (in Chinese)
doi: 10.6023/A22040189 |
|
( 田钊炜, 达伟民, 王雷, 杨宇森, 卫敏, 化学学报, 2022, 80, 1322.)
doi: 10.6023/A22040189 |
|
| [13] |
Liu, H.; Dong, C.; Zhang, Z.; Wu, P.; Jiang, X. Angew. Chem., Int. Ed. 2012, 51, 12570.
doi: 10.1002/anie.201207206 |
| [14] |
Christensen, S. H.; Olsen, E. P.; Rosenbaum, J.; Madsen, R. Org. Biomol. Chem. 2015, 13, 938.
doi: 10.1039/c4ob01958j pmid: 25410149 |
| [15] |
Kumar, A.; Shah, B. A. Org. Lett. 2015, 17, 5232.
doi: 10.1021/acs.orglett.5b02578 |
| [16] |
Park, H.-S.; Kim, D.-S.; Jun, C.-H. ACS Catal. 2015, 5, 397.
doi: 10.1021/cs501778q |
| [17] |
Huang, G.; Lu, L.; Jiang, H.; Yin, B. Chem. Commun. 2017, 53, 12217.
doi: 10.1039/C7CC07111F |
| [18] |
Wu, X.; Cruz, F. A.; Lu, A.; Dong, V. M. J. Am. Chem. Soc. 2018, 140, 10126.
doi: 10.1021/jacs.8b06069 |
| [19] |
Hu, X.; Li, G.-X.; He, G.; Chen, G. Org. Chem. Front. 2019, 6, 3205.
doi: 10.1039/C9QO00786E |
| [20] |
Chen, Y.; Wang, X.; He, X.; An, Q.; Zuo, Z.-W J. Am. Chem. Soc. 2021, 143, 4896.
doi: 10.1021/jacs.1c00618 |
| [21] |
Gao, Y.; Liu, J.; Wei, C.; Li, Y.; Zhang, K.; Song, L.; Cai, L. Nat. Commun. 2022, 13, 7450.
doi: 10.1038/s41467-022-35249-7 |
| [22] |
Mahajan, B.; Aand, D.; Singh, A. K. ChemistrySelect 2018, 3, 12336.
doi: 10.1002/slct.v3.43 |
| [23] |
Yu, X.; Wang, J.; Guo, W.; Tian, Y.; Wang, J. Organometallics 2016, 35, 1876.
doi: 10.1021/acs.organomet.6b00238 |
| [24] |
Zhou, X.; Ding, H.; Chen, P.; Liu, L.; Sun, Q.; Wang, X.; Wang, P.; Lv, Z.; Li, M. Angew. Chem., Int. Ed. 2020, 59, 4138.
doi: 10.1002/anie.v59.10 |
| [25] |
Liu, M.; Zhang, Z.; Liu, H.; Wu, T.; Han, B. Chem. Commun. 2020, 56, 7120.
doi: 10.1039/D0CC02306J |
| [26] |
Chheda, J. N.; Huber, G. W.; Dumesic, J. A. Angew. Chem., Int. Ed. 2007, 46, 7164.
doi: 10.1002/(ISSN)1521-3773 |
| [27] |
Gallezot, P. ChemSusChem 2008, 1, 734.
doi: 10.1002/cssc.200800091 pmid: 18686290 |
| [28] |
Marshall, A. L.; Alaimo, P. J. Chem.-Eur. J. 2010, 16, 4970.
doi: 10.1002/chem.v16:17 |
| [29] |
Zakzeski, J.; Bruijnincx, P. C.; Jongerius, A. A. L.; Weckhuysen, B. M. Chem. Rev. 2010, 110, 3552.
doi: 10.1021/cr900354u pmid: 20218547 |
| [30] |
Serrano-Ruiz, J. C.; Dumesic, J. A. Energy Environ. Sci. 2011, 4, 83.
doi: 10.1039/C0EE00436G |
| [31] |
Li, H.; Wu, H.; Yu, Z.; Zhang, H.; Yang, S. ChemSusChem 2020, 13, 3565.
doi: 10.1002/cssc.v13.14 |
| [32] |
Agarwal, S.; Al-Abed, S. R.; Dionysiou, D. D. Environ. Sci. Technol. 2007, 41, 3722.
doi: 10.1021/es062886y |
| [33] |
Monrad, R. N.; Madsen, R. J. Org. Chem. 2007, 72, 9782.
doi: 10.1021/jo7017729 |
| [34] |
Agarwal, S.; Al-Abed, S. R.; Dionysiou, D. D. Environ. Sci. Technol. 2009, 43, 915.
doi: 10.1021/es802538d |
| [35] |
Yamaguchi, S.; Kondo, H.; Uesugi, K.; Sakoda, K.; Jitsukawa, K.; Mitsudome, T.; Mizugaki, T. ChemCatChem 2021, 13, 1135.
doi: 10.1002/cctc.v13.4 |
| [36] |
Zhang, Z.; Zijlstra, D. S.; Lahive, C. W.; Deuss, P. J. Green Chem. 2020, 22, 3791.
doi: 10.1039/D0GC01209B |
| [37] |
Kreis, M.; Palmelund, A.; Bunch, L.; Madsen, R. Adv. Synth. Catal. 2006, 348, 2148.
doi: 10.1002/(ISSN)1615-4169 |
| [38] |
Fessard, T. C.; Andrews, S. P.; Motoyoshi, H.; Carreira, E. M. Angew. Chem., Int. Ed. 2007, 46, 9331.
doi: 10.1002/(ISSN)1521-3773 |
| [39] |
Iwai, T.; Fujihara, T.; Tsuji, Y. Chem. Commun. 2008, 6215.
|
| [40] |
Bräse, S.; Bröhmer, M.; Volz, N. Synlett 2009, 1383.
|
| [41] |
Akanksha; Maiti, D. Green Chem. 2012, 14, 2314.
doi: 10.1039/c2gc35622h |
| [42] |
Modak, A.; Deb, A.; Patra, T.; Rana, S.; Maity, S.; Maiti, D. Chem. Commun. 2012, 48, 46.
doi: 10.1039/C1CC14674B |
| [43] |
Roa, A. E.; Salazar, V.; López-Serrano, J.; Oñate, E.; Paneque, M.; Poveda, M. L. Organometallics 2012, 31, 716.
doi: 10.1021/om201094q |
| [44] |
Huang, Y. B.; Yang, Z.; Chen, M. Y.; Dai, J. J.; Guo, Q. X.; Fu, Y. ChemSusChem 2013, 6, 1348.
doi: 10.1002/cssc.201300190 |
| [45] |
Gutmann, B.; Elsner, P.; Glasnov, T.; Roberge, D. M.; Kappe, C. O. Angew. Chem., Int. Ed. 2014, 53, 11557.
doi: 10.1002/anie.201407219 |
| [46] |
Mitra, J.; Zhou, X.; Rauchfuss, T. Green Chem. 2015, 17, 307.
doi: 10.1039/C4GC01520G |
| [47] |
Shokri, A.; Que, L., Jr. J. Am. Chem. Soc. 2015, 137, 7686.
doi: 10.1021/jacs.5b01053 |
| [48] |
Hattori, T.; Takakura, R.; Ichikawa, T.; Sawama, Y.; Monguchi, Y.; Sajiki, H. J. Org. Chem. 2016, 81, 2737.
doi: 10.1021/acs.joc.5b02632 |
| [49] |
Ding, K.; Xu, S.; Alotaibi, R.; Paudel, K.; Reinheimer, E. W.; Weatherly, J. J. Org. Chem. 2017, 82, 4924.
doi: 10.1021/acs.joc.7b00284 |
| [50] |
Chatterjee, M.; Ishizaka, T.; Kawanami, H. Green Chem. 2018, 20, 2345.
doi: 10.1039/C8GC00174J |
| [51] |
Li, W. H.; Li, C. Y.; Li, Y.; Tang, H. T.; Wang, H. S.; Pan, Y. M.; Ding, Y. J. Chem. Commun. 2018, 54, 8446.
doi: 10.1039/C8CC03109F |
| [52] |
Matsuyama, T.; Yatabe, T.; Yabe, T.; Yamaguchi, K. ACS Catal. 2021, 11, 13745.
doi: 10.1021/acscatal.1c03375 |
| [53] |
Lu, H.; Yu, T. Y.; Xu, P. F.; Wei, H. Chem. Rev. 2021, 121, 365.
doi: 10.1021/acs.chemrev.0c00153 |
| [54] |
Böeseken, J.; van Senden, G. H. Recl. Trav. Chim. Pays-Bas Belg. 1913, 32, 23.
doi: 10.1002/recl.19130320202 |
| [55] |
Wojcik, B.; Adkins, H. J. Am. Chem. Soc. 1933, 55, 1293.
|
| [56] |
Adkins, H. Ind. Eng. Chem. Anal. Ed. 1932, 4, 342.
|
| [57] |
Covert, L. W.; Adkins, H. J. Am. Chem. Soc. 1932, 54, 4116.
doi: 10.1021/ja01349a510 |
| [58] |
Ipatieff, V. N.; Monroe, G. S.; Fischer, L. E.; Meisinger, E. E. Ind. Eng. Chem. 1949, 41, 1802.
doi: 10.1021/ie50476a066 |
| [59] |
Ipatieff, V. N.; Thompson, W. W.; Pines, H. J. Am. Chem. Soc. 1951, 73, 553.
doi: 10.1021/ja01146a013 |
| [60] |
Ipatieff, V. N.; Czajkowski, G. J.; Pines, H. J. Am. Chem. Soc. 1951, 73, 4098.
doi: 10.1021/ja01153a014 |
| [61] |
Pines, H.; Rodenberg, H. G.; Ipatieff, V. N. J. Am. Chem. Soc. 1953, 75, 6065.
doi: 10.1021/ja01119a530 |
| [62] |
Pines, H.; Rodenberg, H. G.; Ipatieff, V. N. J. Am. Chem. Soc. 1954, 76, 771.
doi: 10.1021/ja01632a040 |
| [63] |
Pines, H.; Shamaiengar, M.; Postl, W. S. J. Am. Chem. Soc. 1955, 77, 5099.
doi: 10.1021/ja01624a044 |
| [64] |
Reinecke, M. G.; Grins, G.; Kray, L. R.; Francis, R. F. Ann. N. Y. Acad. Sci. 1967, 145, 116.
doi: 10.1111/nyas.1967.145.issue-1 |
| [65] |
Masayoshi, I.; Koji, S.; Masatoshi, K.; Kazuo, H. Bull. Chem. Soc. Jpn. 1970, 43, 2186.
doi: 10.1246/bcsj.43.2186 |
| [66] |
Maier, W. F.; Grubmüller, P.; Thies, I.; Stein, P. M.; McKervey, M. A.; Schleyer, P. V. R. Angew. Chem., Int. Ed. Engl. 1979, 18, 939.
|
| [67] |
Di, L.; Yao, S.; Li, M.; Wu, G.; Dai, W.; Wang, G.; Li, L.; Guan, N. ACS Catal. 2015, 5, 7199.
doi: 10.1021/acscatal.5b02180 |
| [68] |
Mizugaki, T.; Togo, K.; Maeno, Z.; Mitsudome, T.; Jitsukawa, K.; Kaneda, K. Sci. Rep. 2017, 7, 14007.
doi: 10.1038/s41598-017-14373-1 pmid: 29070900 |
| [69] |
Kim, C.; Matsui, Y.; Orchin, M. J. Organomet. Chem. 1985, 279, 159.
doi: 10.1016/0022-328X(85)87013-3 |
| [70] |
Olsen, E. P.; Madsen, R. Chem.-Eur. J. 2012, 18, 16023.
doi: 10.1002/chem.v18.50 |
| [71] |
Olsen, E. P.; Singh, T.; Harris, P.; Andersson, P. G.; Madsen, R. J. Am. Chem. Soc. 2015, 137, 834.
doi: 10.1021/ja5106943 |
| [72] |
Ho, H. A.; Manna, K.; Sadow, A. D. Angew. Chem., Int. Ed. 2012, 51, 8607.
doi: 10.1002/anie.v51.34 |
| [73] |
Modak, A.; Naveen, T.; Maiti, D. Chem. Commun. 2013, 49, 252.
doi: 10.1039/C2CC36951F |
| [74] |
Mazziotta, A.; Madsen, R. Eur. J. Org. Chem. 2017, 2017, 5417.
|
| [75] |
Pedersen, M. J.; Madsen, R.; Clausen, M. H. Chem. Commun. 2018, 54, 952.
doi: 10.1039/C7CC09260A |
| [76] |
Peng, L.; Ma, M.; Zhang, X.; Zhang, S.; Wang, J. Tetrahedron Lett. 2006, 47, 8175.
doi: 10.1016/j.tetlet.2006.09.017 |
| [77] |
Zhang, K.; Chang, L.; An, Q.; Wang, X.; Zuo, Z.-W. J. Am. Chem. Soc. 2019, 141, 10556.
doi: 10.1021/jacs.9b05932 |
| [78] |
Xia, A.; Qi, X.; Mao, X.; Wu, X.; Yang, X.; Zhang, R.; Xiang, Z.; Lian, Z.; Chen, Y.; Yang, S. Org. Lett. 2019, 21, 3028.
doi: 10.1021/acs.orglett.9b00563 |
| [1] | 赵红琼, 于淼, 宋冬雪, 贾琦, 刘颖杰, 季宇彬, 许颖. 羧酸脱羧羟基化反应研究进展[J]. 有机化学, 2024, 44(1): 70-84. |
| [2] | 高晓阳, 翟锐锐, 陈训, 王烁今. 碳酸亚乙烯酯参与C—H键活化反应的研究进展[J]. 有机化学, 2023, 43(9): 3119-3134. |
| [3] | 徐光利, 许静, 徐海东, 崔香, 舒兴中. 过渡金属催化烯烃和炔烃合成1,3-共轭二烯化合物研究进展[J]. 有机化学, 2023, 43(6): 1899-1933. |
| [4] | 户晓兢, 郭斐翔, 朱润青, 周柄棋, 张涛, 房立真. 对烷氧基酚的合成及其去芳构化后的合成应用[J]. 有机化学, 2023, 43(6): 2239-2244. |
| [5] | 庞明杨, 常宏宏, 冯璋, 张娟. 过渡金属催化吲哚的串联去芳构化反应研究进展[J]. 有机化学, 2023, 43(4): 1271-1291. |
| [6] | 吴孔川, 卢铠洪, 林建斌, 张慧君. 莱啉酰亚胺类化合物的邻位C—H键功能化研究进展[J]. 有机化学, 2023, 43(3): 1000-1011. |
| [7] | 贾海瑞, 邱早早. 过渡金属催化硼-氢键活化合成含硼-杂原子键邻碳硼烷衍生物的研究进展[J]. 有机化学, 2023, 43(3): 1045-1068. |
| [8] | 蒙玲, 汪君. 硫代黄烷酮类衍生物的合成研究进展[J]. 有机化学, 2023, 43(3): 873-891. |
| [9] | 段康慧, 唐俊龙, 伍婉卿. 稠杂环化合物的合成及其抗肿瘤活性研究进展[J]. 有机化学, 2023, 43(3): 826-854. |
| [10] | 孙婧, 张萌萌, 锅小龙, 王琪, 王陆瑶. 无过渡金属条件下二芳基硒化合物的合成[J]. 有机化学, 2023, 43(12): 4251-4260. |
| [11] | 秦思凝. 芳香卤代物C—S偶联反应的研究进展[J]. 有机化学, 2023, 43(11): 3761-3783. |
| [12] | 刘敏, 亓丽萍, 赵东兵. 过渡金属催化硅杂环丁烷的C—Si键断裂反应研究进展[J]. 有机化学, 2023, 43(10): 3508-3525. |
| [13] | 曾燕, 叶飞. 不对称催化构建硅立体中心化合物的新反应体系研究进展[J]. 有机化学, 2023, 43(10): 3388-3413. |
| [14] | 袁成, 潘长多. 以7-氮杂吲哚为内在导向基团的N-芳基C—H官能化研究进展[J]. 有机化学, 2023, 43(1): 156-170. |
| [15] | 刘东汉, 鲁席杭, 柴张梦洁, 杨浩琦, 孙瑜琳, 余富朝. 构建2H-吡咯-2-酮骨架的研究进展[J]. 有机化学, 2023, 43(1): 57-73. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||
