有机化学 ›› 2023, Vol. 43 ›› Issue (10): 3454-3469.DOI: 10.6023/cjoc202306028 上一篇 下一篇
所属专题: 有机硅化学专辑-2023
综述与进展
收稿日期:2023-06-30
修回日期:2023-08-31
发布日期:2023-09-08
基金资助:
Fengjuan Chen, Luo Liu, Zilu Zhang( ), Wei Zeng
), Wei Zeng
Received:2023-06-30
Revised:2023-08-31
Published:2023-09-08
Contact:
*E-mail: Supported by:文章分享

硅杂化合物广泛存在于药物分子和具有特殊用途的功能材料中. 与其同主族的全碳母体化合物相比, 通常硅元素的存在赋予了相应的硅杂化合物特殊的生物活性和独特的物理化学性能. 概述了近年来可见光催化有机硅的合成方法和策略, 并对其反应机理和局限性予以分析和讨论.
陈凤娟, 刘罗, 张子露, 曾伟. 可见光催化有机硅的合成研究进展[J]. 有机化学, 2023, 43(10): 3454-3469.
Fengjuan Chen, Luo Liu, Zilu Zhang, Wei Zeng. Recent Progress in Synthesis of Organosilanes Driven by Visible-Light[J]. Chinese Journal of Organic Chemistry, 2023, 43(10): 3454-3469.
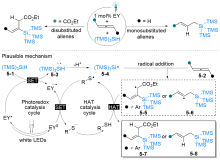
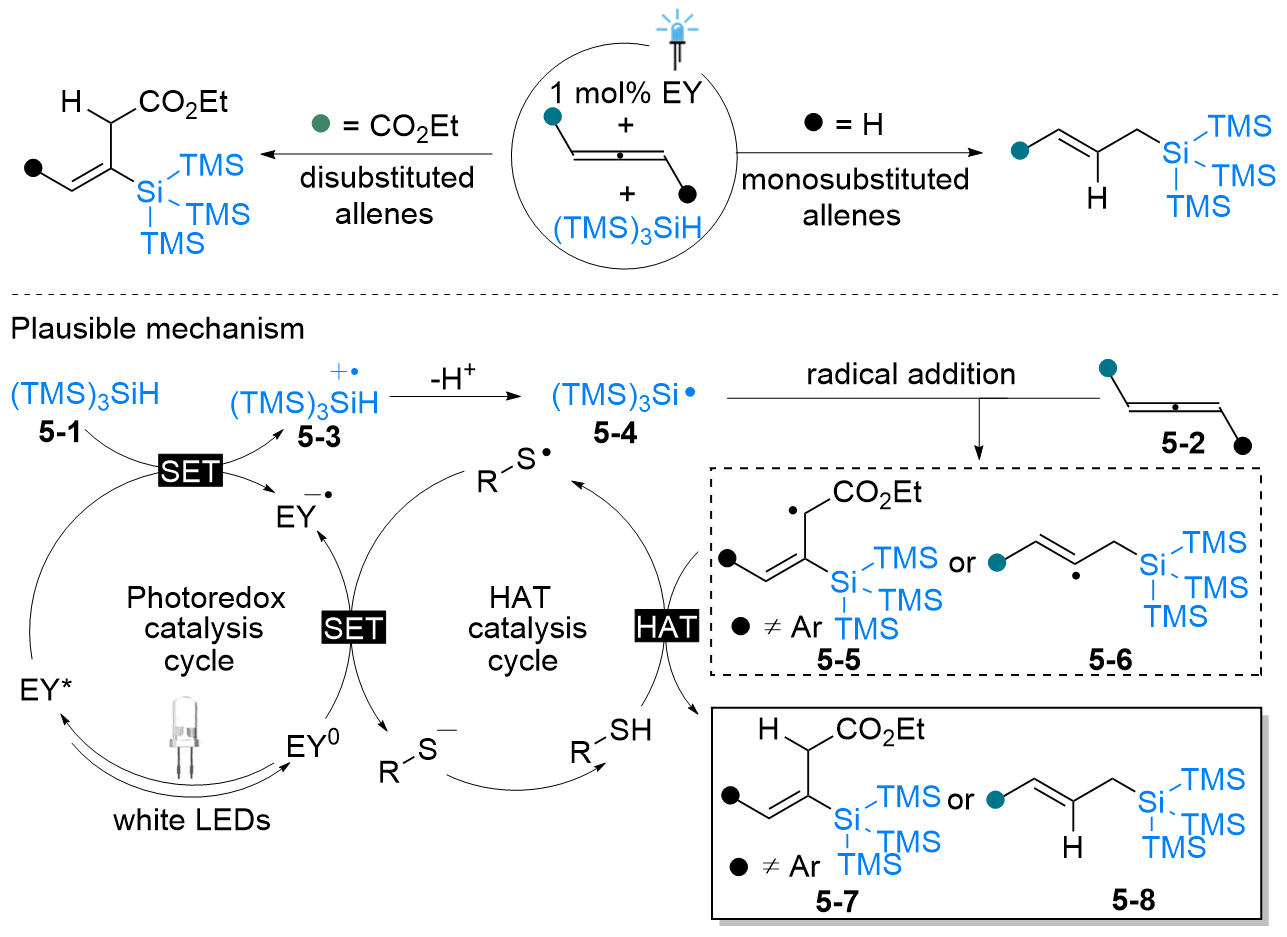
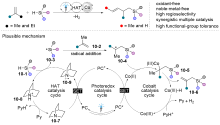
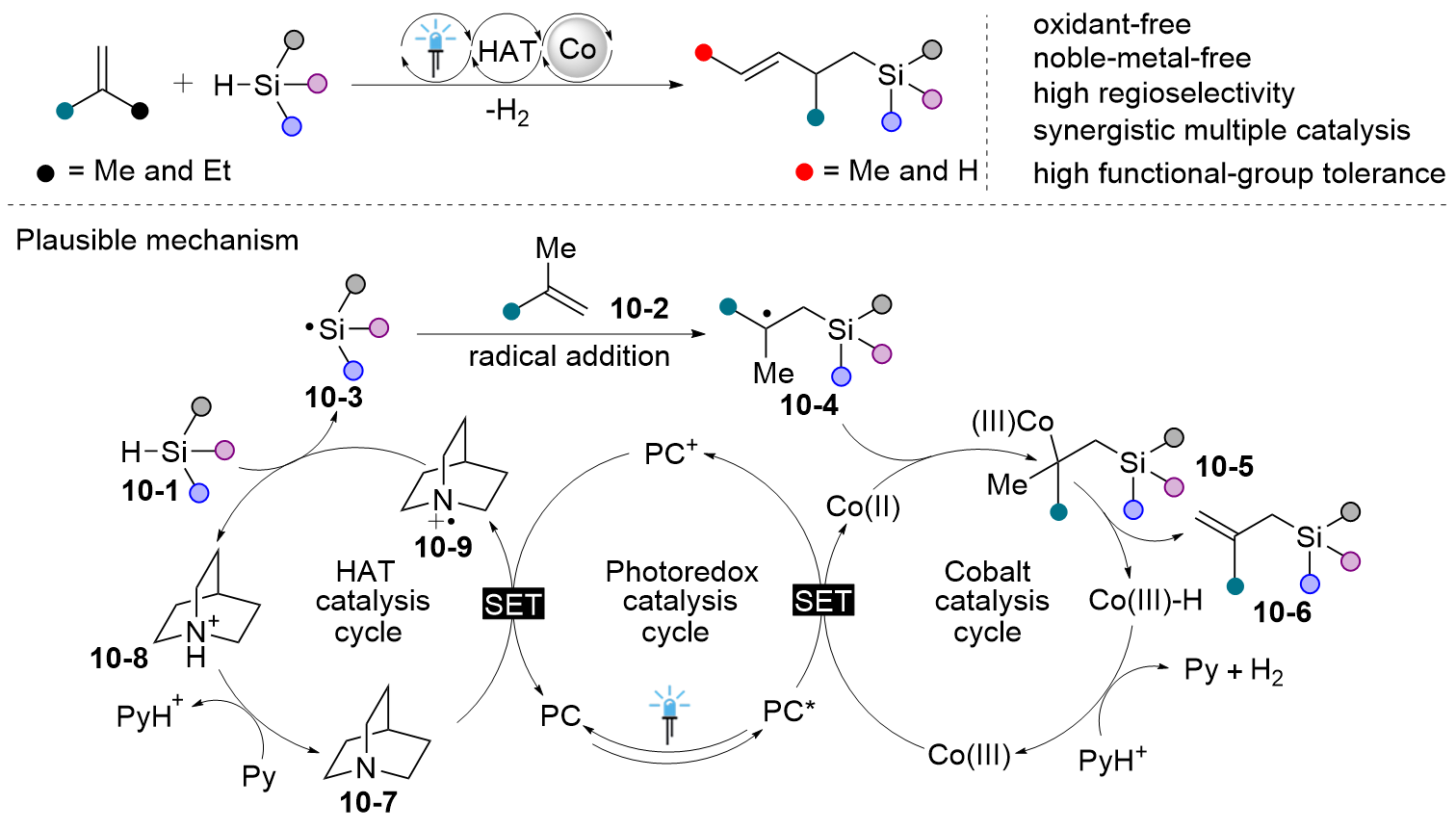
| [1] |
Förster B.; Bertermann R.; Kraft P.; Tacke R. Organometallics 2014, 33, 338.
doi: 10.1021/om401070c |
| [2] |
Allred A. L.; Rochow E. G. J. Inorg. Nucl. Chem. 1958, 5, 264.
doi: 10.1016/0022-1902(58)80003-2 |
| [3] |
(a) Shen L.; Zhao K.; Doitomi K.; Ganguly R.; Li Y.-X.; Shen Z.-L.; Hirao H.; Loh T.-P. J. Am. Chem. Soc. 2017, 139, 13570.
doi: 10.1021/jacs.7b07997 pmid: 24171447 |
|
(b) Breit N. C.; Szilvasi T.; Suzuki T.; Gallego D.; Inoue S. J. Am. Chem. Soc. 2013, 135, 17958.
doi: 10.1021/ja409720c pmid: 24171447 |
|
| [4] |
(a) Akiyama T.; Imazeki S. Chem. Lett. 1997, 10, 1077.
|
|
(b) Fleming I.; Winter S. B. D. J. Chem. Soc., Perkin Trans. 1 1998, 2687.
|
|
| [5] |
(a) Chen X.; Li M. K.; Liu Z. P.; Yang C.; Xie H.; Hu X.; Su S.-J.; Jiang H.; Zeng W. Org. Lett. 2021, 23, 6724.
doi: 10.1021/acs.orglett.1c02283 pmid: 36817085 |
|
(b) Pawley S. B.; Conner A. M.; Omer H. M.; Watson D. A. ACS Catal. 2022, 12, 13108.
doi: 10.1021/acscatal.2c03981 pmid: 36817085 |
|
|
(c) Nakajimaa Y.; Shimada S. RSC Adv. 2015, 5, 20603.
doi: 10.1039/C4RA17281G pmid: 36817085 |
|
|
(d) Ren L. Q.; Li N.; Ke J.; He C. Org. Chem. Front. 2022, 9, 6400.
doi: 10.1039/D2QO01387H pmid: 36817085 |
|
|
(e) Yang X. H.; Gao H. W.; Yan J. L.; Shi L. Chin. J. Org. Chem. 2022, 42, 4122 (in Chinese).
doi: 10.6023/cjoc202207047 pmid: 36817085 |
|
|
(杨惜晖, 高皓炜, 闫甲乐, 史雷, 有机化学, 2022, 42, 4122.)
doi: 10.6023/cjoc202207047 pmid: 36817085 |
|
| [6] |
(a) Albini A.; Fagnoni M. Photochemically Generated Intermediates in Synthesis Wiley, Hoboken, 2013.
|
|
(b) Brook A. G. In The Chemistry of Organic Silicon Compounds, Vol. 2, Eds.: Rappoport, Z.; Apeloig, Y., Wiley, New York, 1998, p. 1233.
|
|
|
(c) Steinmetz M. G. Chem. Rev. 1995, 95, 1527.
doi: 10.1021/cr00037a017 |
|
|
(d) Brix T.; Bastian E.; Potzinger P. J. J. Photochem. Photobiol. A 1989, 49, 287.
doi: 10.1016/1010-6030(89)87127-8 |
|
| [7] |
Matsumoto A.; Ito Y. J. Org. Chem. 2000, 65, 5707.
pmid: 10970314 |
| [8] |
Chatgilialoglu C.; Ingold K. U.; Scaiano J. C.; Woynar H. J. Am. Chem. Soc. 1981, 103, 3231.
doi: 10.1021/ja00401a060 |
| [9] |
(a) Chatgilialoglu C.; Scaiano J. C.; Ingold K. U. Organometallics 1982, 1, 466.
doi: 10.1021/om00063a009 |
|
(b) Lalev¦e J.; Allonas X.; Fouassier J. P. J. Org. Chem. 2007, 72, 6434.
doi: 10.1021/jo0706473 |
|
| [10] |
(a) Lykakis I. N.; Evgenidou E.; Orfanopoulos M. Curr. Org. Chem. 2012, 16, 2400.
doi: 10.2174/138527212803520092 |
|
(b) Hill C. L. J. Mol. Catal. A 2007, 262, 2.
doi: 10.1016/j.molcata.2006.08.042 |
|
|
(c) Renneke R. F.; Hill C. L. J. Am. Chem. Soc. 1986, 108, 3528.
doi: 10.1021/ja00272a069 |
|
| [11] |
(a) Fagnoni M.; Dondi D.; Ravelli D.; Albini A. Chem. Rev. 2007, 107, 2725.
doi: 10.1021/cr068352x pmid: 19551179 |
|
(b) Ravelli D.; Dondi D.; Fagnoni M.; Albini A. Chem. Soc. Rev. 2009, 38, 1999.
doi: 10.1039/b714786b pmid: 19551179 |
|
| [12] |
(a) Dondi D.; Fagnoni M.; Albini A. Chem. Eur. J. 2006, 12, 4153.
doi: 10.1002/chem.v12:15 |
|
(b) Tzirakis M. D.; Orfanopoulos M. J. Am. Chem. Soc. 2009, 131, 406.
doi: 10.1021/ja808310u |
|
|
(c) Tzirakis M. D.; Orfanopoulos M. Angew. Chem., Int. Ed. 2010, 49, 5891.
doi: 10.1002/anie.v49:34 |
|
|
(d) Qrareya H.; Ravelli D.; Fagnoni M.; Albini A. Adv. Synth. Catal. 2013, 355, 2891.
doi: 10.1002/adsc.v355.14/15 |
|
| [13] |
Ryu I.; Tani A.; Fukuyama T.; Ravelli D.; Montanaro S.; Fagnoni M. Org. Lett. 2013, 15, 2554.
doi: 10.1021/ol401061v |
| [14] |
Halperin S. D.; Fan H.; Chang S.; Martin R. E.; Britton R. Angew. Chem., Int. Ed. 2014, 53, 4690.
doi: 10.1002/anie.v53.18 |
| [15] |
Laleve J.; Blanchard N.; Tehfe M.-A.; Fouassier J. P. Macromol. Rapid. Commun. 2011, 32, 838.
doi: 10.1002/marc.v32.11 |
| [16] |
Qrareya H.; Dondi D.; Ravelli D.; Fagnoni M. ChemCatChem 2015, 7, 3350.
doi: 10.1002/cctc.v7.20 |
| [17] |
(a) Capaldo L.; Ravelli D. Eur. J. Org. Chem. 2017, 2056.
pmid: 19551179 |
|
(b) Protti S.; Fagnoni M.; Ravelli D. ChemCatChem 2015, 7, 1516.
doi: 10.1002/cctc.v7.10 pmid: 19551179 |
|
|
(c) Ravelli D.; Dondi D.; Fagnoni M.; Albini A. Chem. Soc. Rev. 2009, 38, 1999.
doi: 10.1039/b714786b pmid: 19551179 |
|
|
(d) Fagnoni M.; Dondi D.; Ravelli D.; Albini A. Chem. Rev. 2007, 107, 2725.
doi: 10.1021/cr068352x pmid: 19551179 |
|
| [18] |
(a) Salamone M.; Bietti M. Acc. Chem. Res. 2015, 48, 2895.
doi: 10.1021/acs.accounts.5b00348 |
|
(b) Roberts B. P. Chem. Soc. Rev. 1999, 28, 25.
doi: 10.1039/a804291h |
|
| [19] |
(a) Le C.; Liang Y.; Evans R. W.; Li X.; MacMillan D. W. C. Nature 2017, 547, 79.
doi: 10.1038/nature22813 pmid: 26316601 |
|
(b) Shaw M. H.; Shurtleff V. W.; Terrett J. A.; Cuthbertson J. D.; MacMillan D. W. C. Science 2016, 352, 1304.
pmid: 26316601 |
|
|
(c) Jeffrey J. L.; Terrett J. A.; MacMillan D. W. C. Science 2015, 349, 1532.
doi: 10.1126/science.aac8555 pmid: 26316601 |
|
| [20] |
Zhou R.; Goh Y. Y.; Liu H.; Tao H.; Li L.; Wu J. Angew. Chem., Int. Ed. 2017, 56, 16621.
doi: 10.1002/anie.v56.52 |
| [21] |
Zhu J.; Cui W.-C.; Wang S. Z.; Yao Z.-J. J. Org. Chem. 2018, 83, 14600.
doi: 10.1021/acs.joc.8b02409 |
| [22] |
Cai Y. Y.; Zhao W. X.; Wang S. Z.; Liang T.; Yao Z. J. Org. Lett. 2019, 21, 9836.
doi: 10.1021/acs.orglett.9b03679 |
| [23] |
Luo C.; Lu W.-H.; Wang G.-Q.; Zhang Z.-B.; Li H.-Q.; Han P.; Yang D.; Jing L.-H.; Wang C. J. Org. Chem. 2022, 87, 3567.
doi: 10.1021/acs.joc.1c03125 |
| [24] |
(a) Yamamoto Y. Chem. Rev. 2012, 112, 4736.
doi: 10.1021/cr300050n pmid: 11848754 |
|
(b) Felix R. J.; Munro-Leighton C.; Gagne M. R. Acc. Chem. Res. 2014, 47, 2319.
doi: 10.1021/ar500047j pmid: 11848754 |
|
|
(c) Widenhoefer R. A. Acc. Chem. Res. 2002, 35, 905.
doi: 10.1021/ar010040n pmid: 11848754 |
|
|
(d) Ojima I.; Tzamarioudaki M.; Li Z.; Donovan R. J. Chem. Rev. 1996, 96, 635.
pmid: 11848754 |
|
|
(e) Malacria M. Chem. Rev. 1996, 96, 289.
doi: 10.1021/cr9500186 pmid: 11848754 |
|
|
(f) Curran D. P. In Comprehensive Organic Synthesis, Vol. 4, Eds.: Trost, B. M.; Fleming, I.; Semmelhack, M. F., Pergamon, Oxford, 1991, pp. 818-827.
pmid: 11848754 |
|
| [25] |
(a) Beckwith A. L. J.; Schiesser C. H. Tetrahedron Lett. 1985, 26, 273.
doi: 10.1016/0040-4020(70)85028-1 |
|
(b) Spellmeyer D. C.; Houk K. N. J. Org. Chem. 1987, 52, 959.
doi: 10.1021/jo00382a001 |
|
| [26] |
Cui W.-C.; Zhao W. X.; Gao M. Liu W.; Wang S. Z.; Liang Y.; Yao Z.-J. Chem. Eur. J. 2019, 25, 16506.
doi: 10.1002/chem.v25.72 |
| [27] |
Hou H.; Xu Y.; Yang H. B.; Chen X. Y.; Yan C. G.; Shi Y. C.; Zhu S. Q. Org. Lett. 2020, 22, 1748.
doi: 10.1021/acs.orglett.0c00024 |
| [28] |
(a) Hou J.; Ee A.; Cao H.; Ong H.-W.; Xu J.-H.; Wu J. Angew. Chem., Int. Ed. 2018, 57, 17220.
doi: 10.1002/anie.v57.52 |
|
(b) Yu W. L.; Luo Y. C.; Yan L.; Liu D.; Wang Z. Y.; Xu P. F. Angew. Chem., Int. Ed. 2019, 58, 10941.
doi: 10.1002/anie.v58.32 |
|
| [29] |
Zhang Z. K.; Hu X. L. ACS Catal. 2020, 10, 777.
doi: 10.1021/acscatal.9b04916 |
| [30] |
Neogi S.; Ghosh A. K.; Mandal S.; Ghosh D.; Ghosh S.; Hajra A. Org. Lett. 2021, 23, 6510.
doi: 10.1021/acs.orglett.1c02322 |
| [31] |
(a) Fried J.; Sabo E. J. Am. Chem. Soc. 1954, 76, 1455.
|
|
(b) Inoue M.; Sumii Y.; Shibata N. ACS Omega 2020, 5, 10633.
doi: 10.1021/acsomega.0c00830 |
|
|
(c) Ogawa Y.; Tokunaga E.; Kobayashi O.; Hirai K.; Shibata N. iScience 2020, 23, 101467.
doi: 10.1016/j.isci.2020.101467 |
|
| [32] |
(a) Moore W. R.; Schatzman G. L.; Jarvi E. T.; Gross R. S.; McCarthy J. R. J. Am. Chem. Soc. 1992, 114, 360.
doi: 10.1021/ja00027a056 |
|
(b) Lim M. H.; Kim H. O.; Moon H. R.; Chun M. W.; Jeong L. S. Org. Lett. 2002, 4, 529.
doi: 10.1021/ol017112v |
|
|
(c) Pan Y.; Qiu J.; Silverman R. B. J. Med. Chem. 2003, 46, 5292.
doi: 10.1021/jm034162s |
|
| [33] |
(a) Barroso G.; Li Q.; Bordia R. K.; Motz G. J. Mater. Chem. A 2019, 7, 1936.
doi: 10.1039/c8ta09054h |
|
(b) Deyko G. S.; Glukhov L. M.; Kustov L. M. Int. J. Hydrogen Energy 2020, 45, 33807.
doi: 10.1016/j.ijhydene.2020.09.107 |
|
|
(c) Guillot S. L.; Usrey M. L.; Peña-Hueso A.; Kerber B. M.; Zhou L.; Du P.; Johnson T. J. Electrochem. Soc. 2021, 168, 030533.
doi: 10.1149/1945-7111/abed25 |
|
| [34] |
Yue F. Y.; Liu J. H.; Ma H.; Liu Y. X.; Dong J. Y.; Wang Q. M. Org. Lett. 2022, 24, 4019.
doi: 10.1021/acs.orglett.2c01448 |
| [35] |
Luo C.; Zhou Y.; Chen H.; Wang T.; Zhang Z.-B.; Han P.; Jing L.-H. Org. Lett. 2022, 24, 4286.
doi: 10.1021/acs.orglett.2c01690 |
| [36] |
(a) Chan T. H.; Fleming I. Synthesis 1979, 761.
pmid: 19421982 |
|
(b) Blumenkopf T. A.; Overman L. E. Chem. Rev. 1986, 86, 857.
doi: 10.1021/cr00075a009 pmid: 19421982 |
|
|
(c) Langkopf E.; Schinzer D. Chem. Rev. 1995, 95, 1375.
doi: 10.1021/cr00037a011 pmid: 19421982 |
|
|
(d) Fleming I.; Barbero A.; Walter D. Chem. Rev. 1997, 97, 2063.
pmid: 19421982 |
|
|
(e) Curtis-Long M. J.; Aye Y. Chem.-Eur. J. 2009, 15, 5402.
doi: 10.1002/chem.200900337 pmid: 19421982 |
|
|
(f) Szudkowska-Fra̧tczak J.; Hreczycho G.; Pawluć P. Org. Chem. Front. 2015, 2, 730.
doi: 10.1039/C5QO00018A pmid: 19421982 |
|
| [37] |
(a) Albini A.; Fagnoni M. Hydrosilylation: A Comprehensive Review on Recent Advances, Springer, Berlin, 2009.
|
|
(b) Trost B. M.; Ball Z. T. Synthesis 2005, 853.
|
|
|
(c) Lim D. S. W.; Anderson E. A. Synthesis 2012, 44, 983.
doi: 10.1055/s-0031-1289729 |
|
|
(d) Sun J.; Deng L. ACS Catal. 2016, 6, 290.
doi: 10.1021/acscatal.5b02308 |
|
| [38] |
Zhu J.; Cui W.-C.; Wang S. Z.; Yao Z.-J. Org. Lett. 2018, 20, 3174.
doi: 10.1021/acs.orglett.8b00909 |
| [39] |
Liang H.; Ji Y.-X.; Wang R.-H.; Zhang Z.-H.; Zhang B. Org. Lett. 2019, 21, 2750.
doi: 10.1021/acs.orglett.9b00701 pmid: 30931573 |
| [40] |
For selected reviews, please see: (b) Pooni P. K.; Showell G. A. Mini-Rev. Med. Chem. 2006, 6, 1169.
pmid: 29039662 |
|
(b) Franz A. K.; Wilson S. O. J. Med. Chem. 2013, 56, 388.
doi: 10.1021/jm3010114 pmid: 29039662 |
|
|
(c) Ramesh R.; Reddy D. S. J. Med. Chem. 2018, 61, 3779.
doi: 10.1021/acs.jmedchem.7b00718 pmid: 29039662 |
|
| [41] |
(a) Denmark S. E.; Kallemeyn J. M. Org. Lett. 2003, 5, 3483.
pmid: 12967305 |
|
(b) Hamze A.; Provot O.; Alami M.; Brion J.-D. Org. Lett. 2006, 8, 931.
doi: 10.1021/ol052996u pmid: 12967305 |
|
|
(c) Guo L.; Chatupheeraphat A.; Rueping M. Angew. Chem., Int. Ed., 2016, 55, 11810.
doi: 10.1002/anie.v55.39 pmid: 12967305 |
|
| [42] |
(a) Toutov A. A. Liu W.-B.; Betz K. N.; Fedorov A. Stoltz B. M.; Grubbs R. H. Nature 2015, 518, 80.
doi: 10.1038/nature14126 |
|
(b) Liu W.-B.; Schuman D. P.; Yang Y.-F.; Toutov A. A.; Liang Y.; Klare H. F. T.; Nesnas N.; Oestreich M.; Blackmond D. G.; Virgil S. C.; Banerjee S.; Zare R. N.; Grubbs R. H.; Houk K. N.; Stoltz B. M. J. Am. Chem. Soc. 2017, 139, 6867.
doi: 10.1021/jacs.6b13031 |
|
| [43] |
Liu S. H.; Pan P.; Fan H. Q.; Li H.; Wang W.; Zhang Y. Q. Chem. Sci. 2019, 10, 3817.
doi: 10.1039/C9SC00046A |
| [44] |
Yang C.; Wang J.; Li J. H.; Ma W. C.; An K.; He W.; Jiang C. Adv. Synth. Catal. 2018, 360, 3049.
doi: 10.1002/adsc.v360.16 |
| [45] |
(a) Yu M. M.; Jing H. Z.; Liu X.; Fu X. F. Organometallics 2015, 34, 5754.
doi: 10.1021/acs.organomet.5b00521 |
|
(b) Urayama T.; Mitsudome T.; Maeno Z.; Mizugaki T.; Jitsukawa K.; Kaneda K. Chem. Lett. 2015, 44, 1062.
doi: 10.1246/cl.150379 |
|
|
(c) Lin J.-D.; Bi Q.-Y.; Tao L.; Jiang T.; Liu Y.-M.; He H.-Y.; Cao Y.; Wang Y.-D. ACS Catal. 2017, 7, 1720.
doi: 10.1021/acscatal.6b03233 |
|
| [46] |
Rammal F.; Gao D.; Boujnah S.; Hussein A. A.; Lalevée J.; Gaumont A.-C.; Morlet-Savary F.; Lakhdar S. ACS Catal. 2020, 10, 13710.
doi: 10.1021/acscatal.0c03726 |
| [47] |
Dai C. H.; Zhan Y. L.; Liu P.; Sun P. P. Green Chem. 2021, 23, 314.
doi: 10.1039/D0GC03697H |
| [48] |
Zhang W. J.; Lu Q.; Wang M. S.; Zhang Y. J.; Xia X.-F.; Wang D. W. Org. Lett. 2022, 24, 3797.
doi: 10.1021/acs.orglett.2c01330 |
| [49] |
(a) Mizuno K. Tetrahedron Lett. 1989, 30, 3689.
|
|
(b) Kako M.; Morita T.; Torihara T.; Nakadaira Y. J. Chem. Soc., Chem. Commun. 1993, 1993, 678.
|
|
|
(c) Mizuno K.; Nakanishi K.; Chosa J. I.; Otsuji Y. J. Organomet. Chem. 1994, 473, 35.
doi: 10.1016/0022-328X(94)80103-7 |
|
| [50] |
Liu R. F.; Chia S. P. M.; Goh Y. Y.; Cheo H. W.; Fan B. B.; Li R. F.; Zhou R.; Wu J. Eur. J. Org. Chem. 2020, 1459.
|
| [51] |
Yu X. Y.; Lübbesmeyer M.; Studer A. Angew. Chem., Int. Ed. 2021, 60, 675.
doi: 10.1002/anie.v60.2 |
| [52] |
Yu X. Y.; Daniliuc C. G.; Alasmary F. A; Studer A. Angew. Chem., Int. Ed. 2021, 60, 23335.
doi: 10.1002/anie.v60.43 |
| [53] |
Matsumoto A.; Ito A. J. Org. Chem. 2000, 65, 5707.
pmid: 10970314 |
| [54] |
Zhong M.; Pannecoucke X.; Jubault P.; Poisson T. Chem. - Eur. J. 2021, 27, 11818.
doi: 10.1002/chem.v27.46 |
| [55] |
Takemura N.; Sumida Y.; Ohmiya H. ACS Catal. 2022, 12, 7804.
doi: 10.1021/acscatal.2c01964 |
| [56] |
Xu N. X.; Li B. X.; Wang C.; Uchiyama M. Angew. Chem., Int. Ed. 2020, 59, 10639.
doi: 10.1002/anie.v59.26 |
| [57] |
Chen F. J.; Shao Y. X.; Li M. K.; Yang C.; Su S. J.; Jiang H. F.; Ke Z. F.; Zeng W. Nat. Commun. 2021, 12, 3304.
doi: 10.1038/s41467-021-23326-2 |
| [58] |
Iwamoto T.; Sato K.; Ishida S.; Kabuto C.; Kira M. J. Am. Chem. Soc. 2006, 128, 16914.
doi: 10.1021/ja065774f |
| [59] |
Tang Z.; Chen F. J.; Huang G. J.; Li Y. K.; Jiang H. F.; Zeng W. Org. Lett. 2023, 25, 2846.
doi: 10.1021/acs.orglett.3c00813 |
| [1] | 童红恩, 郭宏宇, 周荣. 可见光促进惰性碳-氢键对羰基的加成反应进展[J]. 有机化学, 2024, 44(1): 54-69. |
| [2] | 朱彦硕, 王红言, 舒朋华, 张克娜, 王琪琳. 烷氧自由基引发1,5-氢原子转移实现C(sp3)—H键官能团化的研究进展[J]. 有机化学, 2024, 44(1): 1-17. |
| [3] | 杨晓娜, 郭宏宇, 周荣. 可见光促进有机硅化合物参与的化学转化[J]. 有机化学, 2023, 43(8): 2720-2742. |
| [4] | 赵瑜, 张凯, 白育斌, 张琰图, 史时辉. 无金属条件下可见光催化与溴盐协同促进烯烃的氢硅化反应研究[J]. 有机化学, 2023, 43(8): 2837-2847. |
| [5] | 高艳华, 张银潘, 张妍, 宋涛, 杨勇. 可见光驱动表面富含氧空位Nb2O5催化醇氧化反应[J]. 有机化学, 2023, 43(7): 2572-2579. |
| [6] | 赵金晓, 魏彤辉, 柯森, 李毅. 可见光催化合成二氟烷基取代的多环吲哚化合物[J]. 有机化学, 2023, 43(3): 1102-1114. |
| [7] | 赵瑜, 段玉荣, 史时辉, 白育斌, 黄亮珠, 杨晓军, 张琰图, 冯彬, 张建波, 张秋禹. 可见光促进高价碘(III)试剂参与反应的研究进展[J]. 有机化学, 2023, 43(12): 4106-4140. |
| [8] | 郭广青, 练仲. 硅基羧酸在有机合成中的应用进展[J]. 有机化学, 2023, 43(10): 3580-3589. |
| [9] | 朱佳洁, 万义, 袁启洋, 魏金莲, 张永强. 可见光/路易斯碱协同催化的三氟甲基取代烯烃脱氟硅化反应研究[J]. 有机化学, 2023, 43(10): 3623-3634. |
| [10] | 潘振涛, 刘彤, 马永敏, 颜剑波, 王亚军. 布朗斯特酸/可见光氧化还原接力催化构建喹唑啉(硫)酮[J]. 有机化学, 2022, 42(9): 2823-2831. |
| [11] | 李亚东, 吴鹏举, 杨志勇. 可见光催化苯并噁唑与α-酮酸合成芳基苯并噁唑[J]. 有机化学, 2022, 42(6): 1770-1777. |
| [12] | 孙天义, 张依凡, 孟远倢, 王怡, 朱琦峰, 姜玉新, 刘石惠. 可见光-铜共催化的糖类区域选择性氧烷基化反应[J]. 有机化学, 2022, 42(5): 1414-1422. |
| [13] | 潘鹏, 袁启洋, 刘石惠, 赵建宏, 张永强. 奎宁环促进的缺电性含氮芳杂环碳氢硅基化反应研究[J]. 有机化学, 2022, 42(4): 1136-1145. |
| [14] | 李猛, 赵冬阳, 孙凯. 可见光驱动基团迁移引发的烯烃双官能团化反应[J]. 有机化学, 2022, 42(12): 4152-4168. |
| [15] | 赵成军, 白治琴, 何建, 刘强. 吡唑化提高喹喔啉酮敏化效率: 氮杂环丁烷的合成及进一步开环反应[J]. 有机化学, 2022, 42(12): 4300-4314. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||