有机化学 ›› 2024, Vol. 44 ›› Issue (4): 1226-1239.DOI: 10.6023/cjoc202311001 上一篇 下一篇
研究论文
李晓勇, 黄丹凤*( ), 周玉秀, 刘小康, 王克虎, 王君娇, 胡雨来*(
), 周玉秀, 刘小康, 王克虎, 王君娇, 胡雨来*( )
)
收稿日期:2023-11-01
修回日期:2023-12-11
发布日期:2023-12-28
基金资助:
Xiaoyong Li, Danfeng Huang( ), Yuxiu Zhou, Xiaokang Liu, Kehu Wang, Junjiao Wang, Yulai Hu(
), Yuxiu Zhou, Xiaokang Liu, Kehu Wang, Junjiao Wang, Yulai Hu( )
)
Received:2023-11-01
Revised:2023-12-11
Published:2023-12-28
Contact:
E-mail: Supported by:文章分享

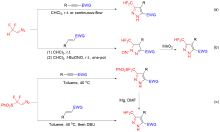
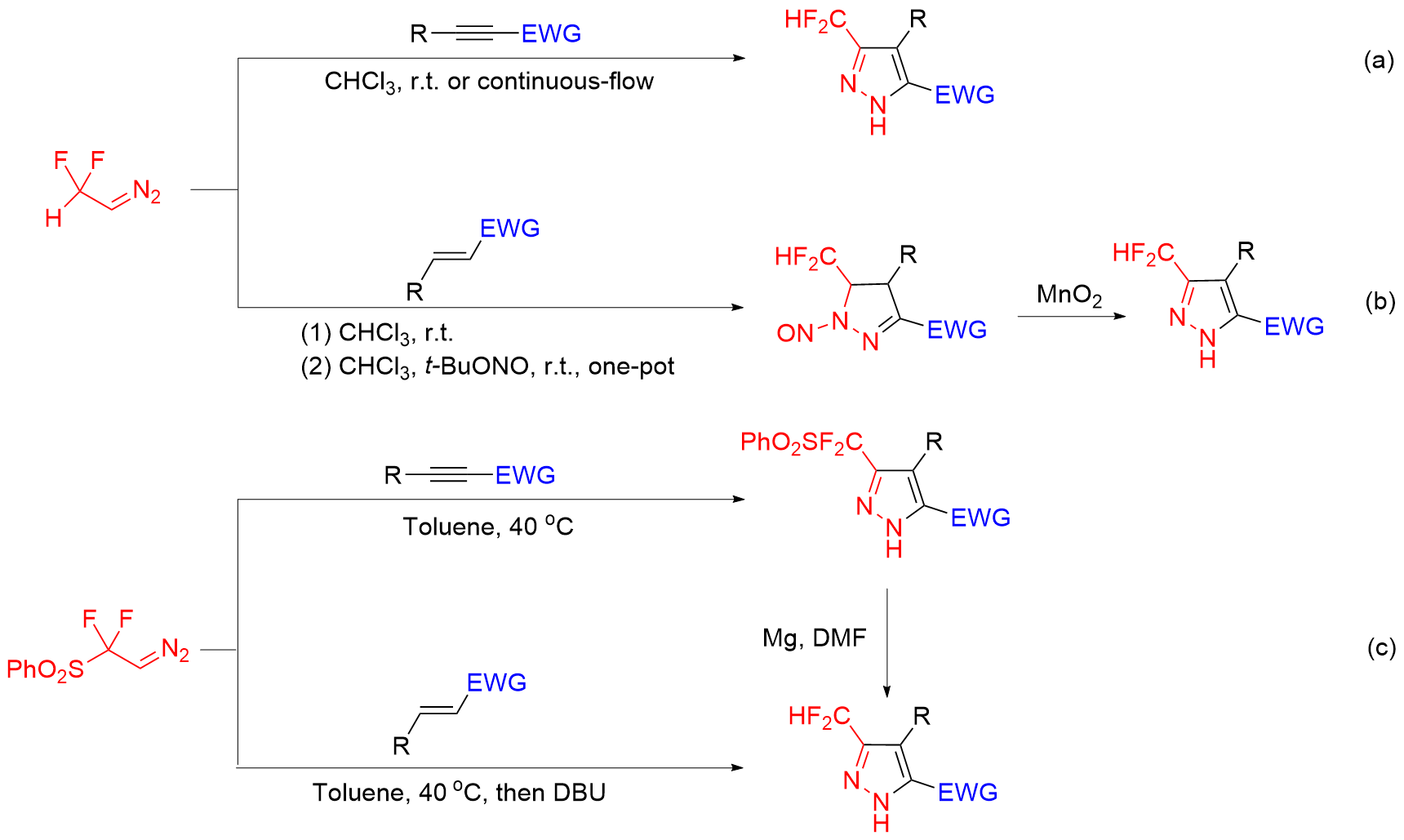
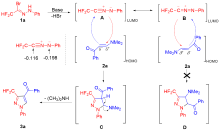
报道了在碱存在下, 由二氟甲基溴代腙原位生成的二氟甲基腈亚胺与β-(N,N-二甲氨基)烯酮/丙烯酸酯/丙烯酰胺的[3+2]环化反应. 该反应首先产生了一个吡唑啉中间体, 然后从该中间体上自发消除一分子二甲胺, 最后以中等至良好的产率得到了一系列3,4-二取代-3-二氟甲基吡唑类化合物. 该反应具有高度的区域选择性: 即它是由1,3-偶极体的最低空轨道和富电子烯烃的最高占有轨道相互作用的反电子需求的环加成反应. 该方法拓展了二氟甲基腈亚胺参与的[3+2]环化反应的类型, 提供了一种简单、高效地合成3,4-二取代-3-二氟甲基吡唑类化合物的新方法.
李晓勇, 黄丹凤, 周玉秀, 刘小康, 王克虎, 王君娇, 胡雨来. 二氟甲基溴代腙与β-(N,N-二甲氨基)烯酮/丙烯酸酯/丙烯酰胺的[3+2]环化反应研究[J]. 有机化学, 2024, 44(4): 1226-1239.
Xiaoyong Li, Danfeng Huang, Yuxiu Zhou, Xiaokang Liu, Kehu Wang, Junjiao Wang, Yulai Hu. [3+2] Cyclization of Difluoroacetohydrazonoyl Bromides with β-(N,N-Dimethylamino)enones/Enoates/Enamides[J]. Chinese Journal of Organic Chemistry, 2024, 44(4): 1226-1239.
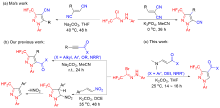

| Entry | Mole ratio of 1a/2a/base | Base | Solvent | Time/h | Temp./℃ | Isolated yield/% | |
|---|---|---|---|---|---|---|---|
| 1 | 1.0/1.0/1.0 | K2CO3 | THF | 12 | 25 | 70 | |
| 2 | 1.2/1.0/1.2 | K2CO3 | THF | 12 | 25 | 75 | |
| 3 | 1.2/1.0/1.5 | K2CO3 | THF | 12 | 25 | 72 | |
| 4 | 1.5/1.0/1.5 | K2CO3 | THF | 14 | 25 | 84 | |
| 5 | 1.5/1.0/2.0 | K2CO3 | THF | 14 | 25 | 76 | |
| 6 | 1.5/1.0/1.5 | K2CO3 | 1,4-Dioxane | 72 | 25 | 60 | |
| 7 | 1.5/1.0/1.5 | K2CO3 | Toluene | 72 | 25 | 44 | |
| 8 | 1.5/1.0/1.5 | K2CO3 | DCM | 48 | 25 | 73 | |
| 9 | 1.5/1.0/1.5 | K2CO3 | DCE | 48 | 25 | 74 | |
| 10 | 1.5/1.0/1.5 | K2CO3 | EtOH | 72 | 25 | 50 | |
| 11 | 1.5/1.0/1.5 | K2CO3 | MeCN | 14 | 25 | 72 | |
| 12 | 1.5/1.0/1.5 | Na2CO3 | THF | 24 | 25 | 69 | |
| 13 | 1.5/1.0/1.5 | Cs2CO3 | THF | 14 | 25 | 45 | |
| 14 | 1.5/1.0/1.5 | NaHCO3 | THF | 30 | 25 | 30 | |
| 15 | 1.5/1.0/1.5 | Et3N | THF | 30 | 25 | 35 | |
| 16 | 1.5/1.0/1.5 | DBU | THF | 30 | 25 | Trace | |
| 17 | 1.5/1.0/1.5 | K2CO3 | THF | 20 | 0 | 74 | |
| 18 | 1.5/1.0/1.5 | K2CO3 | THF | 8 | 40 | 70 | |
| Entry | Mole ratio of 1a/2a/base | Base | Solvent | Time/h | Temp./℃ | Isolated yield/% | |
|---|---|---|---|---|---|---|---|
| 1 | 1.0/1.0/1.0 | K2CO3 | THF | 12 | 25 | 70 | |
| 2 | 1.2/1.0/1.2 | K2CO3 | THF | 12 | 25 | 75 | |
| 3 | 1.2/1.0/1.5 | K2CO3 | THF | 12 | 25 | 72 | |
| 4 | 1.5/1.0/1.5 | K2CO3 | THF | 14 | 25 | 84 | |
| 5 | 1.5/1.0/2.0 | K2CO3 | THF | 14 | 25 | 76 | |
| 6 | 1.5/1.0/1.5 | K2CO3 | 1,4-Dioxane | 72 | 25 | 60 | |
| 7 | 1.5/1.0/1.5 | K2CO3 | Toluene | 72 | 25 | 44 | |
| 8 | 1.5/1.0/1.5 | K2CO3 | DCM | 48 | 25 | 73 | |
| 9 | 1.5/1.0/1.5 | K2CO3 | DCE | 48 | 25 | 74 | |
| 10 | 1.5/1.0/1.5 | K2CO3 | EtOH | 72 | 25 | 50 | |
| 11 | 1.5/1.0/1.5 | K2CO3 | MeCN | 14 | 25 | 72 | |
| 12 | 1.5/1.0/1.5 | Na2CO3 | THF | 24 | 25 | 69 | |
| 13 | 1.5/1.0/1.5 | Cs2CO3 | THF | 14 | 25 | 45 | |
| 14 | 1.5/1.0/1.5 | NaHCO3 | THF | 30 | 25 | 30 | |
| 15 | 1.5/1.0/1.5 | Et3N | THF | 30 | 25 | 35 | |
| 16 | 1.5/1.0/1.5 | DBU | THF | 30 | 25 | Trace | |
| 17 | 1.5/1.0/1.5 | K2CO3 | THF | 20 | 0 | 74 | |
| 18 | 1.5/1.0/1.5 | K2CO3 | THF | 8 | 40 | 70 | |

| [1] |
(a) Mykhailiuk P. K. Chem. Rev. 2021, 121, 1670.
doi: 10.1021/acs.chemrev.0c01015 pmid: 33382252 |
|
(b) Ogawa Y.; Tokunaga E.; Kobayashi O.; Hirai K.; Shibata N. iScience 2020, 23, 101467.
doi: 10.1016/j.isci.2020.101467 pmid: 33382252 |
|
|
(c) Du S.; Tian Z.; Yang D.; Li X.; Li H.; Jia C.; Wang M.; Qin Z. Molecules 2015, 20, 8395.
doi: 10.3390/molecules20058395 pmid: 33382252 |
|
| [2] |
Yossi Z.; Sod-Moriah G.; Yeffet D.; Berliner A.; Amir D.; Gershonov E. J. Med. Chem. 2019, 62, 5628.
doi: 10.1021/acs.jmedchem.9b00604 |
| [3] |
Mcloughlin J. I.; Louis St.; Metz S. C. US 2005223526, 1992.
|
| [4] |
(a) Qiu S.-S.; Bai Y.-L. Modern Agrochem. 2015, 14, 1. (in Chinese)
|
|
(仇是胜, 柏亚罗, 现代农药, 2015, 14, 1.)
|
|
|
(b) Qiu S.-S.; Bai Y.-L. Modern Agrochem. 2014, 13, 1. (in Chinese)
|
|
|
(仇是胜, 柏亚罗, 现代农药, 2014, 13, 1.)
|
|
|
(c) Jorges W.; Heinrich J. D.; Lantzsch R.WO 2006024388, 2006.
|
|
|
(d) Gewehr M.; Dietz J.; Blettner C.; Grammenos W.WO 2006087343, 2006.
|
|
|
(e) Ehrenfreund J.; Tobler H.; Walter H.WO 2004035589, 2004.
|
|
|
(f) Ehrenfreund J.; Tobler H.; Walter H.WO 03074491, 2003.
|
|
| [5] |
(a) McMillan S. K.; Boria P.; Moore G. E.; Widmer W. R.; Bonney P. L.; Knapp D. W. J. Am. Vet. Med. Assoc. 2011, 239, 1084.
doi: 10.2460/javma.239.8.1084 pmid: 9135032 |
|
(b) Penning T. D.; Talley J. J.; Bertenshaw S. R.; Carter J. S.; Collins P. W.; Docter S.; Graneto M. J.; Zhang Y. Y.; Isakson P. C. J. Med. Chem. 1997, 40, 1347.
pmid: 9135032 |
|
| [6] |
(a) Zeng J.; Xu Z; Ma J.-A. Chin. J. Org. Chem. 2020, 40, 1105. (in Chinese)
doi: 10.6023/cjoc201912024 pmid: 21806021 |
|
(曾俊良, 许志红, 马军安, 有机化学, 2020, 40, 1105.)
doi: 10.6023/cjoc201912024 pmid: 21806021 |
|
|
(b) Fustero S.; Sánchez-Roselló M.; Barrio P.; Simán-Fuentes A. Chem. Rev. 2011, 111, 6984.
doi: 10.1021/cr2000459 pmid: 21806021 |
|
| [7] |
Sakamoto R.; Kashiwagi H.; Maruoka K. Org. Lett. 2017, 19, 5126.
doi: 10.1021/acs.orglett.7b02416 pmid: 28898083 |
| [8] |
Bacauanu V.; Cardinal S.; Yamauchi M.; Kondo M.; Fernandez D. F.; Remy R.; Macmillan D. W. C. Angew. Chem., Int. Ed. 2018, 57, 12543.
doi: 10.1002/anie.201807629 pmid: 30067304 |
| [9] |
Giornal F.; Pazenok S.; Rodefeld L.; Lui N.; Vors J.-P.; Leroux F. R. J. Fluorine Chem. 2013, 152, 2.
doi: 10.1016/j.jfluchem.2012.11.008 |
| [10] |
(a) Das A.; Ishitani H.; Kobayashi S. Adv. Synth. Catal. 2019, 361, 5127.
doi: 10.1002/adsc.v361.22 |
|
(b) Qiao L.; Zhai Z. W.; Cai P. P.; Tan C. X.; Weng J. Q.; Han L.; Liu X. H.; Zhang Y. G. J. Heterocycl. Chem. 2019, 56, 2536.
doi: 10.1002/jhet.v56.9 |
|
| [11] |
(a) Herrera A. G.; Schmitt E.; Panossian A.; Vors J.-P.; Pazenok S.; Leroux F. R. J. Fluorine Chem. 2018, 214, 17.
doi: 10.1016/j.jfluchem.2018.07.010 |
|
(b) Iminov R. T.; Mashkov A. V.; Vyzir I. I.; Chalyk B. A.; Tverdokhlebov A. V.; Mykhailiuk P. K.; Babichenko L. N.; Tolmachev A. A.; Volovenko Y. M.; Biitseva A. Eur. J. Org. Chem. 2015, 2015, 886.
doi: 10.1002/ejoc.v2015.4 |
|
|
(c) Wan C.; Pang J. Y.; Jiang W.; Zhang X. W.; Hu X. G. J. Org. Chem. 2021, 86, 4557.
doi: 10.1021/acs.joc.0c02980 |
|
| [12] |
(a) Hamper B. C. J. Fluorine Chem. 1990, 48, 123.
doi: 10.1016/S0022-1139(00)82607-X |
|
(b) Linderman R. J.; Kirollos K. S. Tetrahedron Lett. 1989, 30, 2049.
doi: 10.1016/S0040-4039(01)93708-6 |
|
| [13] |
Sosnovskikh V. Y.; Irgashev R. A.; Moshkin V. S.; Kodess M. I. Russ. Chem. Bull. 2008, 57, 2146.
doi: 10.1007/s11172-008-0291-5 |
| [14] |
(a) Nett M.; Grote T.; Lohmann J. K.; Dietz J.; Smidt S. P.; Rack M.; Zierke T.WO 2008152138, 2008.
|
|
(b) Lantzsch R.; Wolfgang J.; Pazenok S.WO 2005042468, 2004.
|
|
| [15] |
Mykhailiuk P. K. Angew. Chem., Int. Ed. 2015, 54, 6558.
doi: 10.1002/anie.201501529 pmid: 25801346 |
| [16] |
Mertens L.; Hock K. J.; Koenigs R. M. Chem.-Eur. J. 2016, 22, 9542.
doi: 10.1002/chem.201601707 pmid: 27168358 |
| [17] |
(a) Britton J.; Jamison T. F. Angew. Chem., Int. Ed. 2017, 56, 8823.
doi: 10.1002/anie.201704529 pmid: 28544160 |
|
(b) Britton J.; Jamison T. F. Eur. J. Org. Chem. 2017, 2017, 6566.
doi: 10.1002/ejoc.v2017.44 pmid: 28544160 |
|
| [18] |
(a) Lebed P. S.; Fenneteau J.; Wu Y.; Cossy J.; Mykhailiuk P. K. Eur. J. Org. Chem. 2017, 2017, 6114.
doi: 10.1002/ejoc.v2017.41 |
|
(b) Li J.; Yu X. L.; Cossy J.; Lv S. Y.; Zhang H. L.; Su F.; Mykhailiuk P. K.; Wu Y. Eur. J. Org. Chem. 2017, 2017, 266.
doi: 10.1002/ejoc.v2017.2 |
|
| [19] |
Zeng J. L.; Chen Z.; Zhang F. G.; Ma J.-A. Org. Lett. 2018, 20, 4562.
doi: 10.1021/acs.orglett.8b01854 |
| [20] |
(a) Kowalczyk A.; Utecht-Jarzyńska G.; Mlostoń G.; Jasiński M. Org. Lett. 2022, 24, 2499.
doi: 10.1021/acs.orglett.2c00521 pmid: 35343703 |
|
(b) Wang K.-H.; Liu H.; Liu X.; Bian C.; Wang J.; Su Y.; Huang D.; Hu Y. Asian J. Org. Chem. 2022, 11, e202200103.
doi: 10.1002/ajoc.v11.6 pmid: 35343703 |
|
|
(c) Tian Y.; Li J; Zhang F.; Ma J.-A. Adv. Synth. Catal. 2021, 363, 2093.
doi: 10.1002/adsc.v363.8 pmid: 35343703 |
|
| [21] |
Zhou Y.; Gao C. F.; Ma H.; Nie J.; Ma J.-A.; Zhang F. G. Chem. Asian J. 2022, 17, e202200436.
doi: 10.1002/asia.v17.15 |
| [22] |
(a) Han T.; Wang K.-H.; Yang M.; Zhao P.; Wang F.; Wang J.; Huang D.; Hu Y. J. Org. Chem. 2022, 87, 498.
doi: 10.1021/acs.joc.1c02521 |
|
(b) Ren Y.; Ma R.; Feng Y.; Wang K.-H.; Wang J.; Huang D.; Lv X.; Hu Y. Asian J. Org. Chem. 2022, e202200438.
|
|
| [23] |
Ren Y.; Ma R.; Li X.; Wang K.-H.; Wang J.; Huang D.; Lv X.; Hu Y. Tetrahedron 2023, 149, 33711.
|
| [24] |
(a) Singh M. S.; Chowdhury S.; Koley S. Tetrahedron 2016, 72, 1603.
doi: 10.1016/j.tet.2016.02.031 |
|
(b) Shawali A. S. Chem. Rev. 1993, 93, 2731.
doi: 10.1021/cr00024a007 |
|
| [25] |
(a) Chandanshive J. Z.; Gonzalez P. B.; Tiznado W.; Bonini B. F.; Caballero J.; Femoni C.; Franchini M. C. Tetrahedron 2012, 68, 3319.
doi: 10.1016/j.tet.2012.02.068 pmid: 11463282 |
|
(b) Ponti A.; Molteni G. J. Org. Chem. 2001, 66, 5252.
pmid: 11463282 |
|
|
(c) Tanaka K.; Maeno S.; Mitsuhashi K. Chem. Lett. 1982, 11, 543.
doi: 10.1246/cl.1982.543 pmid: 11463282 |
|
| [26] |
(a) Song W.; Liu Y.; Yan N.; Wan J.-P. Org. Lett. 2023, 25, 2139.
doi: 10.1021/acs.orglett.3c00636 |
|
(b) Li X.; Chen Z.; Chen W.; Xie X.; Zhou H.; Liao Y.; Yu F.; Huang J. Org. Lett. 2022, 24, 7372.
doi: 10.1021/acs.orglett.2c02905 |
|
|
(c) Nagireddy A.; Dattatri K. R.; Nanubolu J. B.; Reddy M. S. J. Org. Chem. 2022, 87, 1240.
doi: 10.1021/acs.joc.1c02575 |
|
|
(d) Duan L.; Wang X.; Gu Y.; Hou Y.; Gong P. Org. Chem. Front. 2020, 7, 2307.
doi: 10.1039/D0QO00555J |
|
|
(e) Feng J.; He T.; Xie Y.; Yu Y.; Baell J. B.; Huang F. Org. Biomol. Chem. 2020, 18, 9483.
doi: 10.1039/D0OB01958E |
|
|
(f) Wakade S. B.; Tiwari D. K.; Phanindrudu M.; Pushpendra.; Tiwari, D. K. Tetrahedron 2019, 75, 4024.
doi: 10.1016/j.tet.2019.06.030 |
|
| [27] |
(a) Tu L.; Gao L.; Wang X.; Shi R.; Ma R.; Li J.; Lan X.; Zheng Y.; Liu J. J. Org. Chem. 2021, 86, 559.
doi: 10.1021/acs.joc.0c02244 |
|
(b) Yıldırım M.; Dirtirst Y. Tetrahedron Lett. 2011, 67, 3209.
doi: 10.1016/j.tet.2011.03.017 |
|
| [28] |
(a) Kowalczyk A.; Utecht-Jarzyńska G.; Mlostoń G.; Jasiński M. J. Fluorine Chem. 2021, 241, 10969.
pmid: 29392253 |
|
(b) Utecht G.; Fruziński A.; Jasiński M. Org. Biomol. Chem. 2018, 16, 1252.
doi: 10.1039/c7ob03126b pmid: 29392253 |
|
|
(c) Oh L. M. Tetrahedron Lett. 2006, 47, 7943.
doi: 10.1016/j.tetlet.2006.08.138 pmid: 29392253 |
|
| [29] |
Kantlehner W.; Mezgera J.; Ivanov I. C. Z. Naturforsch. 2014, 69, 519.
doi: 10.5560/znb.2014-4053 |
| [1] | 方新月, 黄雅雯, 胡新伟, 阮志雄. 电化学修饰氨基酸和多肽类化合物的研究进展[J]. 有机化学, 2024, 44(3): 903-926. |
| [2] | 付雅彤, 孙超凡, 张丹, 金成国, 陆居有. 巢式-碳硼烷硼氢键官能化反应研究进展[J]. 有机化学, 2024, 44(2): 438-447. |
| [3] | 张剑, 梁万洁, 杨艺, 闫法超, 刘会. 联烯胺化合物的区域选择性双官能团化[J]. 有机化学, 2024, 44(2): 335-348. |
| [4] | 范威. O2促进下五元环烯胺的C—H亚胺化[J]. 有机化学, 2023, 43(7): 2492-2498. |
| [5] | 户晓兢, 郭斐翔, 朱润青, 周柄棋, 张涛, 房立真. 对烷氧基酚的合成及其去芳构化后的合成应用[J]. 有机化学, 2023, 43(6): 2239-2244. |
| [6] | 纪健, 刘进华, 管丛, 陈绪文, 赵芸, 刘顺英. 原位生成的磺酸催化N-磺酰基-1,2,3-三氮唑与醇偶联高区域选择性合成N2-取代1,2,3-三氮唑[J]. 有机化学, 2023, 43(3): 1168-1176. |
| [7] | 沈梦涵, 李来强, 周泉, 王洁慧, 王磊. 可见光诱导下喹喔啉酮与吡咯衍生物的氧化偶联[J]. 有机化学, 2023, 43(2): 697-704. |
| [8] | 孙婧, 张萌萌, 锅小龙, 王琪, 王陆瑶. 无过渡金属条件下二芳基硒化合物的合成[J]. 有机化学, 2023, 43(12): 4251-4260. |
| [9] | 肖朵朵, 张建涛, 周鹏, 刘卫兵. 无金属条件下芳基酮与二甲亚砜的α-C(sp3)—H亚甲基化反应合成γ-酮亚砜[J]. 有机化学, 2023, 43(11): 3900-3906. |
| [10] | 彭菊, 何晓倩, 廖黎丽, 白若鹏, 蓝宇. 取代基电性效应对碳硅还原消除区域选择性调控的理论研究[J]. 有机化学, 2023, 43(10): 3608-3613. |
| [11] | 徐琳琳, 兰美君, 张慕雨, 张永琪, 冯宇豪, 荣良策, 张金鹏. 芳基乙烯β-H区域选择性三氟甲基磺酰化反应[J]. 有机化学, 2022, 42(7): 2134-2139. |
| [12] | 孙天义, 张依凡, 孟远倢, 王怡, 朱琦峰, 姜玉新, 刘石惠. 可见光-铜共催化的糖类区域选择性氧烷基化反应[J]. 有机化学, 2022, 42(5): 1414-1422. |
| [13] | 马文静, 朱礼志, 章梦珣, 李志成. ent-Kaurene全碳骨架中AB环系的不对称合成[J]. 有机化学, 2022, 42(2): 580-589. |
| [14] | 黄云帅, 靳小慧, 张凤莲, 汪义丰. 4-二甲胺基吡啶-硼自由基促进的缺电子烯烃区域选择性硼氢化反应[J]. 有机化学, 2021, 41(5): 1957-1967. |
| [15] | 韩博士, 时郑, 何慧红, 张兴华. 铜催化芳基(或烷基)卤化物选择性烯丙基化反应研究[J]. 有机化学, 2021, 41(2): 695-701. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||