有机化学 ›› 2024, Vol. 44 ›› Issue (7): 2136-2146.DOI: 10.6023/cjoc202401015 上一篇 下一篇
综述与进展
收稿日期:2024-01-15
修回日期:2024-03-05
发布日期:2024-03-28
基金资助:Received:2024-01-15
Revised:2024-03-05
Published:2024-03-28
Contact:
E-mail: Supported by:文章分享
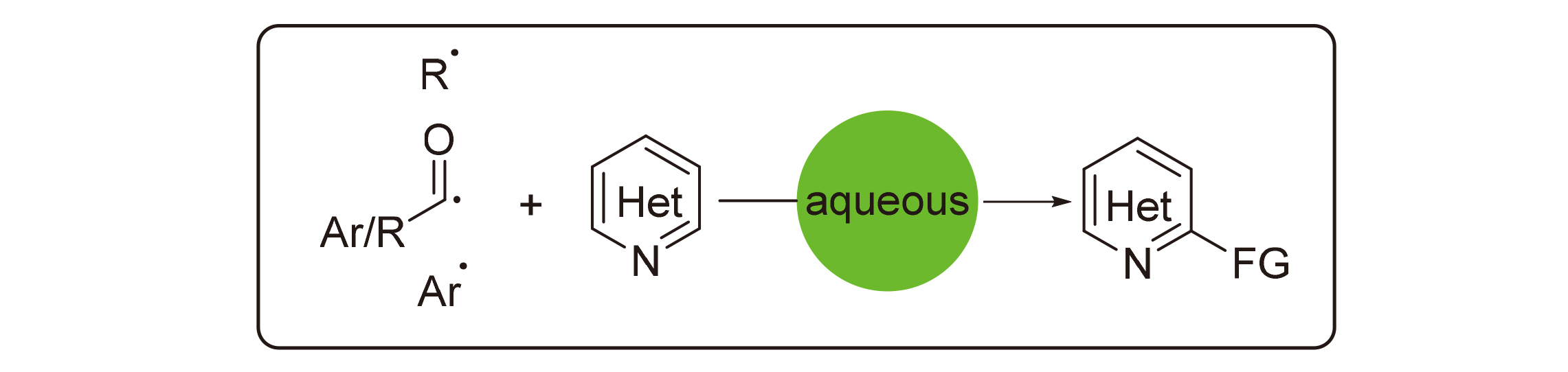
Minisci反应是通过自由基中间体对缺电子含氮杂环化合物进行官能团化的方法. 利用Minisci反应可以向未官能团化的缺电子含氮杂环上引入烷基、酰基、硅基、烷硫基、硼烷等, 构建具有不同取代基的杂环化合物, 是合成取代杂环的一个重要手段. 水作为一种绿色环保的溶剂, 是进行有机反应的理想介质, 在Minisci反应中得到了广泛应用. 尽管从发现Minisci反应开始, 水作为Minisci反应的介质就得到应用, 但是水溶液中的Minisci反应仍然发展缓慢. 从烷基化、芳基化和酰基化三个方面, 根据不同的自由基前体, 综述了水溶液中Minisci反应的进展.
王文贵, 王守锋. 水溶液中的Minisci反应研究进展[J]. 有机化学, 2024, 44(7): 2136-2146.
Wengui Wang, Shoufeng Wang. Recent Advances of Minisci Reactions in Aqueous Solution[J]. Chinese Journal of Organic Chemistry, 2024, 44(7): 2136-2146.
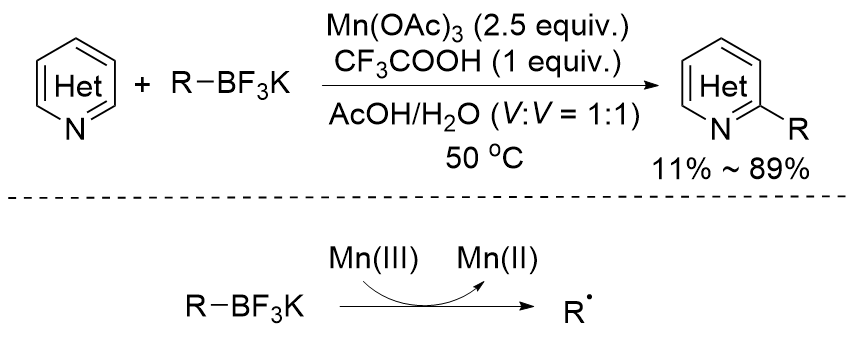
| [1] |
For selected reviews, see: (a) Liu, C.-X.; Yin, S.-Y.; Zhao, F.; Yang, H.; Feng, Z.; Gu, Q.; You, S.-L. Chem. Rev. 2023, 123, 10079.
pmid: 37134187 |
|
(b) Zhang, J.; Rueping, M. Chem. Soc. Rev. 2023, 52, 4099.
pmid: 37134187 |
|
|
(c) Josephitis, C. M.; Nguyen, H. M. H.; McNally, A. Chem. Rev. 2023, 123, 7655.
doi: 10.1021/acs.chemrev.2c00881 pmid: 37134187 |
|
|
(d) Roy, S.; Panja, S.; Sahoo, S. R.; Chatterjee, S.; Maiti, D. Chem. Soc. Rev. 2023, 52, 2391.
pmid: 37134187 |
|
|
(e) Bellotti, P.; Huang, H.-M.; Faber, T.; Glorius, F. Chem. Rev. 2023, 123, 4237.
pmid: 37134187 |
|
| [2] |
Lu, M.-Z.; Goh, J.; Maraswami, M.; Jia, Z.; Tian, J.-S.; Loh, T.-P. Chem. Rev. 2022, 122, 17479.
|
| [3] |
For selected reviews and articles, see: (a) Bacoş, P. D.; Lahdenperä, A. S. K.; Phipps, R. J. Acc. Chem. Res. 2023, 56, 2037.
|
|
(b) Dong, J.; Liu, Y.; Wang, Q. Chin. J. Org. Chem. 2021, 41, 3771. (in Chinese)
|
|
|
(董建洋, 刘玉秀, 汪清民, 有机化学, 2021, 41, 3771.)
|
|
|
(c) Meng, W.; Xu, K.; Guo, B.; Zeng, C. Chin. J. Org. Chem. 2021, 41, 2621. (in Chinese)
|
|
|
(孟薇, 徐坤, 郭兵兵, 曾程初, 有机化学, 2021, 41, 2621.)
|
|
|
(d) Wang, W.; Wang, S. Curr. Org. Chem. 2021, 25, 894.
|
|
|
(e) Zheng, H.; Lu, H.; Su, C.; Yang, R.; Zhao, L.; Liu, X.; Cao, H. Chin. J. Chem. 2023, 41, 193.
|
|
| [4] |
Minisci, F.; Vismara, E.; Fontana, F.; Morini, G.; Serravalle, M. J. Org. Chem. 1987, 52, 730
|
| [5] |
Minisci, F. Tetrahedron 1971, 27, 3575.
|
| [6] |
Minisci, F.; Vismara, E. Tetrahedron Lett. 1986, 26, 4803.
|
| [7] |
Shore, D. G. M.; Wasik, K. A.; Lyssikatos, J. P.; Estrada, A. A. Tetrahedron Lett. 2015, 56, 4063.
|
| [8] |
Tung, T. T.; Christensen, S. B.; Nielsen, J. Chem.-Eur. J. 2017, 23, 18125.
|
| [9] |
Xie, X.; Zhang, Y.; Hao, J.; Wan, W. Org. Biomol. Chem. 2020, 18, 400.
|
| [10] |
Mai, D. N.; Baxter, R. D. Org. Lett. 2016, 18, 3738.
|
| [11] |
Galloway, J. D.; Mai, D. N.; Baxter, R. D. Org. Lett. 2017, 19, 5772.
doi: 10.1021/acs.orglett.7b02706 pmid: 29043819 |
| [12] |
Wang, W.; Song, Y.; Xing, S.; Li, J.; Feng, W.; Qu, X.; Wang, S. ChemistrySelect 2023, 8, e202300958.
|
| [13] |
Sutherland, D. R.; Veguillas, M.; Oates, C. L.; Lee, A.-L. Org. Lett. 2018, 20, 6863.
doi: 10.1021/acs.orglett.8b02988 pmid: 30354158 |
| [14] |
Jafarpour, F.; Darvishmolla, M.; Azaddoost, N.; Mohaghegh, F. New J. Chem. 2019, 43, 9328.
doi: 10.1039/c8nj06410e |
| [15] |
Dong, J.; Wang, Z.; Wang, X.; Song, H.; Liu, Y.; Wang, Q. J. Org. Chem. 2019, 84, 7532.
|
| [16] |
Shao, M.; Liang, H.; Liu, Y.-L.; Qin, W.; Li, Z. Asian J. Org. Chem. 2020, 9, 782.
|
| [17] |
Jin, J.; MacMillan, D. W. C. Angew. Chem., Int. Ed. 2015, 54, 1565.
|
| [18] |
Devariab, S.; Shah, B. A. Chem. Commun. 2016, 52, 1490.
|
| [19] |
McCallum, T.; McCallum, L.-A.; McCallum, A.; Barriault, L. Synlett 2016, 27, 1282.
|
| [20] |
Bohman, B.; Berntsson, B.; Dixon, R. C. M.; Stewart, C. D.; Barrow, R. A. Org. Lett. 2014, 16, 2787.
doi: 10.1021/ol500776j pmid: 24824440 |
| [21] |
Xu, D.; Huang, F.; Tang, L.; Zhang, X.; Zhang, W. Chin. J. Org. Chem. 2022, 42, 1493. (in Chinese)
|
|
(徐东平, 黄飞, 汤琳, 张新明, 张武, 有机化学, 2022, 42, 1493.)
|
|
| [22] |
Lu, S.-C.; Li, H.-S.; Xu, S.; Duan, G.-Y. Org. Biomol. Chem. 2017, 15, 324.
|
| [23] |
Wu, X.; Wang, M.; Huan, L.; Wang, D.; Wang, J.; Zhu, C. Angew. Chem., Int. Ed. 2018, 57, 1640.
|
| [24] |
(a) Wang, Z.; Ji, X.; Zhao, J.; Huang, H. Green Chem. 2019, 21, 5512.
|
|
(b) Ji, X.; Liu, Q.; Wang, Z.; Wang, P.; Deng, G.-J.; Huang, H. Green Chem. 2020, 22, 8233.
|
|
| [25] |
Bosset, C.; Beucher, H.; Bretel, G.; Pasquier, E.; Queguiner, L.; Henry, C.; Vos, A.; Edwards, J. P.; Meerpoel, L.; Berthelot, D. Org. Lett. 2018, 20, 6003.
doi: 10.1021/acs.orglett.8b00991 pmid: 30252482 |
| [26] |
Santos, M. S.; Cybularczyk-Cecotka, M.; Kçnig, B.; Giedyk, M. Chem. Eur. J. 2020, 26, 15323.
|
| [27] |
Molander, G. A.; Colombel, V.; Braz, V. A. Org. Lett. 2011, 13, 1852.
doi: 10.1021/ol2003572 pmid: 21391555 |
| [28] |
Presset, M.; Fleury-Brégeot, N.; Oehlrich, D.; Rombouts, F.; Molander, G. A. J. Org. Chem. 2013, 78, 4615.
doi: 10.1021/jo4005519 pmid: 23594305 |
| [29] |
Matsui, J. K.; Molander, G. A. Org. Lett. 2017, 19, 950.
|
| [30] |
Matsui, J. K.; Primer, D. N.; Molander, G. A. Chem. Sci. 2017, 8, 3512.
|
| [31] |
Yan, H.; Hou, Z.-W.; Xu, H.-C. Angew. Chem., Int. Ed. 2019, 58, 4592.
|
| [32] |
Gutiérrez-Bonet, Á.; Remeur, C.; Matsui, J. K.; Molander, G. A. J. Am. Chem. Soc. 2017, 139, 12251.
|
| [33] |
Ji, Y.; Brueckl, T.; Baxter, R. D.; Fujiwara, Y.; Seiple, I. B.; Su, S.; Blackmond, D. G.; Baran, P. S. Proc. Natl. Acad. Sci. U. S. A. 2011, 108, 14411.
|
| [34] |
(a) Fujiwara, Y.; Dixon, J. A.; Rodriguez, R. A.; Baxter, R. D.; Dixon, D. D.; Collins, M. R.; Blackmond, D. G.; Baran, P. S. J. Am. Chem. Soc. 2012, 134, 1494.
doi: 10.1021/ja211422g pmid: 22229949 |
|
(b) O’Hara, F.; Baxter, R. D.; O’Brien, A. G.; Collins, M. R.; Dixon, J. A.; Fujiwara, Y.; Ishihara, Y.; Baran, P. S. Nat. Protoc. 2013, 8, 1042.
pmid: 22229949 |
|
| [35] |
Lytkinaa, M. A.; Eliseenkovb, E. V.; Boyarskiib, V. P.; Petrovb, A. A. Russ. J. Org. Chem. 2017, 53, 533.
|
| [36] |
Zhou, Q.; Ruffoni, A.; Gianatassio, R.; Fujiwara, Y.; Sella, E.; Shabat, D.; Baran, P. S. Angew. Chem., nt. Ed. 2013, 52, 3949.
|
| [37] |
Gianatassio, R.; Kawamura, S.; Eprile, C. L.; Foo, K.; Ge, J.; Burns, A. C.; Collins, M. R.; Baran, P. S. Angew. Chem., Int. Ed. 2014, 53, 9851.
doi: 10.1002/anie.201406622 pmid: 25088979 |
| [38] |
Jia, X.-M.; Wei, L.; Chen, F.; Tang, R.-Y. RSC Adv. 2015, 5, 29766.
|
| [39] |
Seiple, I. B.; Su, S.; Rodriguez, R. A.; Gianatassio, R.; Fujiwara, Y.; Sobel, A. L.; Baran, P. S. J. Am. Chem. Soc. 2010, 132, 13194.
doi: 10.1021/ja1066459 pmid: 20812741 |
| [40] |
Patel, N. R.; Flowers, R. A. J. Am. Chem. Soc. 2013, 135, 4672.
doi: 10.1021/ja400712g pmid: 23477364 |
| [41] |
Baxter, R. D.; Liang, Y.; Hong, X.; Brown, T. A.; Zare, R. N.; Houk, K. N.; Baran, P. S.; Blackmond, D. G. ACS Cent. Sci. 2015, 1, 456.
|
| [42] |
Biaco, J. L.; Jones, S. L.; Barker, T. J. Heterocycles 2016, 92, 1687.
|
| [43] |
Xue, D.; Jia, Z.-H.; Zhao, C.-J.; Zhang, Y.-Y.; Wang, C.; Xiao, J. Chem.-Eur. J. 2014, 20, 2960.
|
| [44] |
Wang, R.; Falck, J. R. Org. Chem. Front. 2014, 1, 1029.
|
| [45] |
Fontana, F.; Minisci, F.; Barbosa, M. C. N.; Vismara, E. J. Org. Chem. 1991, 56, 2866.
|
| [46] |
Zeng, X.; Liu, C.; Wang, X.; Zhang, J.; Wang, X.; Hu, Y. Org. Biomol. Chem. 2017, 15, 8929.
|
| [47] |
Regan, C. F.; Pierre, F.; Schwaebe, M. K.; Haddach, M.; Jung, M. E.; Ryckman, D. M. Synlett 2012, 23, 443.
|
| [48] |
Wang, X.-Z.; Zeng, C.-C. Tetrahedron 2019, 75, 1425.
|
| [49] |
Manna, S.; Prabhu, K. R. J. Org. Chem. 2019, 84, 5067.
|
| [50] |
Caronna, T.; Gardini, G. P.; Minisci, F. J. Chem. Soc. D 1969, 201.
|
| [51] |
(a) Caronna, T.; Fronza, G.; Minisci, F.; Porta, O. J. Chem. Soc., Perkin Trans. 2 1972, 2035.
|
|
(b) Minisci, F.; Citterio, A.; Vismara, E.; Giordano, C. Tetrahedron 1986, 41, 4157.
|
|
| [52] |
Song, Y.; Yu, Z.; Wang, W.; Wang, S. Tetrahedron 2023, 141, 133518.
|
| [53] |
Sultan, S.; Ahmad Rizvi, M. A.; Kumar, J.; Shah, B. A. Chem. Eur. J. 2018, 24, 10617.
|
| [54] |
Sharma, S.; Kumar, M.; Vishwakarma, R. A.; Verma, M. K.; Singh, P. P. J. Org. Chem. 2018, 83, 12420.
|
| [1] | 刘雯娟, 陈品红. 钯催化1,6-烯炔的环化反应研究[J]. 有机化学, 2024, 44(7): 2077-2091. |
| [2] | 李文雅, 王煜, 陈江琦, 史丹, 张良, 余小春, 王正军. 可见光催化不对称Minisci反应研究进展[J]. 有机化学, 2024, 44(7): 2110-2123. |
| [3] | 李文多, 魏娜娜, 冯楠. 硼自由基促进的C—C键形成反应构筑联芳基和苄基羧酸甲酯[J]. 有机化学, 2024, 44(6): 1853-1861. |
| [4] | 陆玲依, 邱晓东. 自由基形式烯烃双烷基化反应研究进展[J]. 有机化学, 2024, 44(6): 1701-1718. |
| [5] | 沈都益, 李玲慧, 靳鸽, 梁雨佳, 张欣慧, 公培伟, 张范军, 晁绵冉. 基于单电子转移的黄素仿生光催化氧化研究进展[J]. 有机化学, 2024, 44(4): 1069-1093. |
| [6] | 鞠国栋, 周冠宇, 赵应声. 三异丙基硅烷(TIPS)保护苯酚的无过渡金属催化区域选择性硫氰化反应[J]. 有机化学, 2024, 44(4): 1327-1336. |
| [7] | 高燊原, 诸昊穹, 金巧玲, 金露儿, 王晓钟, 戴立言. 三氟甲硫基自由基引发涉及烯烃、AgSCF3和喹喔啉酮的三组分反应[J]. 有机化学, 2024, 44(4): 1264-1275. |
| [8] | 黄健, 张文珍. 碳氮键参与的电化学阴极还原反应研究进展[J]. 有机化学, 2024, 44(3): 825-839. |
| [9] | 刘杰, 韩峰, 李双艳, 陈天煜, 陈建辉, 徐清. 无过渡金属参与甲基杂环化合物与醇的选择性有氧烯基化反应[J]. 有机化学, 2024, 44(2): 573-583. |
| [10] | 朱彦硕, 王红言, 舒朋华, 张克娜, 王琪琳. 烷氧自由基引发1,5-氢原子转移实现C(sp3)—H键官能团化的研究进展[J]. 有机化学, 2024, 44(1): 1-17. |
| [11] | 童红恩, 郭宏宇, 周荣. 可见光促进惰性碳-氢键对羰基的加成反应进展[J]. 有机化学, 2024, 44(1): 54-69. |
| [12] | 金玉坤, 任保轶, 梁福顺. 可见光介导的三氟甲基的选择性C-F键断裂及其在偕二氟类化合物合成中的应用[J]. 有机化学, 2024, 44(1): 85-110. |
| [13] | 张建涛, 张聪, 莫诺琳, 罗佳婷, 陈莲芬, 刘卫兵. 氯仿参与的烯烃自由基加成反应的研究进展[J]. 有机化学, 2023, 43(9): 3098-3106. |
| [14] | 徐伟, 翟宏斌, 程斌, 汪太民. 可见光诱导的钯催化Heck反应[J]. 有机化学, 2023, 43(9): 3035-3054. |
| [15] | 樊思捷, 董武恒, 梁彩云, 王贵超, 袁瑶, 尹作栋, 张兆国. 可见光诱导的自由基环化反应构建4-芳基-1,2-二氢萘类化合物[J]. 有机化学, 2023, 43(9): 3277-3286. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||
