有机化学 ›› 2021, Vol. 41 ›› Issue (5): 1821-1834.DOI: 10.6023/cjoc202009036 上一篇 下一篇
综述与进展
收稿日期:2020-09-15
修回日期:2020-11-18
发布日期:2020-12-05
通讯作者:
邱云亮
基金资助:
Yunliang Qiu1,*( ), Fengjiao Wei1, Liu Ye1, Minyue Zhao1
), Fengjiao Wei1, Liu Ye1, Minyue Zhao1
Received:2020-09-15
Revised:2020-11-18
Published:2020-12-05
Contact:
Yunliang Qiu
About author:Supported by:文章分享
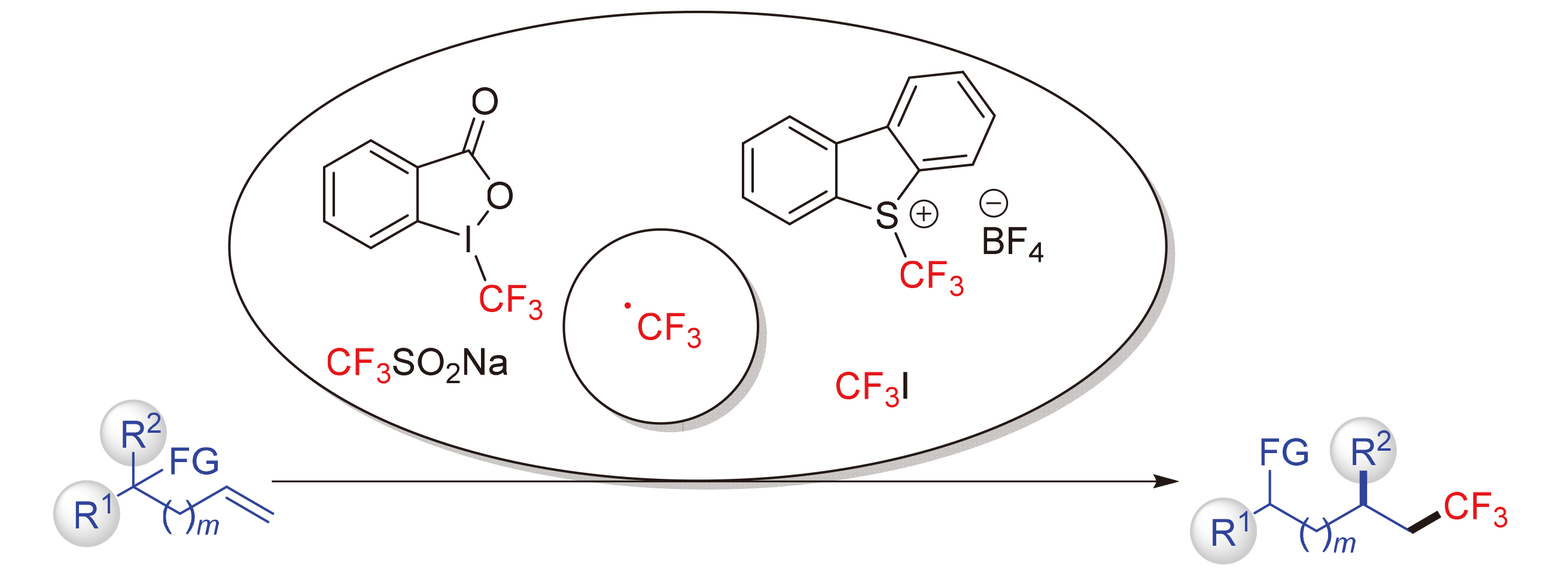
引入三氟甲基官能团可以有效地改善功能分子的化学稳定性、代谢稳定性及脂溶性等理化性质. 发展三氟甲基化合物的高效合成方法具有重要的应用价值. 近年来, 三氟甲基自由基与烯烃的反应得到了迅速的发展, 其形成的烷基自由基物种促进分子内官能团的迁移, 极大地丰富了烯烃的官能团化方式, 在实现烯烃三氟甲基官能团化的同时, 为迅速构建多样性的分子提供了有效的策略, 并推动了有机自由基化学的发展. 根据烯烃类型的不同, 分为官能团化的烯丙基化合物和非活化烯烃两大部分, 对近年来发展的三氟甲基自由基促进的烯烃的双官能团化反应进行了总结. 各部分根据迁移官能团种类不同, 详细讨论了不同方式的自由基产生途径、反应的适用范围和局限性以及不同催化体系的反应机理. 最后, 进一步对基于烯烃三氟甲基化引发的官能团迁移反应进行了总结, 分析了目前的一些研究现状.
邱云亮, 魏凤姣, 叶鎏, 赵旻玥. 三氟甲基自由基促进的烯烃官能团迁移新进展[J]. 有机化学, 2021, 41(5): 1821-1834.
Yunliang Qiu, Fengjiao Wei, Liu Ye, Minyue Zhao. Advances in Trifluoromethylation-Promoted Functional Group Migration of Alkenes[J]. Chinese Journal of Organic Chemistry, 2021, 41(5): 1821-1834.
| [1] |
(a) Harvey, D. F.; Sigano, D. M. Chem. Rev. 1996, 96, 271.
doi: 10.1021/cr950010w |
|
(b) Grubbs, R. H.; Chang, S. Tetrahedron 1998, 54, 4413.
doi: 10.1016/S0040-4020(97)10427-6 |
|
|
(c) Baird, M. C. Chem. Rev. 2000, 100, 1471.
doi: 10.1021/cr990252m |
|
|
(d) Takacs, J. M.; Jiang, X.-T. Curr. Org. Chem. 2003, 7, 369.
doi: 10.2174/1385272033372851 |
|
|
(e) Prunet, J. Angew. Chem., nt. Ed. 2003, 42, 2826.
|
|
|
(f) Beller, M.; Seayad, J.; Tillack, A.; Jiao, H. Angew. Chem., nt. Ed. 2004, 43, 3368.
|
|
|
(g) Chirik, P. J. Acc. Chem. Res. 2015, 48, 1687.
doi: 10.1021/acs.accounts.5b00134 |
|
| [2] |
(a) Lan, X.; Wang, N.; Xing, Y. Eur. J. Org. Chem. 2017,5812.
|
|
(b) Liu, G.; Shannon, S. S. Chem. Rev. 2011, 111, 2981.
doi: 10.1021/cr100371y |
|
|
(c) Smidt, J.; Hafner, W.; Jira, R.; Sedlmeier, J.; Sieber, R.; Kojer, H. Angew. Chem. 1959, 71, 176.
doi: 10.1002/(ISSN)1521-3757 |
|
|
(d) Smidt, J.; Hafner, W.; Jira, R.; Sieber, R.; Sedlmeier, J.; Sabel, A. Angew. Chem., nt. Ed. 1962, 1, 80.
|
|
|
(e) Jira, R. Angew. Chem., nt. Ed. 2009, 48, 9034.
|
|
| [3] |
(a) Filler, R.; Kobayashi, Y.; Yagupolskii, L. M. Organofluorine Compounds in Medicinal Chemistry and Biomedical Applications, Elsevier, Amsterdam,1993.
|
|
(b) Schlosser, M. Angew. Chem., nt. Ed. 2006, 45, 5432.
|
|
|
(c) Muller, K.; Faeh, C.; Diederich, F. Science 2007, 317, 1881.
doi: 10.1126/science.1131943 |
|
| [4] |
(a) Kellner, R.; Bruzzese, D.; Winslow, W. W.; Rada, R. T.; Wall, F. J. Clin. Pharmacol. 1978, 18, 20.
doi: 10.2165/00003088-199018010-00002 |
|
(b) Fann, W. E.; Sullivan, J. L.; Miller, R. D. Curr. Ther. Res. 1974, 16, 1281.
|
|
|
(c) Fann, W. E.; Richman, B. W.; Pitts, W. M. Curr. Ther. Res. 1982, 32, 906.
|
|
| [5] |
(a) Freston, J. W.; Pilmer, B. L.; Chiu, Y. L.; Wang, Q.; Stolle, J. C.; Griffin, J. S.; Lee, C. Q. Aliment. Pharmacol. Ther. 2004, 19, 1111.
doi: 10.1111/apt.2004.19.issue-10 pmid: 9085323 |
|
(b) Miura, M.; Tada, H.; Yasui-Furukori, N.; Uno, T.; Sugawara, K.; Tateishi, T.; Suzuki, T. Eur. J. Clin. Pharmacol. 2004, 60, 623.
pmid: 9085323 |
|
|
(c) Sachs, G.; Shin, J. M.; Howden, C. W. Aliment. Pharmacol. Ther. 2006, 23, 2.
doi: 10.1111/apt.2006.23.issue-s2 pmid: 9085323 |
|
|
(d) Zimmermann, A. E.; Katona, B. G. Pharmacotherapy 1997, 17, 308.
pmid: 9085323 |
|
| [6] |
(a) Tanaka, Y.; DeLuca, H. F.; Kobayashi, Y.; Ikekawa, N. Arch. Biochem. Biophys. 1984, 229, 348.
pmid: 9708607 |
|
(b) Morii, H.; Ogura, Y.; Koshikawa, S.; Mimura, N.; Suzuki, M.; Kurokawa, K.; Marumo, F.; Kawaguchi, Y.; Maeda, K.; Nishizawa, Y.; Inoue, S.; Fujimi, S.; Falecalcitriol Phase Secondary Hyperparathyroidism Treatment Study Group III. J. Bone Miner. Metab. 1998, 16, 34.
doi: 10.1007/s007740050026 pmid: 9708607 |
|
|
(c) Akiba, T.; Marumo, F.; Owada, A.; Kurihara, S.; Inoue, A.; Chida, Y.; Ando, R.; Shinoda, T.; Ishida, Y.; Ohashi, Y. Am. J. Kidney Dis. 1998, 32, 238.
pmid: 9708607 |
|
|
(d) Durakovic, C.; Malabanan, A.; Holick, M. F. Br. J. Dermatol. 2001, 144, 500.
doi: 10.1046/j.1365-2133.2001.04075.x pmid: 9708607 |
|
| [7] |
(a) Delbarre, B.; Dumas, G. Experientia 1969, 25, 850.
pmid: 5348552 |
|
(b) Prasad, T. N. V.; Rao, E. V.; Sastry, B. S.; Sastry, C. S. P.; Kostek, L. J. Anal. Profiles Drug Subst. 1991, 20, 665.
pmid: 5348552 |
|
| [8] |
(a) Bhatt, D. L.; Lincoff, A. M.; Gibson, C. M.; Stone, G. W.; McNulty, S.; Montalescot, G.; Kleiman, N. S.; Goodman, S. G.; White, H. D.; Mahaffey, K. W.; C. V. Pollack, Jr. C. V.; Manoukian, S. V.; Chew, D. P.; Cura, F.; Manukov, I.; Tousek, F.; Jafar, M. Z.; Arneja, J.; Skerjanec, S.; Harrington, R. A. N. Engl. J. Med. 2009, 361, 2330.
doi: 10.1056/NEJMoa0908629 |
|
(b) Harrington, R. A.; Stone, G. W.; McNulty, S.; White, H. D.; Lincoff, A. M.; Gibson, C. M.; Pollack, Jr. C. V.; Montalescot, G.; Mahaffey, K. W.; Kleiman, N. S.; Goodman, S. G.; Amine, M.; Angiolillo, D. J.; Becker, R. C.; Chew, D. P.; French, W. J.; Leisch, F.; Parikh, K. H.; Skerjanec, S.; Bhatt, D. L. N. Engl. J. Med. 2009, 361, 2318.
doi: 10.1056/NEJMoa0908628 |
|
|
(c) Kastrati, A.; Ndrepepa, G. N. Engl. J. Med. 2009, 361, 2382.
doi: 10.1056/NEJMe0910677 |
|
|
(d) Angiolillo, D. J.; Schneider, D. J.; Bhatt, D. L.; French, W. J.; Price, M. J.; Saucedo, J. F.; Shaburishvili, T.; Huber, K.; Prats, J.; Liu, T.; Harrington, R. A.; Becker, R. C. J. Thromb. Thrombolysis 2012, 34, 44.
doi: 10.1007/s11239-012-0737-3 |
|
|
(e) Leonardi, S.; Mahaffey, K. W.; White, H. D.; Gibson, C. M.; Ston, G. W.; Steg, G. W.; Hamm, C. W.; Price, M. J.; Todd, M.; Dietrich, M.; Gallup, D.; Liu, T.; Skerjanec, S.; Harrington, R. A.; Bhatt, D. L. Am. Heart J. 2012, 163, 768.
doi: 10.1016/j.ahj.2012.02.018 |
|
| [9] |
(a) Wang, X.; Zhang, Y.; Wang, J. Sci. Sin.: Chim. 2012, 42, 1417. (in Chinese).
|
|
(王兮, 张艳, 王剑波, 中国科学: 化学, 2012, 42, 1417.)
|
|
|
(b) Zeng, W.; Chen, F. Chin. J. Appl. Chem. 2014, 31, 627. (in Chinese).
|
|
|
(曾薇, 陈甫雪, 应用化学, 2014, 31, 627.)
|
|
|
(c) Li, M.; Kang, H.; Xue, X.-S.; Cheng, J.-P. Acta Chim. Sinica 2018, 76, 988. (in Chinese).
doi: 10.6023/A18080334 |
|
|
(李曼, 康会英, 薛小松, 程津培, 化学学报, 2018, 76, 988.)
doi: 10.6023/A18080334 |
|
|
(d) Ji, X.; Shi, G.; Zhang, Y. Chin. J. Org. Chem. 2019, 39, 929. (in Chinese).
doi: 10.6023/cjoc201810033 |
|
|
(季小明, 史广法, 张扬会, 有机化学, 2019, 39, 929.)
doi: 10.6023/cjoc201810033 |
|
| [10] |
(a) Chen, Z.-M.; Zhang, X.-M.; Tu, Y.-Q. Chem. Soc. Rev. 2015, 44, 5220.
doi: 10.1039/C4CS00467A |
|
(b) Li, W.; Xu, W.; Xie, J.; Yu, S.; Zhu, C. Chem. Soc. Rev. 2018, 47, 654.
doi: 10.1039/C7CS00507E |
|
|
(c) Wu, X.; Wu, S.; Zhu, C. Tetrahedron Lett. 2018, 59, 1328.
doi: 10.1016/j.tetlet.2018.02.053 |
|
|
(d) Zhang, G.; Liu, Y.; Zhao, J.; Li, Y.; Zhang, Q. Sci. China: Chem. 2019, 62, 1476.
doi: 10.1007/s11426-019-9629-x |
|
|
(e) Wu, X.; Zhu, C. Acc. Chem. Res. 2020, 53, 1620.
doi: 10.1021/acs.accounts.0c00306 |
|
|
(f) Chen, D.; Ji, M.; Yao, Y.; Zhu, C. Acta Chim. Sinica 2018, 76, 951. (in Chinese).
doi: 10.6023/A18080313 |
|
|
(陈栋, 吉梅山, 姚英明, 朱晨, 化学学报, 2018, 76, 951.)
doi: 10.6023/A18080313 |
|
| [11] |
(a) Liu, X.; Xiong, F.; Huang, X.; Xu, L.; Li, P.; Wu, X. Angew. Chem., nt. Ed. 2013, 52, 6962.
|
|
(b) Liu, X.; Wu, X. Synlett 2013, 24, 1882.
doi: 10.1055/s-00000083 |
|
| [12] |
Chen, Z.-M.; Bai, W.; Wang, S.-H.; Yang, B.-M.; Tu, Y.-Q.; Zhang, F.-M. Angew. Chem., nt. Ed. 2013, 52, 9781.
|
| [13] |
Egami, H.; Shimizu, R.; Usui, Y.; Sodeoka, M. Chem. Commun. 2013, 49, 7346.
doi: 10.1039/c3cc43936d |
| [14] |
Xu, P.; Hu, K.; Gu, Z.; Cheng, Y.; Zhu, C. Chem. Commun. 2015, 51, 7222.
doi: 10.1039/C5CC01189B |
| [15] |
Huang, H.-L.; Yan, H.; Gao, G.-L.; Yang, C.; Xia, W. Asian J. Org. Chem. 2015, 4, 674.
doi: 10.1002/ajoc.201500096 |
| [16] |
Cai, S.; Tian, Y.; Zhang, J.; Liu, Z.; Lu, M.; Weng, W.; Huang, M. Adv. Synth. Catal. 2018, 360, 4084.
doi: 10.1002/adsc.v360.21 |
| [17] |
Wang, H.; Xu, Q.; Yu, S. Org. Chem. Front. 2018, 5, 2224.
doi: 10.1039/C8QO00430G |
| [18] |
Guan, Z.; Wang, H.; Huang, Y.; Wang, Y.; Wang, S.; Lei, A. Org. Lett. 2019, 21, 4619.
doi: 10.1021/acs.orglett.9b01518 |
| [19] |
Natho, P.; Allen, L. A. T.; Parsons, P. J. Tetrahedron Lett. 2020, 61, 151695.
doi: 10.1016/j.tetlet.2020.151695 |
| [20] |
Sahoo, B.; Li, J.-L.; Glorius, F. Angew. Chem., nt. Ed. 2015, 54, 11577.
|
| [21] |
Woo, S. B.; Kim, D. Y. J. Fluorine Chem. 2015, 178, 214.
doi: 10.1016/j.jfluchem.2015.08.008 |
| [22] |
Kang, J.-C.; Tu, Y.-Q.; Dong, J.-W.; Chen, C.; Zhou, J.; Ding, T.-M.; Zai, J.-T.; Chen, Z.-M.; Zhang, S.-Y. Org. Lett. 2019, 21, 2536.
doi: 10.1021/acs.orglett.9b00263 |
| [23] |
Jung, H. I.; Kim, Y.; Kim, D. Y. Org. Biomol. Chem. 2019, 17, 3319.
doi: 10.1039/c9ob00373h |
| [24] |
Li, M.; Zhu, X.-Y.; Qiu, Y.-F.; Han, Y.-P.; Xia, Y.; Wang, C.-T.; Li, X.-S.; Wei, W.-X.; Liang, Y.-M. Adv. Synth. Catal. 2019, 361, 2945.
doi: 10.1002/adsc.v361.12 |
| [25] |
Kong, W.; Casimiro, M.; Merino, E.; Nevado, C. J. Am. Chem. Soc. 2013, 135, 14480.
doi: 10.1021/ja403954g |
| [26] |
Fuentes, N.; Kong, W.; Fernάndez-Sάnchez, L.; Merino, E.; Nevado, C. J. Am. Chem. Soc. 2015, 137, 964.
doi: 10.1021/ja5115858 |
| [27] |
Kong, W.; Fuentes, N.; García-Domínguez, A.; Merino, E.; Nevado, C. Angew. Chem., nt. Ed. 2015, 54, 2487.
|
| [28] |
Yu, P.; Lin, J.-S.; Li, L.; Zheng, S.-C.; Xiong, Y.-P.; Zhao, L.-J.; Tan, B.; Liu, X.-Y. Angew. Chem., nt. Ed. 2014, 53, 11890.
|
| [29] |
Yu, P.; Zheng, S.-C.; Yang, N.-Y.; Tan, B.; Liu, X.-Y. Angew. Chem., nt. Ed. 2015, 54, 4041.
|
| [30] |
Huang, L.; Lin, J.-S.; Tan, B.; Liu, X.-Y. ACS Catal. 2015, 5, 2826.
doi: 10.1021/acscatal.5b00311 |
| [31] |
Huang, L.; Zheng, S.-C.; Tan, B.; Liu, X.-Y. Org. Lett. 2015,17 , 1589.
|
| [32] |
Huang, L.; Zheng, S.-C.; Tan, B.; Liu, X.-Y. Chem.-Eur. J. 2015, 21, 6718.
|
| [33] |
Cheng, C.; Liu, S.; Lu, D.; Zhu, G. Org. Lett. 2016, 18, 2852.
doi: 10.1021/acs.orglett.6b01113 |
| [34] |
Lonca, G. H.; Ong, D. Y.; Tran, T. M. H.; Tejo, C.; Chiba, S.; Gagosz, F. Angew. Chem., nt. Ed. 2017, 56, 11440.
|
| [35] |
Chen, Z.-M.; Zhang, X.-M.; Tu, Y.-Q. Chem. Soc. Rev. 2015, 44, 5220.
doi: 10.1039/C4CS00467A |
| [36] |
Li, L.; Li, Z.-L.; Wang, F.-L.; Guo, Z.; Cheng, Y.-F.; Wang, N.; Dong, X.-W.; Fang, C.; Liu, J.; Hou, C.; Tan, B.; Liu, X.-Y. Nat. Commun. 2016, 7, 13852.
doi: 10.1038/ncomms13852 |
| [37] |
Li, L.; Gu, Q.-S.; Wang, N.; Song, P.; Li, Z.-L.; Li, X.-H.; Wang, F.-L.; Liu, X.-Y. Chem. Commun. 2017, 53, 4038.
doi: 10.1039/C6CC09215B |
| [38] |
Wu, Z.; Wang, D.; Liu, Y.; Huan, L.; Zhu, C. J. Am. Chem. Soc. 2017, 139, 1388.
doi: 10.1021/jacs.6b11234 |
| [39] |
Jeon, J.; He, Y.-T.; Shin, S.; Hong, S. Angew. Chem., nt. Ed. 2020, 59, 281.
|
| [40] |
Li, L.; Li, Z.-L.; Gu, Q.-S.; Wang, N.; Liu, X.-Y. Sci. Adv. 2017, 3, e1701487.
doi: 10.1126/sciadv.1701487 |
| [41] |
Tang, X.; Studer, A. Angew. Chem., nt. Ed. 2018, 57, 814.
|
| [42] |
Xu, Y.; Wu, Z.; Jiang, J.; Ke, Z.; Zhu, C. Angew. Chem., nt. Ed. 2017, 56, 4545.
|
| [43] |
Tang, X.; Studer, A. Chem. Sci. 2017, 8, 6888.
doi: 10.1039/C7SC02175E |
| [44] |
Tang, N.; Shao, X.; Wang, M.; Wu, X.; Zhu, C. Acta Chim. Sinica 2019, 77, 922. (in Chinese).
doi: 10.6023/A19050158 |
|
(汤娜娜, 邵鑫, 王明扬, 吴新鑫, 朱晨, 化学学报, 2019, 77, 922.)
doi: 10.6023/A19050158 |
|
| [45] |
Wang, N.; Li, L.; Li, Z.-L.; Yang, N.-Y.; Guo, Z.; Zhang, H.-X.; Liu, X.-Y. Org. Lett. 2016, 18, 6026.
doi: 10.1021/acs.orglett.6b02960 |
| [46] |
Li, Z.-L.; Li, X.-H.; Wang, N.; Yang, N.-Y.; Liu, X.-Y. Angew. Chem., nt. Ed. 2016, 55, 15100.
|
|
Wang, N.; Wang, J.; Guo, Y.-L.; Li, L.; Sun, Y.; Li, Z.; Zhang, H.-X.; Guo, Z.; Li, Z.-L.; Liu, X.-Y. Chem. Commun. 2018, 54, 8885.
doi: 10.1039/C8CC05186K |
| [1] | 李思达, 崔鑫, 舒兴中, 吴立朋. 钛催化的烯烃制备1,1-二硼化合物[J]. 有机化学, 2024, 44(2): 631-637. |
| [2] | 张剑, 梁万洁, 杨艺, 闫法超, 刘会. 联烯胺化合物的区域选择性双官能团化[J]. 有机化学, 2024, 44(2): 335-348. |
| [3] | 朱彦硕, 王红言, 舒朋华, 张克娜, 王琪琳. 烷氧自由基引发1,5-氢原子转移实现C(sp3)—H键官能团化的研究进展[J]. 有机化学, 2024, 44(1): 1-17. |
| [4] | 童红恩, 郭宏宇, 周荣. 可见光促进惰性碳-氢键对羰基的加成反应进展[J]. 有机化学, 2024, 44(1): 54-69. |
| [5] | 金玉坤, 任保轶, 梁福顺. 可见光介导的三氟甲基的选择性C-F键断裂及其在偕二氟类化合物合成中的应用[J]. 有机化学, 2024, 44(1): 85-110. |
| [6] | 张建涛, 张聪, 莫诺琳, 罗佳婷, 陈莲芬, 刘卫兵. 氯仿参与的烯烃自由基加成反应的研究进展[J]. 有机化学, 2023, 43(9): 3098-3106. |
| [7] | 樊思捷, 董武恒, 梁彩云, 王贵超, 袁瑶, 尹作栋, 张兆国. 可见光诱导的自由基环化反应构建4-芳基-1,2-二氢萘类化合物[J]. 有机化学, 2023, 43(9): 3277-3286. |
| [8] | 徐伟, 翟宏斌, 程斌, 汪太民. 可见光诱导的钯催化Heck反应[J]. 有机化学, 2023, 43(9): 3035-3054. |
| [9] | 赵瑜, 张凯, 白育斌, 张琰图, 史时辉. 无金属条件下可见光催化与溴盐协同促进烯烃的氢硅化反应研究[J]. 有机化学, 2023, 43(8): 2837-2847. |
| [10] | 归春明, 周潼瑶, 王海峰, 严琼姣, 汪伟, 黄锦, 陈芬儿. 可见光氧化还原催化炔基化反应的研究进展[J]. 有机化学, 2023, 43(8): 2647-2663. |
| [11] | 冯莹珂, 王贺, 崔梦行, 孙然, 王欣, 陈阳, 李蕾. 可见光诱导的新型官能化芳基异腈化合物的二氟烷基化环化反应[J]. 有机化学, 2023, 43(8): 2913-2925. |
| [12] | 杨晓娜, 郭宏宇, 周荣. 可见光促进有机硅化合物参与的化学转化[J]. 有机化学, 2023, 43(8): 2720-2742. |
| [13] | 陈玉琢, 孙红梅, 王亮, 胡方芝, 李帅帅. 基于α-氢迁移策略构建杂环骨架的研究进展[J]. 有机化学, 2023, 43(7): 2323-2337. |
| [14] | 黄芬, 罗维纬, 周俊. 基于C—H键断裂的多氯烷基化反应研究进展[J]. 有机化学, 2023, 43(7): 2368-2390. |
| [15] | 田钰, 张娟, 高文超, 常宏宏. 二甲亚砜作为甲基化试剂在有机合成中的应用[J]. 有机化学, 2023, 43(7): 2391-2406. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||