有机化学 ›› 2021, Vol. 41 ›› Issue (5): 1835-1850.DOI: 10.6023/cjoc202010020 上一篇 下一篇
综述与进展
收稿日期:2020-10-15
修回日期:2020-11-05
发布日期:2020-12-05
通讯作者:
张震
基金资助:Received:2020-10-15
Revised:2020-11-05
Published:2020-12-05
Contact:
Zhen Zhang
About author:Supported by:文章分享

碳二亚胺是合成含氮分子最有效的前体之一. 过渡金属催化的碳二亚胺环化反应已成为合成杂环产物的有效方法, 并引起了合成化学和药物化学家的极大关注. 近些年发表的大量成果证明了该合成方法在现代有机合成中的重要性. 总结了该领域在过去十年中的研究进展及一些开拓性的工作. 根据不同的环化机理, 从三部分归纳和讨论了从碳二亚胺到系列杂环分子的合成方法, 主要包括由亲核过程引发的串联环化、基于碳二亚胺对环金属中间体插入过程的环化和含不饱和体系的碳二亚胺参与的协同环化.
张震, 畅温旭. 过渡金属催化碳二亚胺环化的研究进展[J]. 有机化学, 2021, 41(5): 1835-1850.
Zhen Zhang, Wenxu Chang. Progress in Transition-Metal-Catalyzed Cyclization of Carbodiimides[J]. Chinese Journal of Organic Chemistry, 2021, 41(5): 1835-1850.

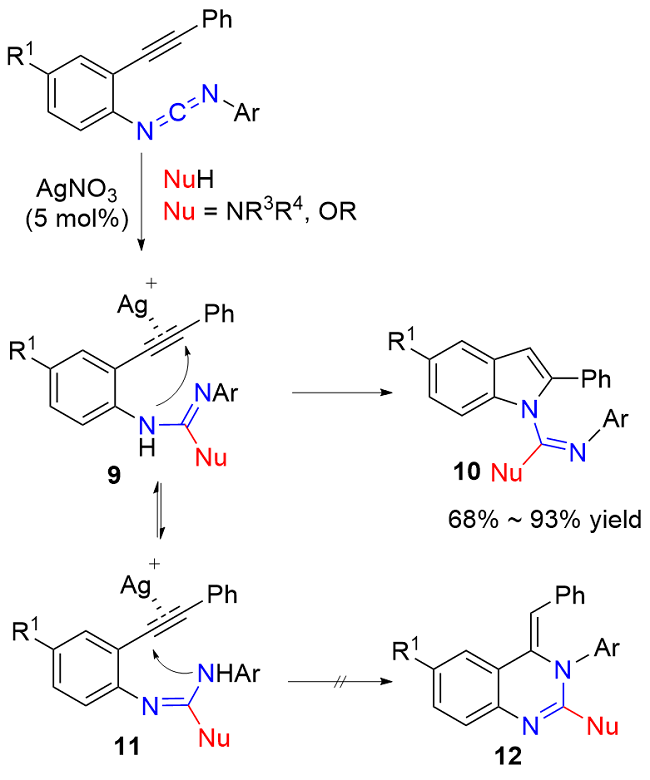
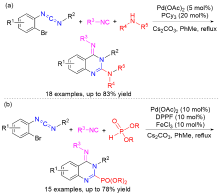

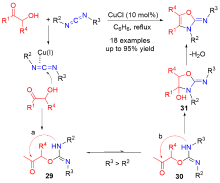
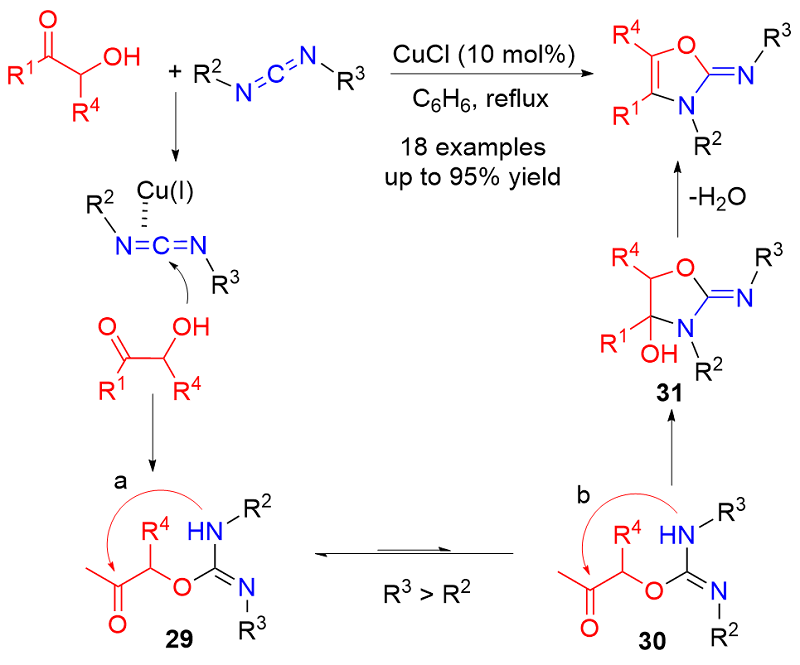


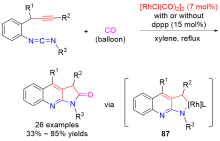
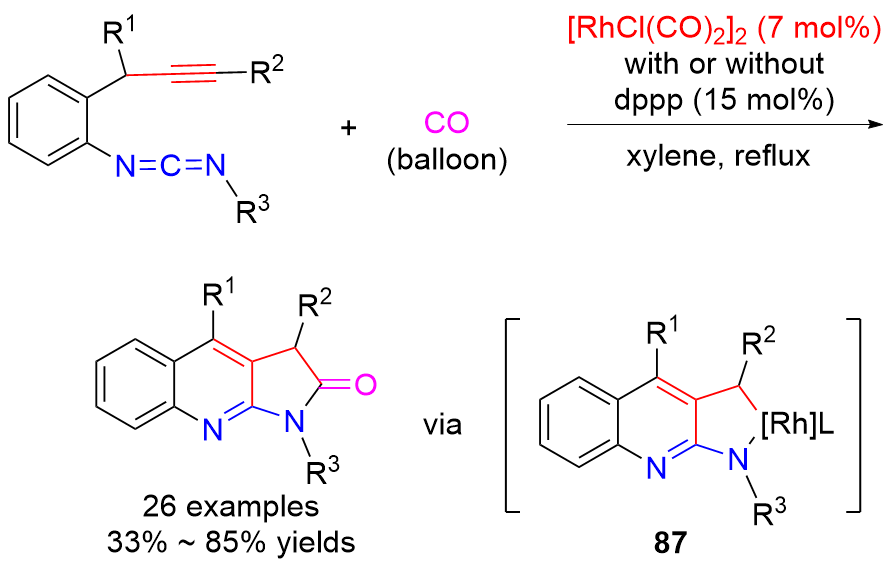

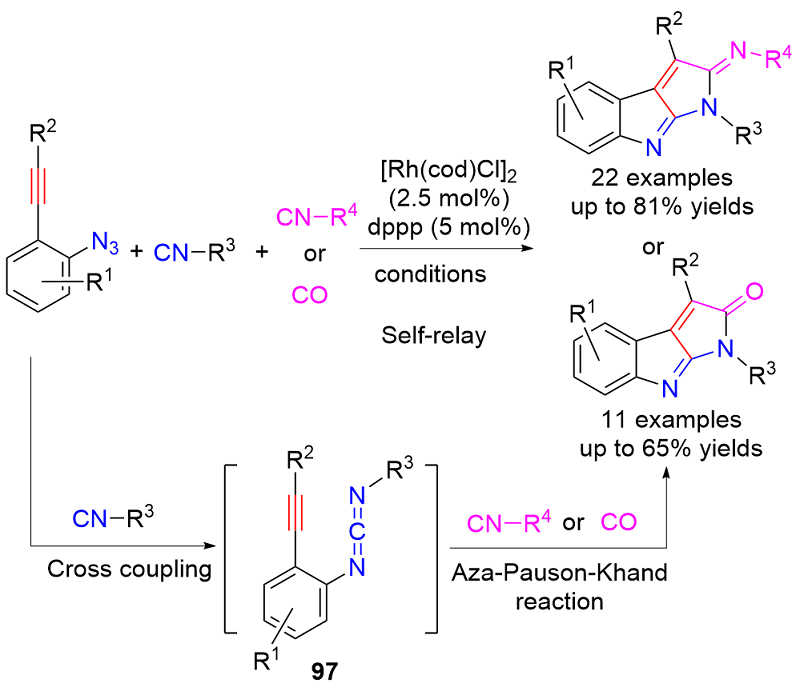
| [1] |
(a) Vovk, M. V.; Samarai, L. I. Russ. Chem. Rev. 1992, 61, 297.
doi: 10.1070/RC1992v061n03ABEH000946 |
|
(b) Williams, A.; Ibrahim, I. T. Chem. Rev. 1981, 81, 589.
doi: 10.1021/cr00046a004 |
|
|
(c) Ulrich, H. Chemistry and Technology of Carbodiimides, John Wiley & Sons, Ltd, Chichester, UK, 2007.
|
|
| [2] |
(a) Zhang, W. X.; Hou, Z. Org. Biomol. Chem. 2008, 6, 1720.
doi: 10.1039/b800135a pmid: 24626874 |
|
(b) Alonso-Moreno, C.; Antinolo, A.; Carrillo-Hermosilla, F.; Otero, A. Chem. Soc. Rev. 2014, 43, 3406.
doi: 10.1039/c4cs00013g pmid: 24626874 |
|
|
(c) Xu, L.; Zhang, W.-X.; Xi, Z. Organometallics 2015, 34, 1787.
doi: 10.1021/acs.organomet.5b00251 pmid: 24626874 |
|
|
(d) Zhang, W.-X.; Xu, L.; Xi, Z. Chem. Commun. 2015, 51, 254.
doi: 10.1039/C4CC05291A pmid: 24626874 |
|
|
(e) Wang, L.; Chi, Y.; Zhang, W.; Xi, Z. Chin. J. Org. Chem. 2018, 38, 1341. (in Chinese).
doi: 10.6023/cjoc201801037 pmid: 24626874 |
|
|
(王连军, 迟樾, 张文雄, 席振峰, 有机化学, 2018, 38, 1341.)
doi: 10.6023/cjoc201801037 pmid: 24626874 |
|
| [3] |
Peshkov, V. A.; Pereshivko, O. P.; Nechaev, A. A.; Peshkov, A. A.; Van der Eycken, E. V. Chem. Soc. Rev. 2018, 47, 3861.
doi: 10.1039/C7CS00065K |
| [4] |
Wang, Y.; Zhang, W. X.; Xi, Z. Chem. Soc. Rev. 2020, 49, 5810.
doi: 10.1039/C9CS00478E |
| [5] |
Lv, X.; Bao, W. J. Org. Chem. 2009, 74, 5618.
doi: 10.1021/jo900743y |
| [6] |
(a) Evindar, G.; Batey, R. A. Org. Lett. 2003, 5, 133.
pmid: 12529123 |
|
(b) Yang, T.; Lin, C.; Fu, H.; Jiang, Y.; Zhao, Y. Org. Lett. 2005, 7, 4781.
doi: 10.1021/ol052126c pmid: 12529123 |
|
| [7] |
He, H.-F.; Wang, Z.-J.; Bao, W. Adv. Synth. Catal. 2010, 352, 2905.
doi: 10.1002/adsc.v352.17 |
| [8] |
Huang, N. Y.; Liu, M. G.; Ding, M. W. J. Org. Chem. 2009, 74, 6874.
doi: 10.1021/jo901362c |
| [9] |
Lin, Y.; Li, E.; Wu, X.; Wang, L.; Wang, H.; Li, X.; Kang, H.; Zhou, L.; Shen, G.; Lv, X. Org. Biomol. Chem. 2020, 18, 1476.
doi: 10.1039/C9OB02532D |
| [10] |
(a) Wu, X.-F.; Neumann, H.; Beller, M. Chem. Rev. 2012, 113, 1.
doi: 10.1021/cr300100s |
|
(b) Chen, J. R.; Hu, X. Q.; Lu, L. Q.; Xiao, W. J. Chem. Rev. 2015, 115, 5301.
doi: 10.1021/cr5006974 |
|
| [11] |
Zeng, F.; Alper, H. Org. Lett. 2010, 12, 1188.
doi: 10.1021/ol902924x |
| [12] |
(a) Domling, A. Chem. Rev. 2006, 106, 17.
doi: 10.1021/cr0505728 |
|
(b) Lygin, A. V.; de Meijere, A. Angew. Chem., nt. Ed. 2010, 49, 9094.
|
|
| [13] |
Qiu, G.; Liu, G.; Pu, S.; Wu, J. Chem. Commun. 2012, 48, 2903.
doi: 10.1039/c2cc18001d |
| [14] |
Qiu, G.; Lu, Y.; Wu, J. Org. Biomol. Chem. 2013, 11, 798.
doi: 10.1039/C2OB26979A |
| [15] |
Larksarp, C.; Alper, H. J. Org. Chem. 1998, 63, 6229.
doi: 10.1021/jo9804341 |
| [16] |
(a) Butler, D. C.; Inman, G. A.; Alper, H. J. Org. Chem. 2000, 65, 5887.
doi: 10.1021/jo000608q |
|
(b) Zhou, H.-B.; Alper, H. Tetrahedron 2004, 60, 73.
doi: 10.1016/j.tet.2003.10.088 |
|
| [17] |
Wang, F.; Cai, S.; Liao, Q.; Xi, C. J. Org. Chem. 2011, 76, 3174.
doi: 10.1021/jo200014v |
| [18] |
Shen, G.; Bao, W. Adv. Synth. Catal. 2010, 352, 981.
doi: 10.1002/adsc.201000022 |
| [19] |
Duangjan, C.; Rukachaisirikul, V.; Saithong, S.; Kaeobamrung, J. Tetrahedron Lett. 2018, 59, 3537.
|
| [20] |
Han, M.-S.; Hahn, H.-G. Bull. Korean Chem. Soc. 2012, 33, 1371.
doi: 10.5012/bkcs.2012.33.4.1371 |
| [21] |
Larksarp, C.; Alper, H. J. Org. Chem. 2000, 65, 2773.
doi: 10.1021/jo991922r |
| [22] |
Chi, Y.; Xu, L.; Du, S.; Yan, H.; Zhang, W. X.; Xi, Z. Chem.-Eur. J. 2015, 21, 10369.
|
| [23] |
Lu, C.; Gong, C.; Zhao, B.; Hu, L.; Yao, Y. J. Org. Chem. 2018, 83, 1154.
doi: 10.1021/acs.joc.7b02550 |
| [24] |
Das, S.; Bhattacharjee, J.; Panda, T. K. Dalton Trans. 2019, 48, 7227.
doi: 10.1039/C8DT04630A |
| [25] |
Chi, Y.; Yan, H.; Zhang, W. X.; Xi, Z. Org. Lett. 2017, 19, 2694.
doi: 10.1021/acs.orglett.7b01025 |
| [26] |
Pathare, R. S.; Ansari, A. J.; Verma, S.; Maurya, A.; Maurya, A. K.; Agnihotri, V. K.; Sharon, A.; Pardasani, R. T.; Sawant, D. M. J. Org. Chem. 2018, 83, 9530.
doi: 10.1021/acs.joc.8b01261 |
| [27] |
Zeng, F.; Alper, H. Org. Lett. 2010, 12, 3642.
doi: 10.1021/ol101428v |
| [28] |
Qiu, G.; He, Y.; Wu, J. Chem. Commun. 2012, 48, 3836.
doi: 10.1039/c2cc30928a |
| [29] |
Qiu, G.; Wu, J. Chem. Commun. 2012, 48, 6046.
doi: 10.1039/c2cc32135a |
| [30] |
Yuan, G.; Liu, H.; Gao, J.; Yang, K.; Niu, Q.; Mao, H.; Wang, X.; Lv, X. J. Org. Chem. 2014, 79, 1749.
doi: 10.1021/jo402742k |
| [31] |
Xu, B.; Peng, B.; Cai, B.; Wang, S.; Wang, X.; Lv, X. Adv. Synth. Catal. 2016, 358, 653.
doi: 10.1002/adsc.201500455 |
| [32] |
Hao, W.; Sang, X.; Xiao, Y.; Cai, M. Tetrahedron Lett. 2016, 57, 4207.
doi: 10.1016/j.tetlet.2016.08.006 |
| [33] |
Hong, P.; Yamazaki, H. Tetrahedron Lett. 1977, 18, 1333.
doi: 10.1016/S0040-4039(01)93010-2 |
| [34] |
Hoberg, H.; Burkhart, G. Synthesis 1979, 1979, 525.
doi: 10.1055/s-1979-28743 |
| [35] |
Young, D. D.; Deiters, A. Angew. Chem., nt. Ed. 2007, 46, 5187.
|
| [36] |
Ishii, M.; Mori, F.; Tanaka, K. Chem.-Eur. J. 2014, 20, 2169.
|
| [37] |
Tanaka, K.; Mimura, M.; Hojo, D. Tetrahedron 2009, 65, 9008.
doi: 10.1016/j.tet.2009.06.115 |
| [38] |
Raghuvanshi, A.; Singh, A. K.; Mobin, S. M.; Mathur, P. ChemistrySelect 2017, 2, 9245.
doi: 10.1002/slct.201701625 |
| [39] |
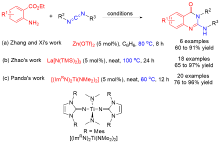
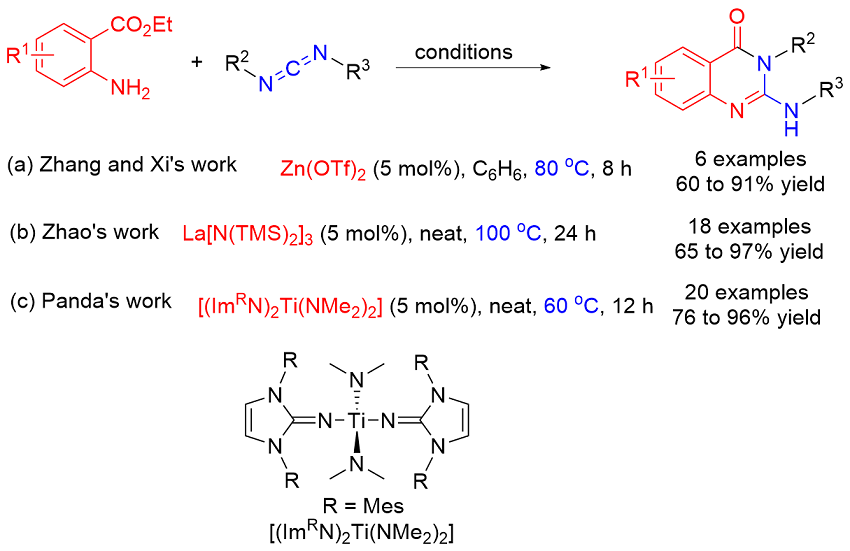
Zhang, Z.; Qin, Z.; Chang, W.; Li, J.; Fan, R.; Wu, X.; Guo, R.; Xie, X.; Zhou, L. Adv. Synth. Catal. 2020, 362, 2864.
doi: 10.1002/adsc.v362.14 |
| [40] |
Lee, E. E.; Rovis, T. Org. Lett. 2008, 10, 1231.
doi: 10.1021/ol800086s |
| [41] |
Li, Z.; Huo, T.; Li, L.; Feng, S.; Wang, Q.; Zhang, Z.; Pang, S.; Zhang, Z.; Wang, P.; Zhang, Z. Org. Lett. 2018, 20, 7762.
doi: 10.1021/acs.orglett.8b03115 |
| [42] |
Wang, Y.; Li, Z.; Zhao, H.; Zhang, Z. Synthesis 2019, 51, 3250.
doi: 10.1055/s-0037-1611830 |
| [43] |
Tsukano, C.; Nakajima, M.; Hande, S. M.; Takemoto, Y. Org. Biomol. Chem. 2019, 17, 1731.
doi: 10.1039/C8OB02224K |
| [44] |
Saito, T.; Shiotani, M.; Otani, T.; Hasaba, S. Heterocycles 2003,60.
|
| [45] |
Saito, T.; Sugizaki, K.; Otani, T.; Suyama, T. Org. Lett. 2007, 9, 1239.
doi: 10.1021/ol063123i |
| [46] |
Mukai, C.; Yoshida, T.; Sorimachi, M.; Odani, A. Org. Lett. 2006, 8, 83.
doi: 10.1021/ol052562z |
| [47] |
Saito, T.; Furukawa, N.; Otani, T. Org. Biomol. Chem. 2010, 8, 1126.
doi: 10.1039/b924301a |
| [48] |
Otani, T.; Saito, T.; Sakamoto, R.; Osada, H.; Hirahara, A.; Furukawa, N.; Kutsumura, N.; Matsuo, T.; Tamao, K. Chem. Commun. 2013, 49, 6206.
doi: 10.1039/c3cc42792g |
| [49] |
Tateno, K.; Ogawa, R.; Sakamoto, R.; Tsuchiya, M.; Kutsumura, N.; Otani, T.; Ono, K.; Kawai, H.; Saito, T. J. Org. Chem. 2018, 83, 690.
doi: 10.1021/acs.joc.7b02674 |
| [50] |
Otani, T.; Onishi, M.; Seino, T.; Furukawa, N.; Saito, T. RSC Adv. 2014, 4, 53669.
doi: 10.1039/C4RA11846D |
| [51] |
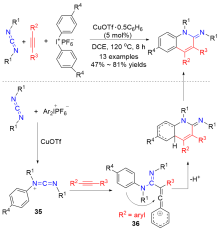
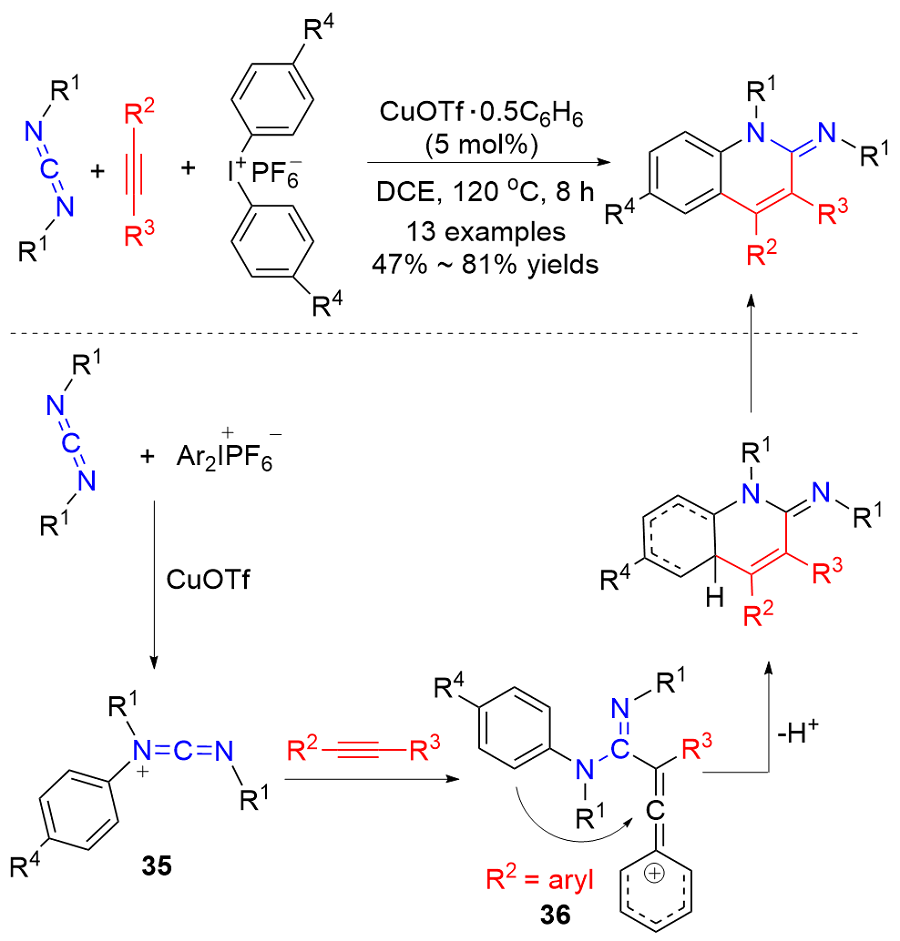
Zhang, Z.; Xiao, F.; Huang, B.; Hu, J.; Fu, B.; Zhang, Z. Org. Lett. 2016, 18, 908.
doi: 10.1021/acs.orglett.5b03570 |
| [1] | 高宝昌, 石雨, 田媛, 张治国, 张婧如, 孙宇峰, 毛国梁, 戴凌燕. 4-甲基-2-氧代-6-芳氨基-二氢-吡喃-3-腈衍生物的合成[J]. 有机化学, 2024, 44(2): 644-649. |
| [2] | 夏登鹏, 罗锦昀, 何林, 蔡志华, 杜广芬. 氮杂环卡宾催化的五氟苯基硫醚的合成[J]. 有机化学, 2024, 44(2): 622-630. |
| [3] | 杨爽, 房新强. 氮杂环卡宾催化实现的动力学拆分近期研究进展[J]. 有机化学, 2024, 44(2): 448-480. |
| [4] | 刘杰, 韩峰, 李双艳, 陈天煜, 陈建辉, 徐清. 无过渡金属参与甲基杂环化合物与醇的选择性有氧烯基化反应[J]. 有机化学, 2024, 44(2): 573-583. |
| [5] | 赵红琼, 于淼, 宋冬雪, 贾琦, 刘颖杰, 季宇彬, 许颖. 羧酸脱羧羟基化反应研究进展[J]. 有机化学, 2024, 44(1): 70-84. |
| [6] | 唐菁, 罗文坤, 周俊. 氮杂螺[4.5]三烯酮衍生物的合成研究进展[J]. 有机化学, 2023, 43(9): 3006-3034. |
| [7] | 贝文峰, 潘健, 冉冬梅, 刘伊琳, 杨震, 冯若昆. 基于钴催化吲哚酰胺与二炔和单炔的[4+2]环化反应合成γ-咔啉酮[J]. 有机化学, 2023, 43(9): 3226-3238. |
| [8] | 樊思捷, 董武恒, 梁彩云, 王贵超, 袁瑶, 尹作栋, 张兆国. 可见光诱导的自由基环化反应构建4-芳基-1,2-二氢萘类化合物[J]. 有机化学, 2023, 43(9): 3277-3286. |
| [9] | 高晓阳, 翟锐锐, 陈训, 王烁今. 碳酸亚乙烯酯参与C—H键活化反应的研究进展[J]. 有机化学, 2023, 43(9): 3119-3134. |
| [10] | 蔡远林, 吕亚, 聂桂花, 金智超, 池永贵. 氮杂环卡宾催化合成氰基化合物的研究进展[J]. 有机化学, 2023, 43(9): 3135-3145. |
| [11] | 陈祖良, 魏颖静, 张俊良. 供体-受体氮杂环丙烷碳-碳键断裂的环加成反应研究进展[J]. 有机化学, 2023, 43(9): 3078-3088. |
| [12] | 冯莹珂, 王贺, 崔梦行, 孙然, 王欣, 陈阳, 李蕾. 可见光诱导的新型官能化芳基异腈化合物的二氟烷基化环化反应[J]. 有机化学, 2023, 43(8): 2913-2925. |
| [13] | 张素珍, 张文文, 杨慧, 顾庆, 游书力. 铑催化2-烯基苯酚与炔烃的对映体选择性螺环化反应[J]. 有机化学, 2023, 43(8): 2926-2933. |
| [14] | 陈新强, 张敬. 伯醇的脱羟甲基反应的研究进展[J]. 有机化学, 2023, 43(8): 2711-2719. |
| [15] | 陈玉琢, 孙红梅, 王亮, 胡方芝, 李帅帅. 基于α-氢迁移策略构建杂环骨架的研究进展[J]. 有机化学, 2023, 43(7): 2323-2337. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||
