有机化学 ›› 2022, Vol. 42 ›› Issue (1): 235-241.DOI: 10.6023/cjoc202107048 上一篇 下一篇
研究论文
张斯旋a, 李祥瑞a, 李文欣a, 饶卫东b, 葛丹华a,*( ), 沈志良a, 褚雪强a,*(
), 沈志良a, 褚雪强a,*( )
)
收稿日期:2021-07-23
修回日期:2021-08-27
发布日期:2021-08-28
通讯作者:
葛丹华, 褚雪强
作者简介:基金资助:
Sixuan Zhanga, Xiangrui Lia, Wenxin Lia, Weidong Raob, Danhua Gea( ), Zhiliang Shena, Xueqiang Chua(
), Zhiliang Shena, Xueqiang Chua( )
)
Received:2021-07-23
Revised:2021-08-27
Published:2021-08-28
Contact:
Danhua Ge, Xueqiang Chu
About author:Supported by:文章分享
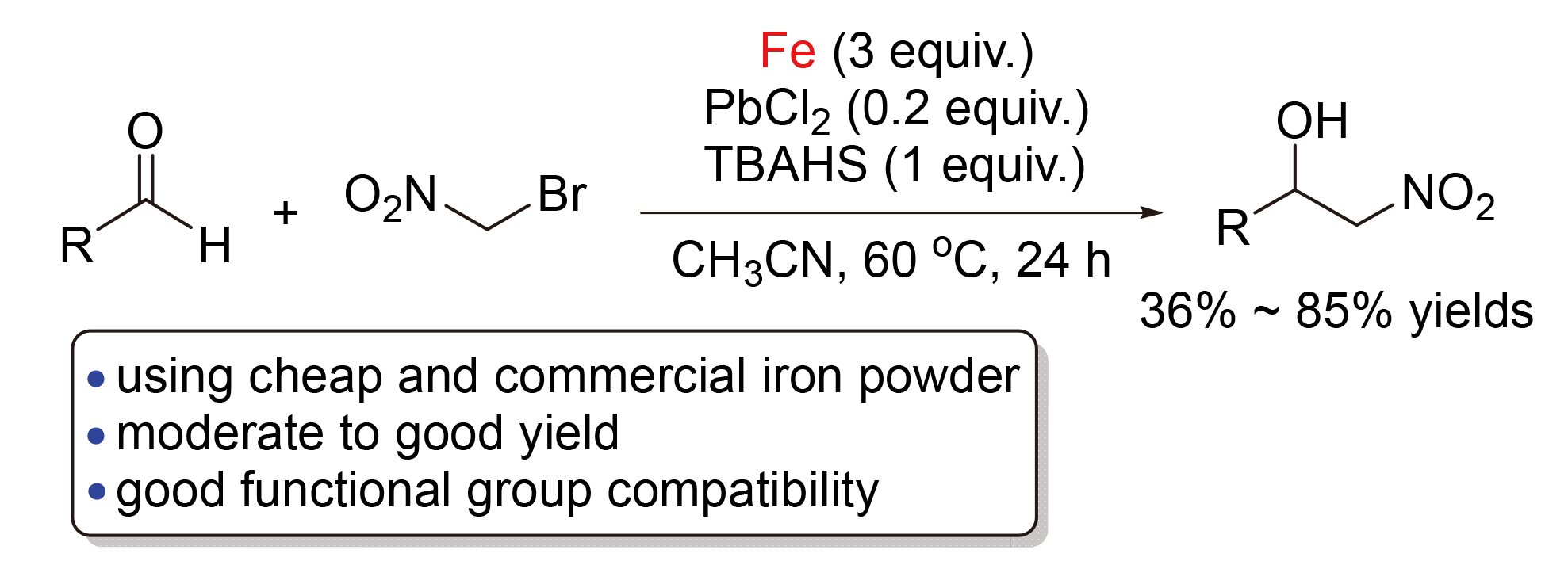
以廉价易得、商品化的铁粉为反应促进剂, 研究了溴代硝基甲烷与各种醛的Henry型反应, 高效地合成了2-硝基-1-醇. 该反应在PbCl2和四丁基硫酸氢铵(TBAHS)存在下有效地进行, 以中等至良好的产率得到目标产物, 并且该反应具有广泛的官能团耐受性.
张斯旋, 李祥瑞, 李文欣, 饶卫东, 葛丹华, 沈志良, 褚雪强. 铁(0)促进的醛与溴代硝基甲烷的Henry型反应高效合成2-硝基-1-醇[J]. 有机化学, 2022, 42(1): 235-241.
Sixuan Zhang, Xiangrui Li, Wenxin Li, Weidong Rao, Danhua Ge, Zhiliang Shen, Xueqiang Chu. Iron(0)-Mediated Henry-Type Reaction of Bromonitromethane with Aldehydes for the Efficient Synthesis of 2-Nitro-alkan-1-ols[J]. Chinese Journal of Organic Chemistry, 2022, 42(1): 235-241.
| Entry | Catalyst | Yieldb/% | Entry | Catalyst | Yieldb/% |
|---|---|---|---|---|---|
| 1 2 3 | — InCl3 BiCl3 | 0 25 28 | 10 11 12 | FeBr2 PbCl2 PbBr2 | 26 58 (53)c 32 |
| 4 | MnCl2 | 48 | 13 | PbI2 | 28 |
| 5 | CrCl3 | 24 | 14 | CuBr | 38 |
| 6 | ZnCl2 | 46 | 15 | CuI | 26 |
| 7 | FeCl3 | 34 | 16 | NaI | 30 |
| 8 | FeCl2 | 22 | 17 | NH4I | 10 |
| 9 | FeBr3 | 26 | 18 | LiI | 30 |
| Entry | Catalyst | Yieldb/% | Entry | Catalyst | Yieldb/% |
|---|---|---|---|---|---|
| 1 2 3 | — InCl3 BiCl3 | 0 25 28 | 10 11 12 | FeBr2 PbCl2 PbBr2 | 26 58 (53)c 32 |
| 4 | MnCl2 | 48 | 13 | PbI2 | 28 |
| 5 | CrCl3 | 24 | 14 | CuBr | 38 |
| 6 | ZnCl2 | 46 | 15 | CuI | 26 |
| 7 | FeCl3 | 34 | 16 | NaI | 30 |
| 8 | FeCl2 | 22 | 17 | NH4I | 10 |
| 9 | FeBr3 | 26 | 18 | LiI | 30 |
| Entry | Additive | Yieldb/% |
|---|---|---|
| 1 | TBAB | 32 |
| 2 | TBAI | <5 |
| 3 | TBAHS | 78 (74)c |
| 4 | CTMAB | 20 |
| 5 | KHSO4 | 67 |
| 6 | TsOH | 67 |
| 7 | TBAHS | 22d |
| 8 | TBAHS | 18e |
| Entry | Additive | Yieldb/% |
|---|---|---|
| 1 | TBAB | 32 |
| 2 | TBAI | <5 |
| 3 | TBAHS | 78 (74)c |
| 4 | CTMAB | 20 |
| 5 | KHSO4 | 67 |
| 6 | TsOH | 67 |
| 7 | TBAHS | 22d |
| 8 | TBAHS | 18e |
| Entry | Aldehyde | Product | Yieldb/% | Entry | Aldehyde | Product | Yieldb/% |
|---|---|---|---|---|---|---|---|
| 1 | | 3b | 68 | 10 | | 3k | 64 |
| 2 | | 3c | 63 | 11 | | 3l | 41 |
| 3 | | 3d | 75 | 12 | | 3m | 36 |
| 4 | | 3e | 69 | 13 | | 3n | 49 |
| 5 | | 3f | 65 | 14 | | 3o | 55 |
| 6 | | 3g | 60 | 15 | | 3p | 45 |
| 7 | | 3h | 66 | 16 | | 3q | 43 |
| 8 | | 3i | 85 | 17 | | 3r | 47c,d |
| 9 | | 3j | 67 |
| Entry | Aldehyde | Product | Yieldb/% | Entry | Aldehyde | Product | Yieldb/% |
|---|---|---|---|---|---|---|---|
| 1 | | 3b | 68 | 10 | | 3k | 64 |
| 2 | | 3c | 63 | 11 | | 3l | 41 |
| 3 | | 3d | 75 | 12 | | 3m | 36 |
| 4 | | 3e | 69 | 13 | | 3n | 49 |
| 5 | | 3f | 65 | 14 | | 3o | 55 |
| 6 | | 3g | 60 | 15 | | 3p | 45 |
| 7 | | 3h | 66 | 16 | | 3q | 43 |
| 8 | | 3i | 85 | 17 | | 3r | 47c,d |
| 9 | | 3j | 67 |
| [1] |
(a) Ono, N. In The Nitro Group in Organic Synthesis, Wiley-VCH, New York, 2001, p. 30.
|
|
(b) Norman, B. H.; Morris, M. L. Tetrahedron Lett. 1992, 33, 6803.
doi: 10.1016/S0040-4039(00)61780-X |
|
|
(c) Kawabata, T.; Kiryu, Y.; Sugiure, Y.; Fuji, K. Tetrahedron Lett. 1993, 34, 5127.
doi: 10.1016/S0040-4039(00)60694-9 |
|
|
(d) Sasai, H.; Kim, W.-S.; Suzuki, T.; Shibasaki, M. Tetrahedron Lett. 1994, 35, 6123.
doi: 10.1016/0040-4039(94)88093-X |
|
|
(e) Corey, E. J.; Zhang, F.-Y. Angew. Chem. Int. Ed. 1999, 38, 1931.
doi: 10.1002/(ISSN)1521-3773 |
|
|
(f) Grembecka, J.; Kafarski, P. Mini Rev. Med. Chem. 2001, 1, 133.
doi: 10.2174/1389557013406990 |
|
| [2] |
Henry, L. Bull. Soc. Chim. Fr. 1895, 13, 999.
|
| [3] |
(a) Rosini, G.; Ballini, R. Synthesis 1988, 833.
|
|
(b) Shvekhgeimer, M. A. Russ. Chem. Rev. 1998, 67, 35.
doi: 10.1070/RC1998v067n01ABEH000285 |
|
|
(c) Luzzio, F. A. Tetrahedron 2001, 57, 915.
doi: 10.1016/S0040-4020(00)00965-0 |
|
| [4] |
(a) Concellon, J. M.; Rodriguez-Solla, H.; Concellon, C.; Garcia-Granda, S.; Diaz, M. R. Org. Lett. 2006, 8, 5979.
doi: 10.1021/ol062451f pmid: 18421397 |
|
(b) Alcaide, B.; Almendros, P.; Luna, A.; Torres, M. R. Org. Biomol. Chem. 2008, 6, 1635.
doi: 10.1039/b802011f pmid: 18421397 |
|
|
(c) Blay, G.; Hernandez-Olmos, V.; Pedro, J. R. Chem. Commun. 2008, 4840.
pmid: 18421397 |
|
|
(d) Leighty, M. W.; Shen, B.; Johnston, J. N. J. Am. Chem. Soc. 2012, 134, 15233.
doi: 10.1021/ja306225u pmid: 18421397 |
|
|
(e) Mao, P.; Yang, L.; Xiao, Y.; Yuan, J.; Mai, W.; Gao, J.; Zhang, X. Chin. J. Org. Chem. 2019, 39, 443.
doi: 10.6023/cjoc201807008 pmid: 18421397 |
|
|
(f) Hu, Z.; Jiang, G.; Zhu, Z. Gong, B.; Xie, Z.; Le, Z. Chin. J. Org. Chem. 2021, 41, 325.
doi: 10.6023/cjoc202006029 pmid: 18421397 |
|
| [5] |
Concellon, J. M.; Rodriguez-Solla, H.; Concellon, C. J. Org. Chem. 2006, 71, 7919.
doi: 10.1021/jo061465w |
| [6] |
(a) Soengas, R. G.; Estévez, A. M. Eur. J. Org. Chem. 2010, 5190.
|
|
(b) Soengas, R. G.; Estévez, A. M. Synlett 2010, 2625.
|
|
|
(c) Soengas, R. G.; Estévez, A. M. Tetrahedron Lett. 2012, 53, 570.
doi: 10.1016/j.tetlet.2011.11.094 |
|
| [7] |
Soengas, R. G.; Silva, A. M. S. Synlett 2012, 873.
|
| [8] |
Mahasneh, A. S. Z. Naturforsch. 2005, 60b, 416.
|
| [9] |
(a) Liu, Y.; Lu, Y.; Prashad, M.; Repic, O.; Blacklock, T. J. Adv. Synth. Catal. 2005, 347, 217.
doi: 10.1002/(ISSN)1615-4169 |
|
(b) Gao, G.; Tao, Y.; Jiang, J. Green Chem. 2008, 10, 439.
doi: 10.1039/b719259b |
|
|
(c) Dey, R.; Mukherjee, N.; Ahammed, S.; Ranu, B. C. Chem. Commun. 2012, 48, 7982.
doi: 10.1039/c2cc30999h |
|
|
(d) Liu, X.-Y.; Cheng, B.-Q.; Guo, Y.-C.; Chu, X.-Q.; Rao, W.; Loh, T.-P.; Shen, Z.-L. Org. Chem. Front. 2019, 6, 1581.
doi: 10.1039/C9QO00210C |
|
|
(e) Liu, X.-Y.; Li, X.-R.; Zhang, C.; Chu, X.-Q.; Rao, W.; Loh, T.-P.; Shen, Z.-L. Org. Lett. 2019, 21, 5873.
doi: 10.1021/acs.orglett.9b01999 |
|
|
(f) Chan, T. C.; Lau, C. P.; Chan, T. H. Tetrahedron Lett. 2004, 45, 4189.
doi: 10.1016/j.tetlet.2004.03.163 |
|
| [10] |
(a) Blümke, T. D.; Chen, Y.-H.; Peng, Z.; Knochel, P. Nat. Chem. 2010, 2, 313.
doi: 10.1038/nchem.590 |
|
(b) Chen, B.-Z.; Wang, C.-X.; Jing, Z.-H.; Chu, X.-Q.; Loh, T.-P.; Shen, Z.-L. Org. Chem. Front. 2019, 6, 313.
doi: 10.1039/C8QO01244J |
|
| [11] |
(a) Blümke, T. D.; Klatt, T.; Koszinowski, K.; Knochel, P. Angew. Chem. Int. Ed. 2012, 51, 9926.
doi: 10.1002/anie.201205169 |
|
(b) Takai, K.; Ikawa, Y. Org. Lett. 2002, 4, 1727.
doi: 10.1021/ol025784v |
|
|
(c) Yun, J.-J.; Zhi, M.-L.; Shi, W.-X.; Chu, X.-Q.; Shen, Z.-L.; Loh, T.-P. Adv. Synth. Catal. 2018, 360, 2632.
doi: 10.1002/adsc.v360.14 |
|
|
(d) Shen, L.; Zhao, K.; Doitomi, K.; Ganguly, R.; Li, Y.-X.; Shen, Z.-L.; Hirao, H.; Loh, T.-P. J. Am. Chem. Soc. 2017, 139, 13570.
doi: 10.1021/jacs.7b07997 |
|
| [12] |
(a) Ollevier, T. Org. Biomol. Chem. 2013, 11, 2740.
doi: 10.1039/c3ob26537d pmid: 23380745 |
|
(b) Wu, Z.; Feng, X.-X.; Wang, Q.-D.; Yun, J.-J.; Rao, W.; Yang, J.-M.; Shen, Z.-L. Chin. Chem. Lett. 2020, 31, 1297.
doi: 10.1016/j.cclet.2019.09.017 pmid: 23380745 |
|
| [13] |
(a) Chen, C.; Liu, P.; Luo, M.; Zeng, X. ACS Catal. 2018, 8, 5864.
doi: 10.1021/acscatal.8b01380 |
|
(b) Li, Y.; Deng, G.; Zeng, X. Organometallics 2016, 35, 747.
doi: 10.1021/acs.organomet.5b01021 |
|
|
(c) Yun, J.-J.; Liu, X.-Y.; Deng, W.; Chu, X.-Q.; Shen, Z.-L.; Loh, T.-P. J. Org. Chem. 2018, 83, 10898.
doi: 10.1021/acs.joc.8b01584 |
|
| [14] |
(a) Enthaler, S.; Junge, K.; Beller, M. Angew. Chem. Int. Ed. 2008, 47, 3317.
doi: 10.1002/(ISSN)1521-3773 |
|
(b) Bauer, I.; Knölker, H.-J. Chem. Rev. 2015, 115, 3170.
doi: 10.1021/cr500425u |
|
|
(c) Xiong, H.; Ramkumar, N.; Chiou, M.-F.; Jian, W.; Li, Y.; Su, J.-H.; Zhang, X.; Bao, H. Nat. Commun. 2019, 10, 122.
doi: 10.1038/s41467-018-07985-2 |
|
|
(d) Wei, R.; Xiong, H.; Ye, C.; Li, Y.; Bao, H. Org. Lett. 2020, 22, 3195.
doi: 10.1021/acs.orglett.0c00969 |
|
|
(e) Deng, W.; Ye, C.; Li, Y.; Li, D.; Bao, H. Org. Lett. 2019, 21, 261.
doi: 10.1021/acs.orglett.8b03689 |
|
|
(f) He, Z.; Fan, M.; Xu, J.; Hu, Y.; Wang, L.; Wu, X.; Xia, C.; Liu, C. Chin. J. Org. Chem. 2019, 39, 3438.
doi: 10.6023/cjoc201909008 |
|
| [15] |
(a) Takai, K.; Kakiuchi, T.; Utimoto, K. J. Org. Chem. 1994, 59, 2671.
doi: 10.1021/jo00089a003 |
|
(b) Cheng, B.-Q.; Zhao, S.-W.; Song, X.-D.; Chu, X.-Q.; Rao, W.; Loh, T.-P.; Shen, Z.-L. J. Org. Chem. 2019, 84, 5348.
doi: 10.1021/acs.joc.9b00370 |
|
| [16] |
(a) Cheng, B.-Q.; Zhang, S.-X.; Cui, Y.-Y.; Chu, X.-Q.; Rao, W.; Xu, H.; Han, G.-Z.; Shen, Z.-L. Org. Lett. 2020, 22, 5456.
doi: 10.1021/acs.orglett.0c01828 |
|
(b) Chu, X.-Q.; Cheng, B.-Q.; Zhang, Y.-W.; Ge, D.; Shen, Z.-L.; Loh, T.-P. Chem. Commun. 2018, 54, 2615.
doi: 10.1039/C7CC09571F |
|
|
(c) Wang, P.; Chen, B.-Z.; Guo, Y.-C.; Rao, W.; Shen, Z.-L. Tetrahedron Lett. 2019, 60, 151288.
doi: 10.1016/j.tetlet.2019.151288 |
|
|
(d) Wu, L.-H.; Zhao, K.; Shen, Z.-L.; Loh, T.-P. Org. Chem. Front. 2017, 4, 1872.
doi: 10.1039/C7QO00416H |
|
|
(e) Liu, B.; Xu, X.; Huang, L.; Feng, H. Chin. J. Org. Chem. 2020, 40, 1290.
doi: 10.6023/cjoc201911020 |
|
|
(f) Huang, S.; Nie, Y.; Yang, J.; Zheng, Z.; Cao, J.; Xu, Z.; Xu, L. Chin. J. Org. Chem. 2020, 40, 2018.
doi: 10.6023/cjoc202003035 |
|
| [17] |
Wu, Z.; Feng, X.-X.; Wang, Q.-D.; Liu, X.-Y.; Rao, W.; Yang, J.-M.; Shen, Z.-L. Chin. Chem. Lett. 2020, 31, 391.
doi: 10.1016/j.cclet.2019.07.030 |
| [18] |
(a) Chen, B.-Z.; Zhi, M.-L.; Wang, C.-X.; Chu, X.-Q.; Shen, Z.-L.; Loh, T.-P. Org. Lett. 2018, 20, 1902.
doi: 10.1021/acs.orglett.8b00441 |
|
(b) Liu, X.-Y.; Cheng, B.-Q.; Guo, Y.-C.; Chu, X.-Q.; Li, Y.-X.; Loh, T.-P.; Shen, Z.-L. Adv. Synth. Catal. 2019, 361, 542.
doi: 10.1002/adsc.v361.3 |
|
| [19] |
(a) Tay, N. E. S.; Chen, W.; Levens, A.; Pistritto, V. A.; Huang, Z.; Wu, Z.; Li, Z.; Nicewicz, D. A. Nat. Catal. 2020, 3, 734.
doi: 10.1038/s41929-020-0495-0 |
|
(b) Bhattacharyya, A.; Kavitha, C. V.; Ghorai, M. K.; J. Org. Chem. 2016, 81, 643.
|
|
|
(c) Kirihara, M.; Osugi, R.; Saito, K.; Adachi, K.; Yamazaki, K.; Matsushima, R.; Kimura, Y. J. Org. Chem. 2019, 84, 8330.
doi: 10.1021/acs.joc.9b01132 |
| [1] | 陈乡萍, 孟晨湘, 李梦娜, 楚尚敏, 朱欣欣, 许凯, 刘澜涛, 王涛, 张凤华, 李飞. 水相中抗坏血酸钠促进铁催化合成含硫芳香伯胺化合物[J]. 有机化学, 2023, 43(8): 2800-2807. |
| [2] | 左鑫, 许诗诺, 陈忠洋, 鄢剑锋, 袁耀锋. 茂铁类单分子结电子传输性质的研究进展[J]. 有机化学, 2023, 43(7): 2313-2322. |
| [3] | 窦谦, 汪太民, 房丽晶, 翟宏斌, 程斌. 光诱导铁催化在有机合成中的应用研究进展[J]. 有机化学, 2023, 43(4): 1386-1415. |
| [4] | 孙伟, 朱守非. 铁系金属催化烯烃与三级硅烷的硅氢化反应研究进展[J]. 有机化学, 2023, 43(10): 3339-3351. |
| [5] | 赖燕琴, 陈雪, 陈芳, 倪林晨, 王婷, 祝子坪, 满菊, 姜春筱, 谢振达. 溶酶体靶向远红光至近红外荧光探针用于监测铁死亡过程中粘度的变化[J]. 有机化学, 2022, 42(9): 2850-2856. |
| [6] | 戴力, 徐迪, 毛翼斐, 朱嘉琦, 杨梦娇. 手性噁唑啉二茂铁化合物结构与合成方法[J]. 有机化学, 2022, 42(8): 2364-2375. |
| [7] | 王泽坤, 徐子悦, 李娟娟, 余尚博, 王辉, 郭东升, 张丹维, 黎占亭. 超分子有机框架对分子容器的水相增溶的梯度增强效应[J]. 有机化学, 2022, 42(7): 2236-2242. |
| [8] | 周文见, 肖欣蕊, 刘永红, 张旭. 磁性Se/Fe/PCN催化烯烃在氧气中的氧化裂解反应[J]. 有机化学, 2022, 42(6): 1849-1855. |
| [9] | 王凯凯, 陈绍维, 李亚军, 李达谅, 鲍红丽. 铁催化1,3-共轭烯烃的Heck型脱羧烷基化反应[J]. 有机化学, 2021, 41(7): 2707-2714. |
| [10] | 朱庆, 夏春谷, 刘超. 铁催化酮羰基的硼化反应合成α-羟基硼酸酯[J]. 有机化学, 2021, 41(2): 661-668. |
| [11] | 卢小彪, 肖茜, 章明, 万常峰, 侯豪情, 万结平. 铁盐催化的高选择性合成2-取代的吡啶并[2,3-b]吲哚衍生物[J]. 有机化学, 2021, 41(11): 4444-4449. |
| [12] | 邬林洋, 钟大猷, 刘文博. 无配体参与的铁催化分子内C(sp3)—H键胺化合成咪唑啉酮[J]. 有机化学, 2021, 41(10): 4083-4087. |
| [13] | 马素芳, 余强, 陆利, 李丽红, 刘文, 武志芳, 李思进. 亚铁离子荧光探针的研究进展[J]. 有机化学, 2021, 41(1): 229-240. |
| [14] | 刘玉婷, 李洁, 尹大伟. 基于二茂铁的金属阳离子识别受体的研究进展[J]. 有机化学, 2021, 41(1): 158-170. |
| [15] | 刘贵园, 郭大乐, 邓赟, 令狐浪, 张茂生, 何芋歧, 肖世基. 长苞铁杉中木脂素类化学成分研究[J]. 有机化学, 2020, 40(7): 2120-2126. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||