有机化学 ›› 2021, Vol. 41 ›› Issue (12): 4535-4553.DOI: 10.6023/cjoc202109007 上一篇 下一篇
综述与进展
邹宁a, 覃小婷a, 王治新a, 石维敏b,*( ), 莫冬亮a,*(
), 莫冬亮a,*( )
)
收稿日期:2021-09-03
修回日期:2021-10-30
发布日期:2021-11-09
通讯作者:
石维敏, 莫冬亮
基金资助:
Ning Zoua, Xiaoting Qina, Zhixin Wanga, Weimin Shib( ), Dongliang Moa(
), Dongliang Moa( )
)
Received:2021-09-03
Revised:2021-10-30
Published:2021-11-09
Contact:
Weimin Shi, Dongliang Mo
Supported by:文章分享

在有机合成化学中, 硝酮作为有机合成中重要的1,3-偶极子, 由于其具有稳定性好、易合成和反应活性高等优点, 能够参与各种有机合成反应, 如氧转移反应、环加成反应、重排反应以及C—H键活化等, 可以用于合成各种各样的杂环化合物, 是进一步构建复杂分子的重要有机砌块. 近年来, α,β-不饱和硝酮由于其α,β-不饱和键具有较强的化学转化能力, 可以参与各种新型的化学转化合成结构新颖的杂环化合物, 从而引起了合成化学家的广泛关注. 综述了近十年来α,β-不饱和硝酮合成的新策略, 及其应用于构建各类骨架新颖的含氮杂环化合物, 包括氧转移反应、与亲核试剂或自由基的加成反应以及各种环加成反应.
邹宁, 覃小婷, 王治新, 石维敏, 莫冬亮. α,β-不饱和硝酮的合成及其应用的研究进展[J]. 有机化学, 2021, 41(12): 4535-4553.
Ning Zou, Xiaoting Qin, Zhixin Wang, Weimin Shi, Dongliang Mo. Advances on the Synthesis and Application of α,β-Unsaturated Nitrones[J]. Chinese Journal of Organic Chemistry, 2021, 41(12): 4535-4553.

| [1] |
(a) Smith, L. L. Chem. Rev. 1938, 38, 193.
pmid: 20111795 |
|
(b) Bartoli, G.; Marcantoni, E.; Petrini, M. J. Org. Chem. 1990, 55, 4456.
doi: 10.1021/jo00301a046 pmid: 20111795 |
|
|
(c) Braum, K. R.; Freysoldt, T. H. E.; Wierschem, F. Chem. Soc. Rev. 2005, 34, 507.
doi: 10.1039/b311200b pmid: 20111795 |
|
|
(d) Pellissier, H. Tetrahedron 2007, 63, 3235.
doi: 10.1016/j.tet.2007.01.009 pmid: 20111795 |
|
|
(e) Nair, V.; Suja, T. D. Tetrahedron 2007, 63, 12247.
doi: 10.1016/j.tet.2007.09.065 pmid: 20111795 |
|
|
(f) Brandi, A.; Cardona, F.; Cicchi, S.; Cordero, F. M.; Goti, A. Chem.-Eur. J. 2009, 15, 7808.
doi: 10.1002/chem.v15:32 pmid: 20111795 |
|
|
(g) Najera, C.; Sansano, J. M. Org. Biomol. Chem. 2009, 7, 4567.
doi: 10.1039/b913066g pmid: 20111795 |
|
|
(h) Kissane, M.; Maguire, A. R. Chem. Soc. Rev. 2010, 39, 845.
doi: 10.1039/b909358n pmid: 20111795 |
|
| [2] |
(a) Saha, N.; Biswas, T.; Chattopadhyay, S. K. Org. Lett. 2011, 13, 5128.
doi: 10.1021/ol2019967 pmid: 26376282 |
|
(b) Hodges, A. J.; Adams, J. P.; Bond, A. D.; Holmes, A, B.; Press, N. J.; Roughley, S. D.; Ryan, J. H.; Saubern, S.; Smith, C. J.; Turnbull, M. D.; Newton, A. F. Org. Biomol. Chem. 2012, 10, 8963.
pmid: 26376282 |
|
|
(c) Martella, D.; Cardona, F.; Parmeggiani, C.; Franco, F.; Tamayo, J. A.; Robina, I.; Moreno-Clavijo, E.; Moreno-Vargas, A. J.; Goti, A. Eur. J. Org. Chem. 2013, 19, 4047.
pmid: 26376282 |
|
|
(d) Ideue, E.; Shimokawa, J.; Fukuyama, T. Org. Lett. 2015, 17, 4964.
doi: 10.1021/acs.orglett.5b02373 pmid: 26376282 |
|
| [3] |
(a) Breslow, R. Angew. Chem., Int. Ed. 1968, 7, 565.
doi: 10.1002/(ISSN)1521-3773 pmid: 26467943 |
|
(b) Black, D. S. C.; Crozier, R. F.; Davis, V. C. Synthesis 1975, 205.
pmid: 26467943 |
|
|
(c) Claire, A. Future Med. Chem. 2012, 4, 9.
doi: 10.4155/fmc.11.173 pmid: 26467943 |
|
|
(d) Ma, L.-L.; Wang, W.; Wang, G.-C. RSC Adv. 2016, 6, 53839.
doi: 10.1039/C6RA07873G pmid: 26467943 |
|
|
(e) Clementson, S.; Radaelli, A.; Fjebye, K.; Tanner, D.; Jessing, M. Org. Lett. 2019, 21, 4763.
doi: 10.1021/acs.orglett.9b01652 pmid: 26467943 |
|
|
(f) Zhao, D.; Zhang, J.; Xie, Z. J. Am. Chem. Soc. 2015, 137, 13938.
doi: 10.1021/jacs.5b09074 pmid: 26467943 |
|
| [4] |
(a) Zhou, Z.; Liu, G.; Chen, Y.; Lu, X. Adv. Synth. Catal. 2015, 357, 2944.
doi: 10.1002/adsc.v357.13 pmid: 30047738 |
|
(b) Wang, H.; Moselage, M.; Gonzalez, M. J.; Ackermann, L. ACS Catal. 2016, 6, 2705.
doi: 10.1021/acscatal.5b02937 pmid: 30047738 |
|
|
(c) Bai, D.; Jia, Q.; Xu, T.; Zhang, Q.; Wu, F.; Ma, C.; Liu, B.; Chang, J.; Li, X. J. Org. Chem. 2017, 82, 9877.
doi: 10.1021/acs.joc.7b01574 pmid: 30047738 |
|
|
(d) Pandey, A. K.; Kang, D.; Han, S. H.; Lee, H.; Mishra, N. K.; Kim, H. S.; Jung, Y. H.; Hong, S.; Kim, I. S. Org. Lett. 2018, 20, 4632.
doi: 10.1021/acs.orglett.8b01910 pmid: 30047738 |
|
|
(e) Li, Y.; Xie, F.; Liu, Y.; Yang, X.; Li, X. Org. Lett. 2018, 20, 437.
doi: 10.1021/acs.orglett.7b03775 pmid: 30047738 |
|
|
(f) Murahashi, S.-I.; Imada, Y. Chem. Rev. 2019, 119, 4684.
doi: 10.1021/acs.chemrev.8b00476 pmid: 30047738 |
|
| [5] |
For some examples with alkenes, see: (a) Confalone, P. N.; Huie, E. M. Org. React. 2004, 36, 1.
pmid: 25333970 |
|
(b) Morita, N.; Fukui, K.; Irikuchi, J.; Sato, H.; Takano, Y.; Okamoto, I.; Ishibashi, H.; Tamura, O. J. Org. Chem. 2008, 73, 7164.
doi: 10.1021/jo800878p pmid: 25333970 |
|
|
(c) Nguyen, T. B.; Martel, A.; Dhal, R.; Dujardin, G. Org. Lett. 2008, 10, 4493.
doi: 10.1021/ol8017243 pmid: 25333970 |
|
|
(d) Bokach, N. A.; Kuznetsov, M. L.; Kukushkin, V. Y. Coord. Chem Rev. 2011, 255, 2946.
doi: 10.1016/j.ccr.2011.07.001 pmid: 25333970 |
|
|
(e) Lahiri, R.; Palanivel, A.; Kulkarni, S. A.; Vankar, Y. D. J. Org. Chem. 2014, 79, 10786.
doi: 10.1021/jo5016745 pmid: 25333970 |
|
|
(f) Kumar, C. V. S.; Ramana, C. V. Org. Lett. 2015, 17, 2870.
doi: 10.1021/acs.orglett.5b00837 pmid: 25333970 |
|
|
(g) Ghosh, A.; Mane, M. V.; Rode, H. B.; Patil, S. A.; Sridhar, B.; Dateer, R. B. Chem.-Asian. J. 2020, 15, 1.
doi: 10.1002/asia.v15.1 pmid: 25333970 |
|
| [6] |
For some examples with alkynes, see: (a) Lu, C.; Dubrovskiy, A. V.; Larock, R. C. J. Org. Chem. 2012, 77, 2279.
doi: 10.1021/jo2025064 pmid: 28862453 |
|
(b) Bhunia, S.; Chang, C. J.; Liu, R. S. Org. Lett. 2012, 14, 5522.
doi: 10.1021/ol302621z pmid: 28862453 |
|
|
(c) Mckay, C. S.; Chigrinova, M.; Blake, J. A.; Peaccki, J. P. Org. Biomol. Chem. 2012, 10, 3066.
doi: 10.1039/c2ob07165g pmid: 28862453 |
|
|
(d) Zhang, Y. Q.; Zhang, J. L. Chem. Commun. 2012, 48, 4710.
doi: 10.1039/c2cc30309d pmid: 28862453 |
|
|
(e) Qi, Z. S.; Wang, M.; Li, X. W. Org. Lett. 2013, 15, 5440.
doi: 10.1021/ol4025309 pmid: 28862453 |
|
|
(f) Huehls, C. B.; Huang, J.; Yang, J. Tetrahedron 2015, 71, 3593.
doi: 10.1016/j.tet.2015.02.069 pmid: 28862453 |
|
|
(g) Huple, D. B.; Ghorpade, S.; Liu, R.-S. Adv. Synth. Catal. 2016, 358, 1348.
doi: 10.1002/adsc.201600018 pmid: 28862453 |
|
|
(i) Tangara, S.; Aupic, C.; Kanazawa, A.; Poisson, J.-F.; Py, S. Org. Lett. 2017, 19, 4842.
doi: 10.1021/acs.orglett.7b02283 pmid: 28862453 |
|
|
(h) Malig, T. C.; Yu, D.; Hein, J. E. J. Am. Chem. Soc. 2018, 140, 9167.
doi: 10.1021/jacs.8b04635 pmid: 28862453 |
|
|
(i) Zhang, G.; Alshreimi, A. S.; Alonso, L.; Antar, A.; Yu, H.-C.; Islan, S. M.; Anderson, L. L. Angew. Chem., Int. Ed. 2021, 60, 13089.
doi: 10.1002/anie.v60.23 pmid: 28862453 |
|
| [7] |
(a) Malinina, J.; Tran, T. Q.; Stepakov, A. V.; Gurzhiy, V. V.; Starova, G. L.; Kostikov, R. R.; Molchanov, A. P. Tetrahedron Lett. 2014, 55, 3663.
doi: 10.1016/j.tetlet.2014.04.107 pmid: 27682854 |
|
(b) Anderson, L. L.; Kroc, M. A.; Reidl, T. W.; Son, J J. Org. Chem. 2016, 81, 9521.
pmid: 27682854 |
|
|
(c) Lee, W.; Yuan, M.; Ashley, C.; Onwu, A.; Gutierrez, O. Org. Biomol. Chem. 2019, 17, 1767.
doi: 10.1039/C8OB02346H pmid: 27682854 |
|
| [8] |
(a) Namitharan, K.; Pitchumani, K. Org. Lett. 2011, 13, 5278.
doi: 10.1021/ol202080x |
|
(b) Qin, C.; Davies, H. M. L. J. Am. Chem. Soc. 2013, 135, 14516.
doi: 10.1021/ja4069003 |
|
|
(c) Wozniak, L.; Krajewska, O. S.; Michalak, M. Chem. Commun. 2015, 51, 1933.
doi: 10.1039/C4CC08742A |
|
| [9] |
(a) Bartoli, G.; Marcantoni, E.; Petrini, M. J. Org. Chem. 1990, 55, 4456.
doi: 10.1021/jo00301a046 pmid: 16872207 |
|
(b) Denmark, S. E.; Montgomery, J. I. J. Org. Chem. 2006, 71, 6211.
pmid: 16872207 |
|
|
(c) Yang, J. Synlett 2012, 23, 2293.
doi: 10.1055/s-00000083 pmid: 16872207 |
|
| [10] |
(a) Shi, W.-M.; Ma, X.-P.; Su, G.-F.; Mo, D.-L. Org. Chem. Front. 2016, 3, 116.
doi: 10.1039/C5QO00122F pmid: 28327748 |
|
(b) Anderson, L. L. Asian J. Org. Chem. 2016, 5, 9.
doi: 10.1002/ajoc.201500211 pmid: 28327748 |
|
|
(c) Merino, P.; Tejero, T.; Delso, I.; Matute, R. Org. Biomol. Chem. 2017, 15, 3364.
doi: 10.1039/c7ob00429j pmid: 28327748 |
|
|
(d) Murahashi, S.-I.; Imada, Y. Chem. Rev. 2019, 119, 4684.
doi: 10.1021/acs.chemrev.8b00476 pmid: 28327748 |
|
|
(e) Sukhorukov, A. Y. Adv. Synth. Catal. 2020, 362, 724.
doi: 10.1002/adsc.201900718 pmid: 28327748 |
|
|
(f) Thakur, S.; Das, A.; Das, T. New J. Chem. 2021, 45, 11420.
doi: 10.1039/D1NJ02023D pmid: 28327748 |
|
|
(g) Wang, L.; Zhang, Z.; Han, H.; Liu, X.; Bu, Z.; Wang, Q. Chin. J. Org. Chem. 2021, 41, 12. (in Chinese)
doi: 10.6023/cjoc202007045 pmid: 28327748 |
|
|
( 王乐乐, 张子莹, 韩华彬, 刘雄利, 卜站伟, 王琪琳, 有机化学, 2021, 41, 12.)
doi: 10.6023/cjoc202007045 pmid: 28327748 |
|
| [11] |
(a) Confalone, P. N.; Huie, E. M. Org. React. 1988, 36, 1.
|
|
(b) Soldaini, G.; Cardona, F.; Goti, A. Org. Lett. 2007, 9, 473.
doi: 10.1021/ol062862w |
|
|
(c) Gella, C.; Ferrer, E.; Alibes, R.; Busque, F.; de March, P.; Figueredo, M.; Font, J. J. Org. Chem. 2009, 74, 6365.
doi: 10.1021/jo901108u |
|
|
(d) Hota, S. K.; Chatterjee, A.; Bhattacharya, P. K.; Chattopadhyay, P. Green Chem. 2009, 11, 169.
doi: 10.1039/B812290C |
|
|
(e) Forcato, M.; Mba, M.; Nugent, W. A.; Licini, G. Eur. J. Org. Chem. 2010, 740.
|
|
|
(f) Abrantes, M.; Goncalves, I. S.; Pillinger, M.; Vurchio, C.; Cordero, F. M.; Brandi, A. Tetrahedron Lett. 2011, 52, 7079.
doi: 10.1016/j.tetlet.2011.10.079 |
|
|
(g) Zhang, Y. H.; Wu, M. Y.; Huang, W. C. RSC Adv. 2015, 5, 105825.
doi: 10.1039/C5RA21874H |
|
| [12] |
Hood, T. S.; Huehls, C. B.; Yang, J. Tetrahedron Lett. 2012, 53, 4679.
doi: 10.1016/j.tetlet.2012.06.083 |
| [13] |
Ma, X.-P.; Shi, W.-M.; Mo, X.-L.; Li, X.-H.; Li, L.-G.; Pan, C.-X.; Chen, B.; Su, G.-F.; Mo, D.-L. J. Org. Chem. 2015, 80, 10098.
doi: 10.1021/acs.joc.5b01716 |
| [14] |
Fraboni, A. J.; Brenner-Moyer, S. E. Org. Lett. 2016, 18, 2146.
doi: 10.1021/acs.orglett.6b00770 |
| [15] |
Li, Y.; Ng, J. S.; Wang, B.; Chiba, S. Org. Lett. 2021, 23, 5060.
doi: 10.1021/acs.orglett.1c01583 |
| [16] |
(a) Ma, X.-P.; Liu, F.-P.; Mo, D.-L. Chin. J. Org. Chem. 2017, 37, 1069. (in Chinese)
doi: 10.6023/cjoc201702001 |
|
( 马小盼, 刘凤萍, 莫冬亮, 有机化学, 2017, 37, 1069.)
doi: 10.6023/cjoc201702001 |
|
|
(b) Chen, J.-Q.; Li, J.-H.; Dong, Z.-B. Adv. Synth. Catal. 2020, 362, 3311.
doi: 10.1002/adsc.v362.16 |
|
| [17] |
(a) Mo, D.-L.; Wink, D. A.; Anderson, L. L. Org. Lett. 2012, 14, 5180.
doi: 10.1021/ol3022885 |
|
(b) Chen, C.-H.; Liu, Q.-Q.; Ma, X.-P.; Feng, Y.; Liang, C.; Pan, C.-X.; Su, G.-F.; Mo, D.-L. J. Org. Chem. 2017, 82, 6417.
doi: 10.1021/acs.joc.7b00620 |
|
|
(c) Mo, X.-L.; Chen, C.-H.; Liang, C.; Mo, D.-L. Eur. J. Org. Chem. 2018, 2018, 150.
doi: 10.1002/ejoc.v2018.2 |
|
| [18] |
Kontokosta, D.; Mueller, D. S.; Mo, D.-L.; Pace, W. H.; Simpson, R. A.; Anderson, L. L. Beilstein J. Org. Chem. 2015, 11, 2097.
doi: 10.3762/bjoc.11.226 pmid: 26664630 |
| [19] |
Nakamura, I.; Onuma, T.; Kanazawa, R.; Nishigai, Y.; Terada, M. Org. Lett. 2014, 16, 4198.
doi: 10.1021/ol501889g pmid: 25058679 |
| [20] |
Li, X.; Yan, W.; Zhang, R.; Chang, H.; Gao, W.; Tian, X.; Wei, W. Synthesis 2019, 51, 4043.
doi: 10.1055/s-0039-1690186 |
| [21] |
Nakamura, I.; Okamoto, M.; Sato, Y.; Terada, M. Angew. Chem., Int. Ed. 2012, 51, 10816.
doi: 10.1002/anie.v51.43 |
| [22] |
Nakamura, I.; Sato, Y.; Takeda, K.; Terada, M. Chem.-Eur. J. 2014, 20, 10214.
doi: 10.1002/chem.201403637 pmid: 25044489 |
| [23] |
Chen, F.; Yang, X.-L.; Wu, Z.-W.; Han, B. J. Org. Chem. 2016, 81, 3042.
doi: 10.1021/acs.joc.6b00180 pmid: 26954339 |
| [24] |
Huehls, C. B.; Hood, T. S.; Yang, J. Angew. Chem., Int. Ed. 2012, 51, 5110.
doi: 10.1002/anie.201200860 |
| [25] |
Mo, D.-L.; Wink, D. J.; Anderson, L. L. Chem.-Eur. J. 2014, 20, 13217.
doi: 10.1002/chem.201403268 |
| [26] |
Huehls, C. B.; Huang, J.; Yang, J. Tetrahedron 2015, 71, 3593.
doi: 10.1016/j.tet.2015.02.069 |
| [27] |
Pace, W. H.; Mo, D.-L.; Reidl, T. W.; Wink, D. J.; Anderson, L. L. Angew. Chem., Int. Ed. 2016, 55, 9183.
doi: 10.1002/anie.v55.32 |
| [28] |
Ma, X.-P.; Li, K.; Wu, S.-Y.; Liang, C.; Su, G.-F.; Mo, D.-L. Green. Chem. 2017, 19, 5761.
doi: 10.1039/C7GC02844J |
| [29] |
Kroc, M. A.; Prajapati, A.; Wink, D. J.; Anderson, L. L. J. Org. Chem. 2018, 83, 1085.
doi: 10.1021/acs.joc.7b02638 |
| [30] |
Xu, P.-P.; Liao, J.-Y.; Zhang, J.-J.; Shi, W.-M.; Liang, C.; Su, G.-F.; Mo, D.-L. Org. Lett. 2021, 23, 7482.
doi: 10.1021/acs.orglett.1c02695 |
| [31] |
Ghosh, A.; Mane, M. V.; Rode, H. B.; Patil, S. A.; Sridhar, B.; Dateer, R. B. Chem.-Asian. J. 2020, 15, 899.
doi: 10.1002/asia.v15.6 |
| [32] |
Zhao, J.; Huang, B.-Q.; Zhu, B.-C.; Ma, X.-P.; Mo, D.-L. Adv. Synth. Catal. 2021, 363, 4575.
doi: 10.1002/adsc.v363.19 |
| [33] |
Mo, D.-L.; Anderson, L. L. Angew. Chem., Int. Ed. 2013, 52, 6722.
doi: 10.1002/anie.v52.26 |
| [34] |
Mo, D.-L.; Pecak, W. H.; Zhao, M.; Wink, D. J.; Anderson, L. L. Org. Lett. 2014, 16, 3696.
doi: 10.1021/ol501503a |
| [35] |
Kumar, Y.; Singh, P.; Bhargave, G. New J. Chem. 2016, 40, 8216.
doi: 10.1039/C6NJ01747A |
| [36] |
Kroc, M. A.; Markiewicz, M.; Pace, W. H.; Wink, D. J.; Anderson, L. L. Chem. Commun. 2019, 55, 2309.
doi: 10.1039/C8CC10313E |
| [37] |
Zou, N.; Jiao, J.-W.; Feng, Y.; Chen, C.-H.; Liang, C.; Su, G.-F.; Mo, D.-L. Adv. Synth. Catal. 2017, 359, 3545.
doi: 10.1002/adsc.v359.20 |
| [38] |
Ma, X.-P.; Li, L.-G.; Zhao, H.-P.; Du, M.; Liang, C.; Mo, D.-L. Org. Lett. 2018, 20, 4571.
doi: 10.1021/acs.orglett.8b01761 |
| [39] |
Ma, X.-P.; Nong, C.-M.; Zhao, J.; Lu, X.; Liang, C.; Mo, D.-L. Adv. Synth. Catal. 2020, 6, 478.
|
| [40] |
Ma, X.-P.; Nong, C.-M.; Liang, Y.-F.; Xu, P.-P.; Guo, X.-Y.; Liang, C.; Pan, C.-X.; Su, G.-F.; Mo, D.-L. Green Chem. 2020, 22, 3827.
doi: 10.1039/D0GC00929F |
| [41] |
Chen, C.-H.; Wu, Q.-Y.; Wei, C.; Liang, C.; Su, G.-F.; Mo, D.-L. Green Chem. 2018, 20, 2722.
doi: 10.1039/C8GC00630J |
| [42] |
Liao, J.-Y.; Wu, Q.-Y.; Lu, X.; Zou, N.; Pan, C.-X.; Liang, C.; Su, G.-F.; Mo, D.-L. Green Chem. 2019, 21, 6567.
doi: 10.1039/C9GC01811E |
| [43] |
Zou, N.; Lan, J.-X.; Yan, G.-G.; Liang, C.; Su, G.-F.; Mo, D.-L. Org. Lett. 2020, 22, 8446.
doi: 10.1021/acs.orglett.0c02947 |
| [44] |
Zou, N.; Jiao, J.-W.; Feng, Y.; Pan, C.-X.; Liang, C.; Su, G.-F.; Mo, D.-L. Org. Lett. 2019, 21, 481.
doi: 10.1021/acs.orglett.8b03767 |
| [45] |
Jia, Q.; Li, D.; Lang, M.; Zhang, K.; Wang, J. Adv. Synth. Catal. 2017, 359, 3837.
doi: 10.1002/adsc.v359.21 |
| [46] |
Hasegawa, M.; Suga, T.; Soeta, T.; Ukaji, Y. J. Org. Chem. 2020, 85, 11258.
doi: 10.1021/acs.joc.0c01349 pmid: 32786638 |
| [47] |
Buchlovic, M.; Hebanova, S.; Potacek, M. Tetrahedron 2012, 68, 3117.
doi: 10.1016/j.tet.2012.01.043 |
| [1] | 陈祖良, 魏颖静, 张俊良. 供体-受体氮杂环丙烷碳-碳键断裂的环加成反应研究进展[J]. 有机化学, 2023, 43(9): 3078-3088. |
| [2] | 孔德亮, 戴闻, 赵怡玲, 陈艺林, 朱红平. 脒基胺硼基硅宾与单酮和二酮的氧化环加成反应研究[J]. 有机化学, 2023, 43(5): 1843-1851. |
| [3] | 戴春波, 夏思奇, 陈晓玉, 杨丽敏. 氮杂环卡宾(NHC)催化[4+3]环加成反应构建4-氨基苯并环庚烯内酯[J]. 有机化学, 2023, 43(3): 1084-1090. |
| [4] | 曾成富, 何媛, 李清, 董琳. Ir(III)催化新型三组分串联三氟乙氧基化反应并一锅法构建复杂酰胺化合物[J]. 有机化学, 2023, 43(3): 1115-1123. |
| [5] | 李硕, 王明亮, 周来运, 王兰芝. 磁性纳米负载对甲苯磺酸催化串联合成稠合多环的1,5-苯并氧氮杂䓬类化合物[J]. 有机化学, 2023, 43(11): 3977-3988. |
| [6] | 梁俊秀, 刘亚洲, 王阿木, 吴彦超, 马小锋, 李惠静. 基于原位形成的氮杂邻亚甲基苯醌和卤代萘酚的分子间[4+1]螺环化/去芳香化反应[J]. 有机化学, 2023, 43(11): 3888-3899. |
| [7] | 张维露, 陈绍维, 沈晓. 镍催化苯并硅杂环丁烷与酰基硅烷的[4+2]环化反应[J]. 有机化学, 2023, 43(10): 3635-3643. |
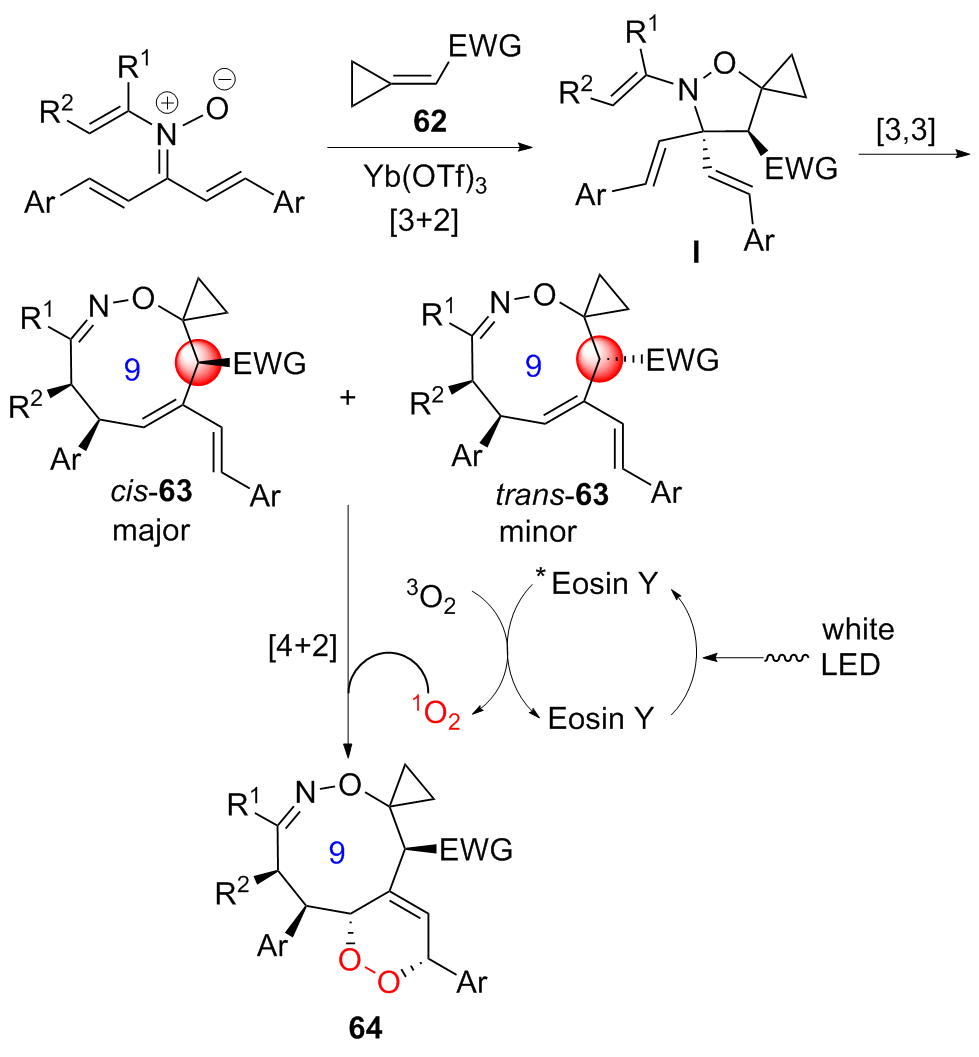
| [8] | 覃小婷, 邹宁, 农彩梅, 莫冬亮. 九元氮杂环化合物合成最新研究进展[J]. 有机化学, 2023, 43(1): 130-155. |
| [9] | 石云, 肖婷, 夏冬, 杨文超. 三氟甲硫基自由基引发不饱和烃的串联反应[J]. 有机化学, 2022, 42(9): 2715-2727. |
| [10] | 赵晓正, 凌琴琴, 曹桂妍, 火星, 赵小龙, 苏瀛鹏. 炔丙醇类化合物参与的环化反应研究进展[J]. 有机化学, 2022, 42(9): 2605-2639. |
| [11] | 高秋珊, 李蒙, 伍婉卿. 过渡金属催化的异腈插入反应研究进展[J]. 有机化学, 2022, 42(9): 2659-2681. |
| [12] | 王君姣, 吕瑜瑜, 尚永伟, 崔振丽, 王克虎, 黄丹凤, 胡雨来. α-羟基酮类化合物参与的反应研究进展[J]. 有机化学, 2022, 42(8): 2300-2321. |
| [13] | 周旭煜, 张爱君, 张庆庆, 刘庆安, 宣俊. 可见光诱导4-色满酮合成: 醋酸碘苯促进的α-酮酸与邻-烯丙氧基芳醛的自由基串联环化反应[J]. 有机化学, 2022, 42(8): 2488-2495. |
| [14] | 侯金松, 杨高升. 三(邻二甲胺基苄基)钇催化脂肪胺对烯腈的插入串联反应[J]. 有机化学, 2022, 42(7): 2070-2078. |
| [15] | 袁飞, 赵艳, 郭青松, 尹福丹, 赖金荣, 念倍芳, 张明, 汤峨. 乙烯基硒盐参与的串联反应合成1-[1-(胺基)环丙基]酮化合物[J]. 有机化学, 2022, 42(6): 1759-1769. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||