有机化学 ›› 2023, Vol. 43 ›› Issue (5): 1742-1750.DOI: 10.6023/cjoc202301018 上一篇 下一篇
所属专题: 有机硼化学专辑
综述与进展
收稿日期:2023-01-18
修回日期:2023-02-15
发布日期:2023-03-07
通讯作者:
张攀科, 徐森苗
Ke Jinga,b, Panke Zhanga( ), Senmiao Xub(
), Senmiao Xub( )
)
Received:2023-01-18
Revised:2023-02-15
Published:2023-03-07
Contact:
Panke Zhang, Senmiao Xu
文章分享
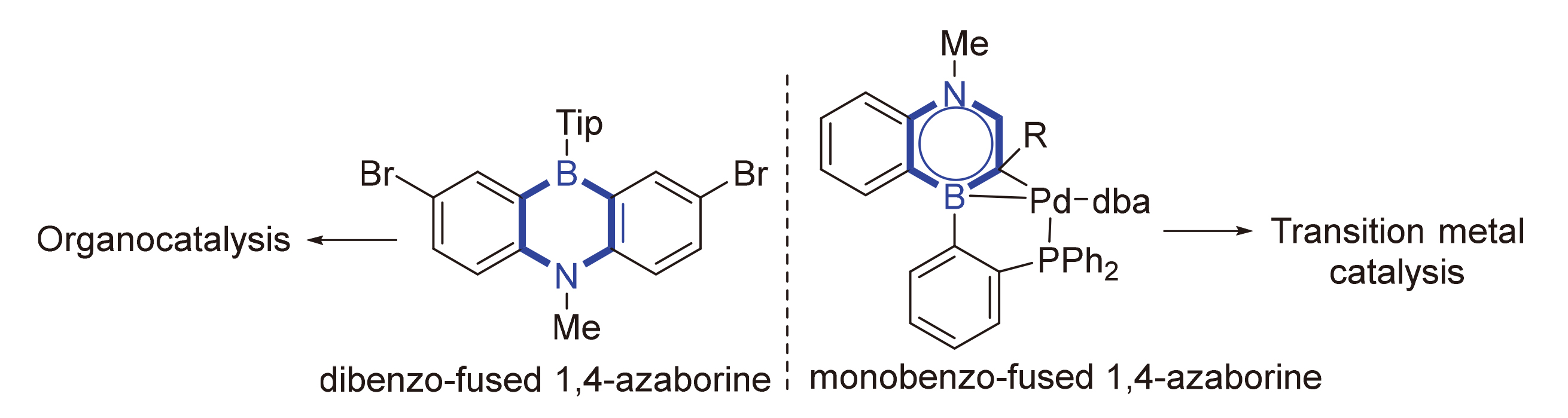
总结了1,4-氮硼杂芳环在有机和过渡金属催化中的最新进展, 涵盖三部分内容: 一是简要介绍了1,4-氮硼杂芳环的发展历史; 二是重点介绍了1,4-氮硼杂芳环作为有机小分子催化剂在光致氧化三芳基膦中的应用; 三是详细阐述了1,4-氮硼杂芳环作为配体在钯催化的烯炔的立体选择性硼化反应中的应用. 此外, 对这一领域的未来发展进行了展望.
景科, 张攀科, 徐森苗. 1,4-氮硼杂芳环在有机和过渡金属催化中的应用[J]. 有机化学, 2023, 43(5): 1742-1750.
Ke Jing, Panke Zhang, Senmiao Xu. Application of 1,4-Azaborines in Organic and Transition Metal Catalysis[J]. Chinese Journal of Organic Chemistry, 2023, 43(5): 1742-1750.
| [1] |
Lipscomb, W. N. Angew. Chem. 1977, 89, 685.
doi: 10.1002/ange.v89:10 |
| [2] |
Brown, H. C. Angew. Chem. 1980, 92, 675.
doi: 10.1002/(ISSN)1521-3757 |
| [3] |
Suzuki, A. Angew. Chem., Int. Ed. 2011, 50, 6722.
doi: 10.1002/anie.201101379 pmid: 21618370 |
| [4] |
Ji, L.; Griesbeck, S.; Marder, T. B. Chem. Sci. 2017, 8, 846.
doi: 10.1039/C6SC04245G |
| [5] |
McConnell, C. R.; Liu, S.-Y. Chem. Soc. Rev. 2019, 48, 3436.
doi: 10.1039/c9cs00218a pmid: 31134984 |
| [6] |
Giustra, Z. X.; Liu, S.-Y. J. Am. Chem. Soc. 2018, 140, 1184.
doi: 10.1021/jacs.7b09446 |
| [7] |
Chen, C.; Du, C.-Z.; Wang, X.-Y. Adv. Sci. 2022, 9, 2200707.
doi: 10.1002/advs.v9.19 |
| [8] |
Campbell, P. G.; Marwitz, A. J. V.; Liu, S.-Y. Angew. Chem., Int. Ed. 2012, 51, 6074.
doi: 10.1002/anie.201200063 pmid: 22644658 |
| [9] |
Abengózar, A.; García-García, P.; Fernández-Rodríguez, M. A.; Sucunza, D.; Vaquero, J. J. In Advances in Heterocyclic Chemistry, Eds.: Scriven, E. F. V.; Ramsden, C. A., Academic Press, 2021, Vol. 135, p.197.
|
| [10] |
Oda, S.; Hatakeyama, T. Bull. Chem. Soc. Jpn. 2021, 94, 950.
doi: 10.1246/bcsj.20200372 |
| [11] |
Shin, I.; Lim, H. N.; Hong, W. P. Synthesis 2021, 54, 570.
doi: 10.1055/s-0040-1719851 |
| [12] |
Morgan, M. M.; Piers, W. E. Dalton Trans. 2016, 45, 5920.
doi: 10.1039/C5DT03991F |
| [13] |
Wang, X.-Y.; Wang, J.-Y.; Pei, J. Chem.-Eur. J. 2015, 21, 3528.
doi: 10.1002/chem.v21.9 |
| [14] |
Liu, Z.; Marder, T. B. Angew. Chem., Int. Ed. 2008, 47, 242.
|
| [15] |
Marwitz, A. J. V.; Matus, M. H.; Zakharov, L. N.; Dixon, D. A.; Liu, S.-Y. Angew. Chem., Int. Ed. 2009, 48, 973.
doi: 10.1002/anie.200805554 pmid: 19105174 |
| [16] |
Xu, S.; Zakharov, L. N.; Liu, S.-Y. J. Am. Chem. Soc. 2011, 133, 20152.
doi: 10.1021/ja2097089 |
| [17] |
Li, J.; Daniliuc, C. G.; Mück-Lichtenfeld, C.; Kehr, G.; Erker, G. Angew. Chem., Int. Ed. 2019, 58, 15377.
doi: 10.1002/anie.v58.43 |
| [18] |
Liu, X.; Zhang, Y.; Li, B.; Zakharov, L. N.; Vasiliu, M.; Dixon, D. A.; Liu, S.-Y. Angew. Chem., Int. Ed. 2016, 55, 8333.
doi: 10.1002/anie.v55.29 |
| [19] |
Schäfer, M.; Beattie, N. A.; Geetharani, K.; Schäfer, J.; Ewing, W. C.; Krahfuß, M.; Hörl, C.; Dewhurst, R. D.; Macgregor, S. A.; Lambert, C.; Braunschweig, H. J. Am. Chem. Soc. 2016, 138, 8212.
doi: 10.1021/jacs.6b04128 pmid: 27286231 |
| [20] |
Braunschweig, H.; Damme, A.; Jimenez-Halla, J. O. C.; Pfaffinger, B.; Radacki, K.; Wolf, J. Angew. Chem., Int. Ed. 2012, 51, 10034.
doi: 10.1002/anie.201205795 pmid: 22952191 |
| [21] |
Maitlis, P. M. J. Chem. Soc. (Resumed) 1961, 425.
|
| [22] |
Agou, T.; Kobayashi, J.; Kawashima, T. Org. Lett. 2006, 8, 2241.
doi: 10.1021/ol060539n |
| [23] |
Xu, S.; Haeffner, F.; Li, B.; Zakharov, L. N.; Liu, S.-Y. Angew. Chem., Int. Ed. 2014, 53, 6795.
doi: 10.1002/anie.201403903 |
| [24] |
Xu, S.; Zhang, Y.; Li, B.; Liu, S.-Y. J. Am. Chem. Soc. 2016, 138, 14566.
doi: 10.1021/jacs.6b09759 |
| [25] |
Hatakeyama, T.; Shiren, K.; Nakajima, K.; Nomura, S.; Nakatsuka, S.; Kinoshita, K.; Ni, J.; Ono, Y.; Ikuta, T. Adv. Mater. 2016, 28, 2777.
doi: 10.1002/adma.201505491 |
| [26] |
Kondo, M.; Agou, T. Chem. Commun. 2022, 58, 5001.
doi: 10.1039/D2CC00782G |
| [27] |
Porcel, S.; Bouhadir, G.; Saffon, N.; Maron, L.; Bourissou, D. Angew. Chem., Int. Ed. 2010, 49, 6186.
doi: 10.1002/anie.201000520 |
| [28] |
Hayashi, T. Acc. Chem. Res. 2000, 33, 354.
doi: 10.1021/ar990080f |
| [29] |
Yang, Y.; Jiang, J.; Yu, H.; Shi, J. Chem.-Eur. J. 2018, 24, 178.
doi: 10.1002/chem.201704035 |
| [30] |
Zhang, Y.; Li, B.; Liu, S.-Y. Angew. Chem., Int. Ed. 2020, 59, 15928.
doi: 10.1002/anie.v59.37 |
| [31] |
Wang, Z.; Wu, J.; Lamine, W.; Li, B.; Sotiropoulos, J.-M.; Chrostowska, A.; Miqueu, K.; Liu, S.-Y. Angew. Chem., Int. Ed. 2021, 60, 21231.
doi: 10.1002/anie.v60.39 |
| [32] |
Wang, Z.; Lamine, W.; Miqueu, K.; Liu, S.-Y. Chem. Sci. 2023, 14, 2082.
doi: 10.1039/D2SC05828F |
| [1] | 刘杰, 韩峰, 李双艳, 陈天煜, 陈建辉, 徐清. 无过渡金属参与甲基杂环化合物与醇的选择性有氧烯基化反应[J]. 有机化学, 2024, 44(2): 573-583. |
| [2] | 董江湖, 宣良明, 王池, 赵晨熙, 王海峰, 严琼姣, 汪伟, 陈芬儿. 无过渡金属或无光催化剂条件下可见光促进喹喔啉酮C(3)—H官能团化研究进展[J]. 有机化学, 2024, 44(1): 111-136. |
| [3] | 赵红琼, 于淼, 宋冬雪, 贾琦, 刘颖杰, 季宇彬, 许颖. 羧酸脱羧羟基化反应研究进展[J]. 有机化学, 2024, 44(1): 70-84. |
| [4] | 王文芳. 过渡金属催化不对称C—H硼化反应研究进展[J]. 有机化学, 2023, 43(9): 3146-3166. |
| [5] | 程春霞, 吴露平, 沙风, 伍新燕. 手性叔膦-酰胺不对称催化香豆素与Morita-Baylis-Hillman碳酸酯之间的插烯烯丙基烷基化反应[J]. 有机化学, 2023, 43(9): 3188-3195. |
| [6] | 高晓阳, 翟锐锐, 陈训, 王烁今. 碳酸亚乙烯酯参与C—H键活化反应的研究进展[J]. 有机化学, 2023, 43(9): 3119-3134. |
| [7] | 陈新强, 张敬. 伯醇的脱羟甲基反应的研究进展[J]. 有机化学, 2023, 43(8): 2711-2719. |
| [8] | 徐忠荣, 万结平, 刘云云. 基于热、光以及电化学过程的无过渡金属碳-氢键硫氰化和硒氰化反应[J]. 有机化学, 2023, 43(7): 2425-2446. |
| [9] | 石义军, 孙馨悦, 曹晗, 别福升, 马杰, 刘哲, 丛兴顺. 室温下酯与伯硫醇的硫酯化反应[J]. 有机化学, 2023, 43(7): 2499-2505. |
| [10] | 董思凡, 李昊龙, 秦源, 范士明, 刘守信. 氨基酸作为瞬态导向基在碳氢键活化反应中的研究进展[J]. 有机化学, 2023, 43(7): 2351-2367. |
| [11] | 褚杨杨, 韩召斌, 丁奎岭. 动力学拆分在过渡金属催化的不对称(转移)氢化中的应用研究[J]. 有机化学, 2023, 43(6): 1934-1951. |
| [12] | 户晓兢, 郭斐翔, 朱润青, 周柄棋, 张涛, 房立真. 对烷氧基酚的合成及其去芳构化后的合成应用[J]. 有机化学, 2023, 43(6): 2239-2244. |
| [13] | 秦娇, 陈杰, 苏艳. 无过渡金属催化的α-溴代茚酮自由基裂解反应合成(2-氰基苯基)乙酸-2,2,6,6-四甲基哌啶酯[J]. 有机化学, 2023, 43(6): 2171-2177. |
| [14] | 徐光利, 许静, 徐海东, 崔香, 舒兴中. 过渡金属催化烯烃和炔烃合成1,3-共轭二烯化合物研究进展[J]. 有机化学, 2023, 43(6): 1899-1933. |
| [15] | 全翌雯, 蒋心惠, 李文军, 汪舰. 借助有机催化去共轭-羟醛缩合反应来获得α-乙烯基-β-炔基取代的烯醛[J]. 有机化学, 2023, 43(6): 2120-2125. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||