有机化学 ›› 2021, Vol. 41 ›› Issue (2): 443-454.DOI: 10.6023/cjoc202010005 上一篇 下一篇
所属专题: 热点论文虚拟合集
研究专题
收稿日期:2020-10-05
修回日期:2020-11-03
发布日期:2020-12-05
通讯作者:
赵晓丹
作者简介: |
姜权彬博士, 2016年在中国科学院大连化学物理研究所获得有机化学博士学位, 导师余正坤研究员. 现在中山大学化学学院博士后流动站从事博士后研究, 合作导师赵晓丹教授. 研究方向为烯烃的亲电转化. |
 |
赵晓丹教授, 2007年底在中国科学院大连化学物理研究所有机化学专业博士毕业, 导师余正坤研究员, 期间作为交换学生在加拿大渥太华大学Howard Alper课题组学习和从事研究工作一年. 2008~2010年在多伦多大学从事博士后研究, 合作导师Vy M. Dong教授. 2010~2013年在美国科罗拉多州立大学Tomislav Rovis课题组从事博士后研究. 2013年入职中山大学化学学院, 开始独立科研工作. 研究方向为有机硫属化合物催化、不对称催化和有机氟化学. |
基金资助:
Quanbin Jiang1, Xiaodan Zhao1,*( )
)
Received:2020-10-05
Revised:2020-11-03
Published:2020-12-05
Contact:
Xiaodan Zhao
Supported by:文章分享

手性含硫化合物在药物化学和不对称合成领域中应用广泛, 发展这类化合物的新合成方法是有机合成化学的重要任务. 烯烃的不对称亲电硫化反应为手性含硫化合物的合成提供了一条方便的途径, 通过这种方式不仅可以在烯烃母体分子上引入一个含硫基团, 同时也能够引入另外一个重要的官能团. 我们课题组设计、合成了一系列手性双官能硒醚/硫醚催化剂, 并成功将其应用在不同种类烯烃的分子内和分子间的不对称三氟甲硫基化、烷硫基化和芳硫基化反应, 高对映选择性地合成了各种手性含硫化合物. 总结了我们课题组在手性双官能硒醚/硫醚催化的烯烃不对称亲电硫化反应中的研究进展, 并对该领域的发展进行展望.
姜权彬, 赵晓丹. 手性双官能硫族化合物催化烯烃的不对称亲电硫化反应[J]. 有机化学, 2021, 41(2): 443-454.
Quanbin Jiang, Xiaodan Zhao. Chiral Bifunctional Chalcogenide-Catalyzed Enantioselective Electrophilic Thiofunctionalization of Alkenes[J]. Chinese Journal of Organic Chemistry, 2021, 41(2): 443-454.
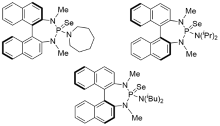
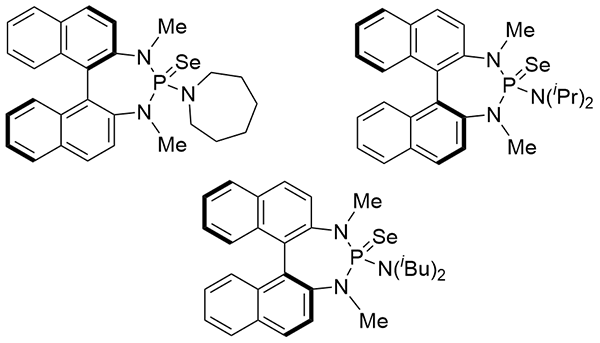



| [1] |
(a) Parry R.J. Tetrahedron 1983, 39, 1215.
doi: 10.1016/S0040-4020(01)91887-3 |
|
(b) Nudelman A. The Chemistry of Optically Active Sulfur Compounds, Gordon and Breach, New York, 1984.
|
|
|
(c) Anne C.; Turcaud S.; Quancard J.; Teffo F.; Meudal H.; Fournié-Zaluski M.-C.; Roques B.P. J. Med. Chem. 2003, 46, 4648.
doi: 10.1021/jm0300680 |
|
|
(d) McGrath N.A.; Brichacek M.; Njardarson J.T. J. Chem. Educ. 2010, 87, 1348.
doi: 10.1021/ed1003806 |
|
|
(e) Ilardi E.A.; Vitaku E.; Njardarson J.T. J. Med. Chem. 2014, 57, 2832.
doi: 10.1021/jm401375q |
|
|
(f) Feng M.; Tang B.; Liang S.H.; Jiang X. Curr. Top. Med. Chem. 2016, 16, 1200.
doi: 10.2174/1568026615666150915111741 |
|
|
(g) Scott K.A.; Njardarson J.T. Top. Curr. Chem. 2018, 376, 5.
|
|
| [2] |
(a) Counts G.W.; Gregory D.; Zeleznik D.; Turck M. Antimicrob. Agents Chemother. 1977, 11, 708.
doi: 10.1128/AAC.11.4.708 |
|
(b) Yagupolskii L.M.; Maletina I.I.; Petko K.I.; Fedyuk D.V.; Handrock R.; Shavaran S.S.; Klebanov B.M.; Herzig S. J. Fluorine Chem. 2001, 109, 87.
doi: 10.1016/S0022-1139(01)00382-7 |
|
|
(c) Pommier P.; Keïta A.; Wessel-Robert S.; Dellac B.; Mundt H.C. Rev. Med. Vet. 2003, 154, 41.
|
|
| [3] |
Chatgilialoglu C.; Asmus K.D. Sulfur - Centered Reactive Intermediates in Chemistry and Biology, Springer Verlag, New York, 1991.
|
|
(b) Masdeu-Bultó A.M.; Diéguez M.; Martin E.; Gómez M. Coord. Chem. Rev. 2003, 242, 159.
doi: 10.1016/S0010-8545(03)00106-1 |
|
|
(c) Otocka S; Kwiatkowska M.; Madalińska L.; Kiełbasiński P. Chem. Rev. 2017, 117, 4147.
doi: 10.1021/acs.chemrev.6b00517 |
|
| [4] |
(a) Kondo T.; Mitsudo T.-A. Chem. Rev. 2000, 100, 3205.
doi: 10.1021/cr9902749 |
|
(b) Clayden J.; MacLellan P. Beilstein J. Org. Chem. 2011, 7, 582.
doi: 10.3762/bjoc.7.68 |
|
|
(c) Chauhan P.; Mahajan S.; Enders D. Chem. Rev. 2014, 114, 8807.
doi: 10.1021/cr500235v |
|
|
(d) Yu J.-S.; Huang H.-M.; Ding P.-G.; Hu X.-S.; Zhou F.; Zhou J. ACS Catal. 2016, 6, 5319.
doi: 10.1021/acscatal.6b01496 |
|
| [5] |
(a) Pritɀius A.B.; Breit B. Angew. Chem. Int. Ed. 2015, 54, 3121.
doi: 10.1002/anie.201411402 |
|
(b) Kennemur J.L.; Kortman G.D.; Hull K.L. J. Am. Chem. Soc. 2016, 138, 11914.
doi: 10.1021/jacs.6b07142 |
|
|
(c) Yang X.-H.; Davison R.T.; Dong V.M. J. Am. Chem. Soc. 2018, 140, 10443.
doi: 10.1021/jacs.8b06957 |
|
|
(d) Yang X.-H.; Davison R.; Nie S.-Z.; Cruz F.A.; McGinnis T.M.; Dong V.M. J. Am. Chem. Soc. 2019, 141, 3006.
doi: 10.1021/jacs.8b11395 |
|
| [6] |
(a) Liu Y.; Sun B.; Wang B.; Wakem M.; Deng L. J. Am. Chem. Soc. 2009, 131, 418.
doi: 10.1021/ja8085092 |
|
(b) Hui Y.; Jiang J.; Wang W.; Chen W.; Cai Y.; Lin L.; Liu X.; Feng X. Angew. Chem. Int. Ed. 2010, 49, 4290.
doi: 10.1002/anie.v49:25 |
|
|
(c) White J. D.; Shaw, S.Chem. Sci. 2014, 5, 2200.
doi: 10.1039/C4SC00051J |
|
|
(d) Yang J.; Farley A. J. M.; Dixon D.J. Chem. Sci. 2017, 8, 606.
doi: 10.1039/C6SC02878K |
|
|
(e) Formica M.; Sorin G.; Farley A. J. M.; Díaz J.; Paton R.S.; Dixon D.J. Chem. Sci. 2018, 9, 6969.
doi: 10.1039/C8SC01804A |
|
| [7] |
(a) Zhao G.-L.; Rios R; Vesely J.; Eriksson L.; Córdova A. Angew. Chem. Int. Ed. 2008, 47, 8468.
doi: 10.1002/anie.v47:44 |
|
(b) Denmark S.E.; Vogler T. Chem.- Eur. J. 2009, 15, 11737.
doi: 10.1002/chem.200901377 |
|
|
(c) Mizar P.; Niebuhr R.; Hutchings M.; Farooq U.; Wirth T. Chem.- Eur. J. 2016, 22, 1614.
doi: 10.1002/chem.201504636 |
|
| [8] |
(a) Marigo M.; Wabnitz T.C.; Fielenbach D.; Jørgensen K.A. Angew. Chem. Int. Ed. 2005, 44, 794.
doi: 10.1002/anie.v44:5 pmid: 16366584 |
|
(b) Franzén J.; Marigo M.; Fielenbach D.; Wabnitz T.C.; Kjærsgaard A.; Jørgensen K.A. J. Am. Chem. Soc. 2005, 127, 18296.
pmid: 16366584 |
|
|
(c) Armstrong A.; Challinor L.; Moir J.H. Angew. Chem. Int. Ed. 2007, 46, 5369.
doi: 10.1002/(ISSN)1521-3773 pmid: 16366584 |
|
|
(d) Fang L.; Lin A.; Hu H.; Zhu C. Chem.- Eur. J. 2009, 15, 7039.
doi: 10.1002/chem.200901099 pmid: 16366584 |
|
|
(e) Li X.; Liu C.; Xue X.-S.; Cheng J.-P. Org. Lett. 2012, 14, 4374.
doi: 10.1021/ol301833f pmid: 16366584 |
|
|
(f) Han Z.; Chen W.; Dong S.; Yang C.; Liu H.; Pan Y.; Yan L.; Jiang Z. Org. Lett. 2012, 14, 4670.
doi: 10.1021/ol3021176 pmid: 16366584 |
|
| [9] |
(a) Denmark S.E.; Kuester W.E.; Burk M.T. Angew. Chem. Int. Ed. 2012, 51, 10938.
doi: 10.1002/anie.201204347 |
|
(b) Cheng Y.A.; Yu W.Z.; Yeung Y.-Y. Org. Biomol. Chem. 2014, 12, 2333.
doi: 10.1039/C3OB42335B |
|
|
(c) Sakakura A.; Ishihara K. Chem. Rec. 2015, 15, 728.
doi: 10.1002/tcr.v15.4 |
|
|
(d) Cresswell A.J.; Eey S.T.-C.; Denmark S.E. Angew. Chem. Int. Ed. 2015, 54, 15642.
doi: 10.1002/anie.201507152 |
|
|
(e) Gieuw M.H.; Ke Z.; Yeung Y.-Y. Chem. Rec. 2017, 17, 287.
doi: 10.1002/tcr.v17.3 |
|
|
(f) Landry M.L.; Burns N.Z. Acc. Chem. Res. 2018, 51, 1260.
doi: 10.1021/acs.accounts.8b00064 |
|
| [10] |
(a) Luo J.; Liu X.; Zhao X. Synlett 2017, 28, 397.
doi: 10.1055/s-0036-1588926 |
|
(b) Matviitsuk A.; Panger J.L.; Denmark S.E. Angew. Chem. Int. Ed. 2020, 59, 19796.
doi: 10.1002/anie.v59.45 |
|
| [11] |
(a) Archer N.J.; Rayner C.M.; Bell D.; Miller D. Synlett 1994, 617.
|
|
(b) Lucchini V.; Modena G.; Pasquato L. J. Chem. Soc. Chem. Commun. 1994, 1565.
|
|
| [12] |
(a) Guan H.; Wang H.; Huang D.; Shi Y. Tetrahedron 2012, 68, 2728.
doi: 10.1016/j.tet.2012.01.006 |
|
(b) Li L.; Li Z.; Huang D.; Wang H.; Shi Y. RSC Adv. 2013, 3, 4523.
doi: 10.1039/c3ra40307f |
|
| [13] |
(a) Denmark S.E.; Kornfilt D. J. P.; Vogler T. J. Am. Chem. Soc. 2011, 133, 15308.
doi: 10.1021/ja2064395 pmid: 25411883 |
|
(b) Denmark S.E.; Jaunet A. J. Am. Chem. Soc. 2013, 135, 6419.
doi: 10.1021/ja401867b pmid: 25411883 |
|
|
(c) Denmark S.E.; Chi H.M. J. Am. Chem. Soc. 2014, 136, 8915.
doi: 10.1021/ja5046296 pmid: 25411883 |
|
|
(d) Denmark S.E.; Hartmann E.; Kornfilt D. J. P.; Wang H. Nat. Chem. 2014, 6, 1056.
doi: 10.1038/nchem.2109 pmid: 25411883 |
|
|
(e) Tao Z.; Robb K.A.; Zhao K.; Denmark S. E.J. Am. Chem. Soc. 2018, 140, 3569.
doi: 10.1021/jacs.8b01660 pmid: 25411883 |
|
|
(f) Roth A.; Denmark S.E. J. Am. Chem. Soc. 2019, 141, 13767.
doi: 10.1021/jacs.9b07019 pmid: 25411883 |
|
|
(g) Matviitsuk A.; Denmark S.E. Angew. Chem. Int. Ed. 2019, 58, 12486.
doi: 10.1002/anie.v58.36 pmid: 25411883 |
|
|
(h) Xie Y.-Y.; Chen Z.-M.; Luo H.-Y.; Shao H.; Tu Y.-Q.; Bao X.; Cao R.-F. Zhang S.-Y.; Tian J.-M. Angew. Chem. Int. Ed. 2019, 58, 12491.
doi: 10.1002/anie.v58.36 pmid: 25411883 |
|
| [14] |
Denmark S.E.; Collins W.R.; Cullen M.D. J. Am. Chem. Soc. 2009, 131, 3490.
doi: 10.1021/ja900187y |
| [15] |
Hiyama T. Organofluorine Compounds : Chemistry and Applications, Springer, New York, 2000.
|
|
(b) Kirsch P. Modern Fluoroorganic Chemistry : Synthesis Reactivity, Applications, Wiley-VCH, Weinheim, 2004.
|
|
|
(c) Uneyama K. Organofluorine Chemistry, Blackwell, Oxford, 2006.
|
|
|
(d) Bégué J.-P.; Bonnet-Delpon D. Bioorganic and Medicinal Chemistry of Fluorine, Wiley, Hoboken, 2008.
|
|
|
Gouverneur V.; Muller K. Fluorine in Pharmaceutical and Medicinal Chemistry : From Biophysical Aspects to Clinical Applications, Imperial College Press, London, 2012.
|
|
| [16] |
(a) Burke T.R.; Lee K. Acc. Chem. Res. 2003, 36, 426.
doi: 10.1021/ar020127o |
|
(b) Muller K.; Faeh C.; Diederich F. Science 2007, 317, 1881.
doi: 10.1126/science.1131943 |
|
|
(c) Purser S.; Moore P.R.; Swallow S.; Gouverneur V. Chem. Soc. Rev. 2008, 37, 320.
doi: 10.1039/B610213C |
|
|
(d) Berger R.; Resnati G.; Metrangolo P.; Weberd E.; Hulliger J. Chem. Soc. Rev. 2011, 40, 3496.
doi: 10.1039/c0cs00221f |
|
|
(e) Wang J.; Sánchez-Roselló M.; Aceña J.L.; del Pozo C.; Sorochinsky A.E.; Fustero S.; Soloshonok V.A.; Liu H. Chem. Rev. 2014, 114, 2432.
doi: 10.1021/cr4002879 |
|
|
(f) Meanwell N.A. J. Med. Chem. 2018, 61, 5822.
doi: 10.1021/acs.jmedchem.7b01788 |
|
| [17] |
(a) Hansch C.; Leo A.; Unger S.H.; Kim K.H.; Nikaitani D.; Lien E.J. J. Med. Chem. 1973, 16, 1207.
pmid: 24484423 |
|
(b) Hansch C.; Leo A.; Taft R.W. Chem. Rev. 1991, 91, 165.
doi: 10.1021/cr00002a004 pmid: 24484423 |
|
|
(c) Biffinger J.C.; Kim H.W.; DiMagno S.G. ChemBioChem 2004, 5, 622.
pmid: 24484423 |
|
|
(d) Leroux F.; Jeschke P.; Schlosser M. Chem. Rev. 2005, 105, 827.
doi: 10.1021/cr040075b pmid: 24484423 |
|
|
(e) Manteau B.; Pazenok S.; Vors J.-P.; Leroux F.R. J. Fluorine Chem. 2010, 131, 140.
doi: 10.1016/j.jfluchem.2009.09.009 pmid: 24484423 |
|
|
(f) Landelle G.; Panossian A. Curr. Top. Med. Chem. 2014, 14, 941.
pmid: 24484423 |
|
| [18] |
(a) Boiko V.N. Beilstein J. Org. Chem. 2010, 6, 880.
doi: 10.3762/bjoc.6.88 pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
(b) Tlili A.; Billard T. Angew. Chem. Int. Ed. 2013, 52, 6818.
doi: 10.1002/anie.201301438 pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
(c) Liang T.; Neumann C.N.; Ritter T. Angew. Chem. Int. Ed. 2013, 52, 8214.
doi: 10.1002/anie.v52.32 pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
(d) Toulgoat F.; Alazet S.; Billard T. Eur. J. Org. Chem. 2014, 2415.
pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
(e) Besset T; Poisson T; Pannecoucke X. Chem. -Eur. J. 2014, 20, 16830.
doi: 10.1002/chem.201404537 pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
(f) Chu L.; Qing F.-L. Acc. Chem. Res. 2014, 47, 1513.
doi: 10.1021/ar4003202 pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
(g) Zhang K.; Xu X.; Qing F. Chin. J. Org. Chem. 2015, 35, 556. (in Chinese)
doi: 10.6023/cjoc201501017 pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
张柯, 徐修华, 卿凤翎, 有机化学, 2015, 35, 556.).
doi: 10.6023/cjoc201501017 pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
(h) Xu X.H.; Matsuzaki K.; Shibata N. Chem. Rev. 2015, 115, 731.
doi: 10.1021/cr500193b pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
(i) Ni C.; Hu M.; Hu J. Chem. Rev. 2015, 115, 765.
doi: 10.1021/cr5002386 pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
(j) Yang X.; Wu T.; Phipps R.J.; Toste F.D. Chem. Rev. 2015, 115, 826.
doi: 10.1021/cr500277b pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
(k) Shao X.; Xu C.; Lu L.; Shen Q. Acc. Chem. Res. 2015, 48, 1227.
doi: 10.1021/acs.accounts.5b00047 pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
(l) Barata-Vallejo S.; Bonesi S.; Postigo A. Org. Biomol. Chem. 2016, 14, 7150.
doi: 10.1039/C6OB00763E pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
(m) Zhang P.; Lu L.; Shen Q. Acta Chim. Sinica 2017, 75, 744. (in Chinese)
doi: 10.6023/A17050202 pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
|
张盼盼, 吕龙, 沈其龙, 化学学报, 2017, 75, 744.).
doi: 10.6023/A17050202 pmid: C2FFAE2D-3ADD-44F1-8659-75F71F4C092F |
|
| [19] |
(a) Guo Y.; Huang M.-W.; Fu X.-L.; Liu C.; Chen Q.-Y.; Zhao Z.-G.; Zeng B.-Z.; Chen J. Chin. Chem. Lett. 2017, 28, 719.
doi: 10.1016/j.cclet.2017.02.006 pmid: 44FA39C6-539D-4118-B69E-83C3722933D0 |
|
(b) Li S.; Wang J. Acta Chim. Sinica 2018, 76, 913. (in Chinese)
doi: 10.6023/A18070306 pmid: 44FA39C6-539D-4118-B69E-83C3722933D0 |
|
|
李树森, 王剑波, 化学学报, 2018, 76, 913.).
doi: 10.6023/A18070306 pmid: 44FA39C6-539D-4118-B69E-83C3722933D0 |
|
|
(c) Hardy M.A.; Chachignon H.; Cahard D. Asian J. Org. Chem. 2019, 8, 591.
doi: 10.1002/ajoc.v8.5 pmid: 44FA39C6-539D-4118-B69E-83C3722933D0 |
|
| [20] |
Luo J.; Zhu Z.; Liu Y.; Zhao X. Org. Lett. 2015, 17, 3620.
doi: 10.1021/acs.orglett.5b01727 |
| [21] |
Denmark S.E.; Beutner G.L. Angew. Chem., Int. Ed. 2008, 47, 1560.
doi: 10.1002/(ISSN)1521-3773 |
| [22] |
Liu X.; An R.; Zhang X.; Luo J.; Zhao X. Angew. Chem., Int. Ed. 2016, 55, 5846.
doi: 10.1002/anie.201601713 |
| [23] |
Luo J.; Liu Y.; Zhao X. Org. Lett. 2017, 19, 3434.
doi: 10.1021/acs.orglett.7b01392 |
| [24] |
(a) Petersen K.S. Tetrahedron Lett. 2015, 56, 6523.
doi: 10.1016/j.tetlet.2015.09.134 |
|
(b) Zeng X.-P.; Cao Z.-Y.; Wang Y.-H.; Zhou F.; Zhou J. Chem. Rev. 2016, 116, 7330.
doi: 10.1021/acs.chemrev.6b00094 |
|
| [25] |
Luo J.; Cao Q.; Cao X.; Zhao X. Nat. Commun. 2018, 9, 527.
doi: 10.1038/s41467-018-02955-0 |
| [26] |
(a) Wipf P. Chem. Rev. 1995, 95, 2115.
doi: 10.1021/cr00038a013 |
|
(b) Marson C.M.; Matthews C.J.; Atkinson S.J.; Lamadema N.; Thomas N. S. B.J. Med. Chem. 2015, 58, 6803.
doi: 10.1021/acs.jmedchem.5b00545 |
|
|
(c) Tyler A.R.; Mosaei H.; Morton S.; Waddell P.G.; Wills C.; McFarlane W.; Gray J.; Goodfellow M.; Errington J.; Allenby N.; Zenkin N.; Hall M.J. J. Nat. Prod. 2017, 80, 1558.
doi: 10.1021/acs.jnatprod.7b00082 |
|
|
(d) Yang G.; Zhang W. Chem. Soc. Rev. 2018, 47, 1783.
doi: 10.1039/C7CS00615B |
|
| [27] |
(a) Jaganathan A.; Garzan A.; Whitehead D.C.; Staples R.J.; Borhan B. Angew. Chem. Int. Ed. 2011, 50, 2593.
doi: 10.1002/anie.201006910 pmid: 29719676 |
|
(b) Jaganathan A.; Borhan B. Org. Lett. 2014, 16, 3616.
doi: 10.1021/ol500861z pmid: 29719676 |
|
|
(c) Marzijarani N.S.; Yousefi R.; Jaganathan A.; Ashtekar K.D.; Jackson J.E.; Borhan B. Chem. Sci. 2018, 9, 2898.
doi: 10.1039/c7sc04430e pmid: 29719676 |
|
| [28] |
Rauniyar V.; Lackner A.D.; Hamilton G.L.; Toste F.D. Science 2011, 334, 1681.
doi: 10.1126/science.1213918 |
| [29] |
(a) Kawato Y.; Kubota A.; Ono H.; Egami H.; Hamashima Y. Org. Lett. 2015, 17, 1244.
doi: 10.1021/acs.orglett.5b00220 |
|
(b) Kawato Y.; Ono H.; Kubota A.; Nagao Y.; Morita N.; Egami H.; Hamashima Y. Chem. -Eur. J. 2016, 22, 2127.
doi: 10.1002/chem.201503153 |
|
|
(c) Nagao Y.; Hisanaga T.; Egami H.; Kawato Y.; Hamashima Y. Chem. -Eur. J. 2017, 23, 16758.
doi: 10.1002/chem.201704847 |
|
| [30] |
Qin T.; Jiang Q.; Ji J.; Luo J.; Zhao X. Org. Biomol. Chem. 2019, 17, 1763.
doi: 10.1039/C8OB02575D |
| [31] |
Liu X.; Liang Y.; Ji J.; Luo J.; Zhao X. J. Am. Chem. Soc. 2018, 140, 4782.
doi: 10.1021/jacs.8b01513 |
| [32] |
Xu J.; Zhang Y.; Qin T.; Zhao X. Org. Lett. 2018, 20, 6384.
doi: 10.1021/acs.orglett.8b02672 |
| [33] |
Bräse S.; Gil C.; Knepper K.; Zimmermann V. Angew. Chem., Int. Ed. 2005, 44, 5188.
doi: 10.1002/(ISSN)1521-3773 |
| [34] |
Liang Y.; Zhao X. ACS Catal. 2019, 9, 6896.
doi: 10.1021/acscatal.9b01900 |
| [1] | 杨爽, 房新强. 氮杂环卡宾催化实现的动力学拆分近期研究进展[J]. 有机化学, 2024, 44(2): 448-480. |
| [2] | 陈宛婷, 钟雄威, 邢佳乐, 吴昌书, 高杨. C—N轴手性化合物的不对称催化合成研究进展[J]. 有机化学, 2024, 44(2): 349-377. |
| [3] | 姜权彬. 经由氮杂邻联烯醌中间体合成轴手性化合物的研究进展[J]. 有机化学, 2024, 44(1): 159-172. |
| [4] | 程春霞, 吴露平, 沙风, 伍新燕. 手性叔膦-酰胺不对称催化香豆素与Morita-Baylis-Hillman碳酸酯之间的插烯烯丙基烷基化反应[J]. 有机化学, 2023, 43(9): 3188-3195. |
| [5] | 全翌雯, 蒋心惠, 李文军, 汪舰. 借助有机催化去共轭-羟醛缩合反应来获得α-乙烯基-β-炔基取代的烯醛[J]. 有机化学, 2023, 43(6): 2120-2125. |
| [6] | 罗诚, 尹艳丽, 江智勇. P-手性膦氧化物的不对称合成研究进展[J]. 有机化学, 2023, 43(6): 1963-1976. |
| [7] | 景科, 张攀科, 徐森苗. 1,4-氮硼杂芳环在有机和过渡金属催化中的应用[J]. 有机化学, 2023, 43(5): 1742-1750. |
| [8] | 张心予, 耿慧慧, 张士磊, 王卫, 陈晓蓓. 一种N-杂环卡宾催化合成氘代苯偶姻的方法[J]. 有机化学, 2023, 43(4): 1510-1516. |
| [9] | 王海清, 杨爽, 张宇辰, 石枫. 邻羟基苄醇参与的催化不对称反应研究进展[J]. 有机化学, 2023, 43(3): 974-999. |
| [10] | 曹伟地, 刘小华. 不对称催化质子化构建α-叔碳羰基化合物研究进展[J]. 有机化学, 2023, 43(3): 961-973. |
| [11] | 方思强, 刘赞娇, 王天利. Atherton-Todd反应的研究进展[J]. 有机化学, 2023, 43(3): 1069-1083. |
| [12] | 戴春波, 夏思奇, 陈晓玉, 杨丽敏. 氮杂环卡宾(NHC)催化[4+3]环加成反应构建4-氨基苯并环庚烯内酯[J]. 有机化学, 2023, 43(3): 1084-1090. |
| [13] | 张雨杉, 桓臻, 杨金东, 程津培. 氮杂环磷氢试剂的氢转移活性研究进展[J]. 有机化学, 2023, 43(11): 3806-3825. |
| [14] | 曾燕, 叶飞. 不对称催化构建硅立体中心化合物的新反应体系研究进展[J]. 有机化学, 2023, 43(10): 3388-3413. |
| [15] | 赵佳怡, 葛怡聪, 何川. 不对称催化Si—H/X—H脱氢偶联构筑硅中心手性[J]. 有机化学, 2023, 43(10): 3352-3366. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||