有机化学 ›› 2021, Vol. 41 ›› Issue (5): 1939-1948.DOI: 10.6023/cjoc202101019 上一篇 下一篇
所属专题: 镍催化有机反应虚拟合辑; 热点论文虚拟合集
研究论文
收稿日期:2021-01-13
修回日期:2021-01-28
发布日期:2021-02-22
通讯作者:
施世良
基金资助:
Yu-Qing Li1, Shi-Liang Shi1,*( )
)
Received:2021-01-13
Revised:2021-01-28
Published:2021-02-22
Contact:
Shi-Liang Shi
About author:Supported by:文章分享
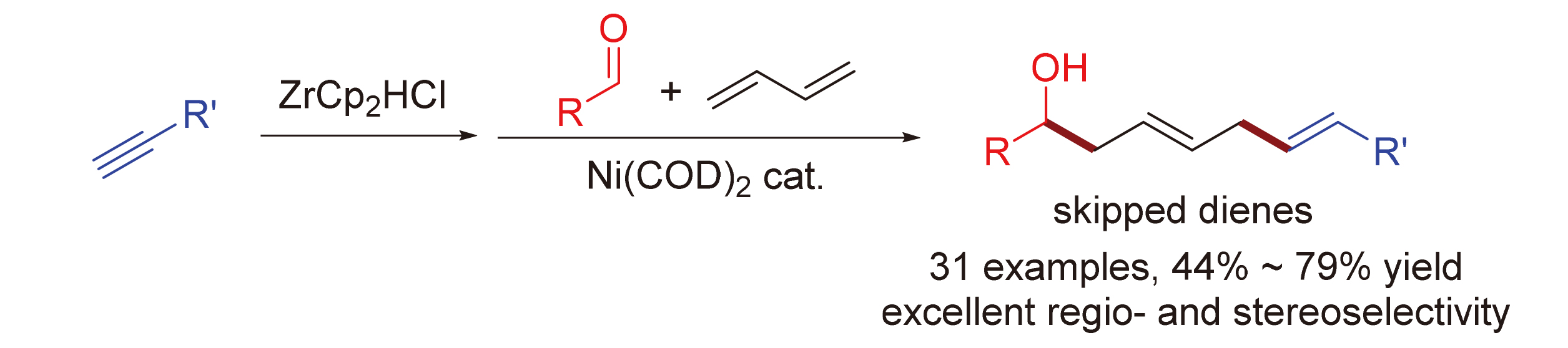
1,4-二烯结构广泛存在于一系列具有生物活性的化合物分子中, 其构建是有机合成中的重要研究领域之一. 使用简单易得的原料合成1,4-二烯具有重要的研究意义. 发展了镍催化的1,3-丁二烯、醛、炔和氢氯二茂锆的多组分偶联反应, 用于高效合成1,4-二烯产物. 该反应的原料均简单易得, 其中1,3-丁二烯更是大宗化工产品. 通过简单的炔烃氢锆化反应现场制备烯基锆试剂直接参与反应, 无需分离纯化. 反应以优秀的区域选择性和立体选择性合成了一系列(E,E)-1,4-二烯产物. 简单温和的反应条件使该方法具有广泛的底物适用范围和优秀的官能团兼容性. 该反应提供了一种合成1,4-二烯产物的高效且实用的方法.
李雨青, 施世良. 镍催化的丁二烯、醛、炔和氢氯二茂锆的多组分偶联反应合成1,4-二烯[J]. 有机化学, 2021, 41(5): 1939-1948.
Yu-Qing Li, Shi-Liang Shi. Nickel-Catalyzed Multicomponent Coupling of Butadiene, Aldehydes, Alkynes and Schwartz Reagent to Form 1,4-Dienes[J]. Chinese Journal of Organic Chemistry, 2021, 41(5): 1939-1948.
| Entry | T/℃ | Yieldb/% of 4a | Yieldb/% of 5a |
|---|---|---|---|
| 1 | 25 | 52 | 16 |
| 2 | 10 | 61 | 10 |
| 3 | 0 | 69 (63)c | <5 |
| 4 | –20 | 35 | <5 |
| 5d | 0 | 0 | 0 |
| 6e | 0 | 0 | 0 |
| Entry | T/℃ | Yieldb/% of 4a | Yieldb/% of 5a |
|---|---|---|---|
| 1 | 25 | 52 | 16 |
| 2 | 10 | 61 | 10 |
| 3 | 0 | 69 (63)c | <5 |
| 4 | –20 | 35 | <5 |
| 5d | 0 | 0 | 0 |
| 6e | 0 | 0 | 0 |
| [1] |
(a) Winter, P.; Hiller, W.; Christmann, M. Angew. Chem., Int. Ed. 2012, 51, 3396.
doi: 10.1002/anie.v51.14 |
|
(b) Tang, W.; Prusov, E. V. Angew. Chem., Int. Ed. 2012, 51, 3401.
doi: 10.1002/anie.v51.14 |
|
|
(c) Shin, J.; Paul, V. J.; Fenical, W. Tetrahedron Lett. 1986, 27, 5189.
doi: 10.1016/S0040-4039(00)85165-5 |
|
|
(d) Shinohara, Y.; Kudo, F.; Eguchit, T. J. Am. Chem. Soc. 2011, 133, 18134.
doi: 10.1021/ja208927r |
|
| [2] |
(a) Roulet, J. M.; Deguin, B.; Vogel, P. J. Am. Chem. Soc. 1994, 116, 3639.
doi: 10.1021/ja00087a076 |
|
(b) Denmark, S. E.; Guagnano, V.; Dixon, J. A.; Stolle, A. J. Org. Chem. 1997, 62, 4610.
doi: 10.1021/jo970686m |
|
|
(c) Wang, P.-S.; Liu, P.; Zhai, Y.-J.; Lin, H.-C.; Han, Z.-Y.; Gong, L.-Z. J. Am. Chem. Soc. 2015, 137, 12732.
doi: 10.1021/jacs.5b08477 |
|
|
(d) Lin, H.-C.; Wang, P.-S.; Tao, Z.-L.; Chen, Y.-G.; Han, Z.-Y.; Gong, L.-Z. J. Am. Chem. Soc. 2016, 138, 14354.
doi: 10.1021/jacs.6b08236 |
|
|
(e) Zhou, X.-L.; Su, Y.-L.; Wang, P.-S.; Gong, L.-Z. Acta Chim. Sinica 2018, 76, 857. (in Chinese).
doi: 10.6023/A18060235 |
|
|
(周霄乐, 苏永亮, 汪普生, 龚流柱, 化学学报, 2018, 76, 857.)
doi: 10.6023/A18060235 |
|
|
(f) Lin, H.-C.; Xie, P.-P.; Dai, Z.-Y.; Zhang, S.-Q.; Wang, P.-S.; Chen, Y.-G.; Wang, T.-C.; Hong, X.; Gong, L.-Z. J. Am. Chem. Soc. 2019, 141, 5824.
doi: 10.1021/jacs.8b13582 |
|
|
(g) Fan, L.-F.; Luo, S.-W.; Chen, S.-S.; Wang, T.-C.; Wang, P.-S.; Gong, L.-Z. Angew. Chem., Int. Ed. 2019, 58, 16806.
doi: 10.1002/anie.v58.47 |
|
| [3] |
(a) Sturla, S. J.; Kablaoui, N. M.; Buchwald, S. L. J. Am. Chem. Soc. 1999, 121, 1976.
doi: 10.1021/ja9839567 |
|
(b) Snider, B. B. Acc. Chem. Res. 1980, 13, 426.
doi: 10.1021/ar50155a007 |
|
| [4] |
(a) Schnermann, M. J.; Romero, F. A.; Hwang, I.; Nakamaru-Ogiso, E.; Yagi, T.; Boger, D. L. J. Am. Chem. Soc. 2006, 128, 11799.
pmid: 16953619 |
|
(b) Pospíšil, J.; Markó, I. E. J. Am. Chem. Soc. 2007, 129, 3516.
doi: 10.1021/ja0691728 pmid: 16953619 |
|
|
(c) Liu, W. B.; He, H.; Dai, L. X.; You, S. L. Chem.-Eur. J. 2010, 16, 7376.
doi: 10.1002/chem.201000316 pmid: 16953619 |
|
|
(d) Lin, A.; Wang, J.; Mao, H.; Shi, Y.; Mao, Z.; Zhu, C. Eur. J. Org. Chem. 2013,6241.
pmid: 16953619 |
|
|
(e) Ma, X.-T.; Wang, Y.; Dai, R.-H.; Liu, C.-R.; Tian, S.-K. J. Org. Chem. 2013, 78, 11071.
doi: 10.1021/jo401736k pmid: 16953619 |
|
|
(f) Xu, S.; Zhu, S.; Shang, J.; Zhang, J.; Tang, Y.; Dou, J. J. Org. Chem. 2014, 79, 3696.
doi: 10.1021/jo500375q pmid: 16953619 |
|
| [5] |
(a) Basavaiah, D.; Kumaragurubaran, N.; Sharada, D. S. Tetrahedron Lett. 2001, 42, 85.
doi: 10.1016/S0040-4039(00)01886-4 pmid: 12354010 |
|
(b) Basavaiah, D.; Sharada, D. S.; Kumaragurubaran, N.; Reddy, R. M. J. Org. Chem. 2002, 67, 7135.
pmid: 12354010 |
|
| [6] |
(a) Hamilton, J. Y.; Sarlah, D.; Carreira, E. M. J. Am. Chem. Soc. 2013, 135, 994.
doi: 10.1021/ja311422z |
|
(b) McCammant, M. S.; Liao, L.; Sigman, M. S. J. Am. Chem. Soc. 2013, 135, 4167.
doi: 10.1021/ja3110544 |
|
|
(c) Li, H.; Zhang, Z.; Shangguan, X.; Huang, S.; Chen, J.; Zhang, Y.; Wang, J. Angew. Chem., Int. Ed. 2014, 53, 11921.
doi: 10.1002/anie.201407000 |
|
|
(d) Bin, H.-Y.; Wei, X.; Zi, J.; Zuo, Y.-J.; Wang, T.-C.; Zhong, C. M. ACS Catal. 2015, 5, 6670.
doi: 10.1021/acscatal.5b01441 |
|
|
(e) Xu, G.; Zhao, H.; Fu, B.; Cang, A.; Zhang, G.; Zhang, Q.; Xiong, T.; Zhang, Q. Angew. Chem., Int. Ed. 2017, 56, 13130.
doi: 10.1002/anie.201707070 |
|
|
(f) Song, F.; Wang, F.; Guo, L.; Feng, X.; Zhang, Y.; Chu, L. Angew. Chem., Int. Ed. 2020, 59, 177.
doi: 10.1002/anie.v59.1 |
|
|
(t) Li, W.; Yu, S.; Li, J.; Zhao, Y. Angew. Chem., Int. Ed. 2020, 59, 14404.
doi: 10.1002/anie.v59.34 |
|
| [7] |
(a) RajanBabu, T. V. Synlett 2009,853.
|
|
(b) Hilt, G.; du Mesnil, F.-X.; Lüers, S. Angew. Chem., Int. Ed. 2001, 40, 387.
|
|
|
(c) Jing, S. M.; Balasanthiran, V.; Pagar, V.; Gallucci, J. C.; RajanBabu, T. V. J. Am. Chem. Soc. 2017, 139, 18034.
doi: 10.1021/jacs.7b10055 |
|
|
(d) Lian, X.; Chen, W.; Dang, L.; Li, Y.; Ho, C.-Y. Angew. Chem., Int. Ed. 2017, 56, 9048.
doi: 10.1002/anie.201703706 |
|
|
(e) Schmidt, V. A.; Kennedy, C. R.; Bezdek, M. J.; Chirik, P. J. J. Am. Chem. Soc. 2018, 140, 3443.
doi: 10.1021/jacs.8b00245 |
|
| [8] |
(a) Kimura, M.; Ezoe, A.; Mori, M.; Tamaru, Y. J. Am. Chem. Soc. 2005, 127, 201.
doi: 10.1021/ja0469030 |
|
(b) Kimura, M.; Kojima, K.; Tatsuyama, Y.; Tamaru, Y. J. Am. Chem. Soc. 2006, 128, 6332.
doi: 10.1021/ja0616332 |
|
| [9] |
(a) McCammant, M. S.; Liao, L.; Sigman, M. S. J. Am. Chem. Soc. 2013, 135, 4167.
doi: 10.1021/ja3110544 pmid: 25705367 |
|
(b) McCammant, M. S.; Sigman, M. S. Chem. Sci. 2015, 6, 1355.
pmid: 25705367 |
|
| [10] |
For selected reviews on difunctionalization of 1,3-dienes, see: (a) Wu, X.; Gong, L.-Z. Synthesis 2019, 51, 122.
doi: 10.1055/s-0037-1610379 pmid: 32055328 |
|
(b) Xiong, Y.; Sun, Y. W.; Zhang, G.-Z. Tetrahedron Lett. 2018, 59, 347.
doi: 10.1016/j.tetlet.2017.12.059 pmid: 32055328 |
|
|
(c) Wu, Z.; Zhang, W. Chin. J. Org. Chem. 2017, 37, 2250.
doi: 10.6023/cjoc201704031 pmid: 32055328 |
|
|
For selected examples, see:.
pmid: 32055328 |
|
|
(d) Luo, Y.-C.; Xu, C.; Zhang, X. Chin. J. Chem. 2020, 38, 1371.
doi: 10.1002/cjoc.v38.11 pmid: 32055328 |
|
|
(e) Gui, Y.-Y.; Hu, N.; Chen, X.-W.; Liao, L.-L.; Ju, T.; Ye, J.-H.; Zhang, Z.; Li, J.; Yu, D.-G. J. Am. Chem. Soc. 2017, 139, 17011.
doi: 10.1021/jacs.7b10149 pmid: 32055328 |
|
|
(f) Fu, B.; Yuan, X.; Li, Y.; Wang, Y.; Zhang, Q.; Xiong, T.; Zhang, Q. Org. Lett. 2019, 21, 3576.
doi: 10.1021/acs.orglett.9b00979 pmid: 32055328 |
|
|
(g) Xiong, Y.; Zhang, G. J. Am. Chem. Soc. 2018, 140, 2735.
doi: 10.1021/jacs.7b12760 pmid: 32055328 |
|
|
(h) Tao, Z. L.; Adili, A.; Shen, H. C.; Han, Z. Y.; Gong, L. Z. Angew. Chem., Int. Ed. 2016, 55, 4322.
doi: 10.1002/anie.201600148 pmid: 32055328 |
|
|
(i) Yang, J.; Ji, D. W.; Hu, Y. C.; Min, X. T.; Zhou, X.; Chen, Q. A. Chem. Sci. 2019, 10, 9560.
doi: 10.1039/c9sc03747k pmid: 32055328 |
|
|
(j) Xiao, L. J.; Cheng, L.; Feng, W. M.; Li, M. L.; Xie, J. H.; Zhou, Q. L. Angew. Chem., Int. Ed. 2018, 57, 461.
doi: 10.1002/anie.201710735 pmid: 32055328 |
|
| [11] |
(a) Holmes, M.; Schwartz, L. A.; Krische, M. J. Chem. Rev. 2018, 118, 6026.
doi: 10.1021/acs.chemrev.8b00213 |
|
(b) Nguyen, K. D.; Park, B. Y.; Luong, T.; Sato, H.; Garza, V. J.; Krische, M. J. Science 2016, 354, ahh5133.
|
|
|
(c) Montgomery, L. Angew. Chem., Int. Ed. 2004, 43, 3890.
doi: 10.1002/(ISSN)1521-3773 |
|
|
(d) Doerksen, R. S.; Meyer, C. C.; Krische, M. J. Angew. Chem., Int. Ed. 2019, 58, 14055.
doi: 10.1002/anie.v58.40 |
|
|
(e) Standley, E. A.; Tasker, S. Z.; Jensen, K. L.; Jamison, T. F. Acc. Chem. Res. 2015, 48, 1503.
doi: 10.1021/acs.accounts.5b00064 |
|
|
(d) Hoshimoto, Y.; Ohashi, M.; Ogoshi, S. Acc. Chem. Res. 2015, 48, 1746.
doi: 10.1021/acs.accounts.5b00061 |
|
| [12] |
(a) Zhang, W.-B.; Yang, X.-T.; Ma, J.-B.; Su, Z.-M.; Shi, S.-L. J. Am. Chem. Soc. 2019, 141, 5628.
doi: 10.1021/jacs.9b00931 |
|
(b) Cai, Y.; Zhang, J.-W.; Li, F.; Liu, J.-M.; Shi, S.-L. ACS Catal. 2019, 9, 1.
doi: 10.1021/acscatal.8b04198 |
|
|
(c) Cai, Y.; Ye, X.; Liu, S.; Shi, S.-L. Angew. Chem., Int. Ed. 2019, 58, 13433.
doi: 10.1002/anie.v58.38 |
|
|
(d) Shen, D.; Zhang, W.-B.; Li, Z.; Shi, S.-L.; Xu, Y. Adv. Synth. Catal. 2020, 362, 1125.
doi: 10.1002/adsc.v362.5 |
|
|
(e) Li, Y.-Q.; Li, F.; Shi, S.-L. Chin. J. Chem. 2020, 38, 1035.
doi: 10.1002/cjoc.v38.10 |
|
| [13] |
(a) Yang, Y.; Zhu, S.-F.; Duan, H.-F.; Zhou, C.-Y.; Wang, L.-X.; Zhou, Q.-L. J. Am. Chem. Soc. 2007, 129, 2248.
pmid: 17269780 |
|
(b) Sato, Y.; Takimoto, M.; Hayashi, K.; Katsuhara, T.; Takagi, K.; Mori, M. J. Am. Chem. Soc. 1994, 116, 9771.
doi: 10.1021/ja00100a061 pmid: 17269780 |
|
|
(c) Kimura, M.; Ezoe, A.; Shibata, K.; Tamaru, Y. J. Am. Chem. Soc. 1998, 120, 4033.
doi: 10.1021/ja973847c pmid: 17269780 |
|
|
(d) Kimura, M.; Fujimatsu, H.; Ezoe, A.; Shibata, K.; Shimizu, M.; Matsumoto, S.; Tamaru, Y. Angew. Chem., Int. Ed. 1999, 38, 397.
pmid: 17269780 |
|
|
(e) Kimura, M.; Ezoe, A.; Tanaka, S.; Tamaru, Y. Angew. Chem., Int. Ed. 2001, 40, 3600.
doi: 10.1002/1521-3773(20011001)40:19【-逻*辑*与-】amp;lt;3600::AID-ANIE3600【-逻*辑*与-】amp;gt;3.0.CO;2-N pmid: 17269780 |
|
|
(f) Kimura, M.; Ezoe, A.; Mori, M.; Iwata, K.; Tamaru, Y. J. Am. Chem. Soc. 2006, 128, 8559.
doi: 10.1021/ja0608904 pmid: 17269780 |
|
|
(g) Loh, T.-P.; Song, H. Y.; Zhou, Y. Org. Lett. 2002, 4, 2715.
doi: 10.1021/ol026216i pmid: 17269780 |
|
|
(h) Sato, Y.; Hinata, Y.; Seki, R.; Oonishi, Y.; Saito, N. Org. Lett. 2007, 9, 5597.
doi: 10.1021/ol702543m pmid: 17269780 |
|
|
(i) Cho, H. Y.; Morken, J. P. J. Am. Chem. Soc. 2010, 132, 7576.
doi: 10.1021/ja101513d pmid: 17269780 |
|
|
(j) Ogoshi, S.; Tonomori, K.; Oka, M. A. J. Am. Chem. Soc. 2006, 128, 7077.
pmid: 17269780 |
|
|
(k) Li, Y.-L.; Li, W.-D.; Gu, Z.-Y.; Chen, J.; Xia, J.-B. ACS Catal. 2019, 10, 1528.
doi: 10.1021/acscatal.9b05137 pmid: 17269780 |
|
|
(l) Chen, B.; Zhang, Y.; Wu, Y.; Fang, D.; Chen, X.; Wang, S.; Zhao, Y.; Hu, P.; Zhao, K.-Q.; Wang, B.-Q.; Cao, P. ACS Catal. 2019, 9, 11788.
doi: 10.1021/acscatal.9b04183 pmid: 17269780 |
|
| [14] |
Song, Z.; Takahashi, T. Hydrozirconation of Alkenes and Alkynes. Hydrozirconation of Alkenes and Alkynes, In Comprehensive Organic Synthesis II, 2 ed., Ed.: Knochel, P., Elsevier, London, 2014, pp.838~876.
|
| [15] |
During our manuscript preparation, similar work was reported, which utilize aldehydes, dienes and isolated vinylzirconium reagents to afford 1,4-dienes. (a) Wang, C.-G.; Zhang, Y.; Wang, S.; Chen, B.; Li, Y.; Ni, H.-L.; Gao, Y.; Hu, P.; Wang, B.-Q.; Cao, P. Org. Lett. 2021, 23, 535.
doi: 10.1021/acs.orglett.0c04059 |
|
(b) Li, Y.-Q.; Chen, G.; Shi, S.-L. Org. Lett. 2021, DOI: 10.1021/acs.orglett.1c00488.
doi: 10.1021/acs.orglett.1c00488 |
|
|
(c) Li, Y.-Q.; Shi, S.-L. Organometallics 2021, DOI: 10.1021/acs.organomet.1c00096.
doi: 10.1021/acs.organomet.1c00096 |
| [1] | 陈雯雯, 张琴, 张松月, 黄芳芳, 张馨尹, 贾建峰. 无光催化剂条件下可见光诱导炔基碘和亚磺酸钠偶联反应[J]. 有机化学, 2024, 44(2): 584-592. |
| [2] | 童红恩, 郭宏宇, 周荣. 可见光促进惰性碳-氢键对羰基的加成反应进展[J]. 有机化学, 2024, 44(1): 54-69. |
| [3] | 蒋宜欣, 唐伯孝, 毛海波, 陈雪霞, 俞洋杰, 全翠英, 徐昭阳, 石金慧, 刘益林. 水-聚乙二醇(PEG-200)中烯烃与碘代芳烃绿色可循环无负载偶联反应的研究[J]. 有机化学, 2023, 43(9): 3210-3215. |
| [4] | 陈祖佳, 宇世伟, 周永军, 李焕清, 邱琪雯, 李妙欣, 汪朝阳. BF3•OEt2作为催化剂与合成子在有机合成中的应用进展[J]. 有机化学, 2023, 43(9): 3107-3118. |
| [5] | 归春明, 周潼瑶, 王海峰, 严琼姣, 汪伟, 黄锦, 陈芬儿. 可见光氧化还原催化炔基化反应的研究进展[J]. 有机化学, 2023, 43(8): 2647-2663. |
| [6] | 梁陆祺, 奚娟, 姜若楠, 杨艺, 孙丰钢, 张立志, 李新进, 刘会. 镍催化硫酯转移反应合成芳基硫酯[J]. 有机化学, 2023, 43(4): 1566-1573. |
| [7] | 高师泉, 刘闯军, 杨俊锋, 张俊良. 钴催化的烯烃和炔烃的电化学还原偶联反应[J]. 有机化学, 2023, 43(4): 1559-1565. |
| [8] | 童宇星, 王子维, 刘奔, 徐耀威, 高颂, 唐向兵, 张兴华. 吲哚-3-硫醚类化合物的合成研究进展[J]. 有机化学, 2023, 43(4): 1310-1324. |
| [9] | 张妍妍, 张珠珠, 朱圣卿, 储玲玲. 镍催化不对称酰基化反应研究进展[J]. 有机化学, 2023, 43(3): 1023-1035. |
| [10] | 陈深豪, 邹松, 席婵娟. 光催化苯乙烯与BrCF2CO2Me的2∶2偶联反应: 双-二氟乙酸酯己雌酚衍生物的合成[J]. 有机化学, 2023, 43(3): 1157-1167. |
| [11] | 魏文婷, 李壮壮, 李婉迪, 李嘉琪, 石先莹. 纯水及空气中芳香羧酸和丙烯酸酯氧化偶联构筑苯酞的绿色方法[J]. 有机化学, 2023, 43(3): 1177-1186. |
| [12] | 刘婷婷, 胡宇才, 沈安. 亚胺配体协同氮杂环卡宾钯配合物催化碳碳偶联反应的作用机制[J]. 有机化学, 2023, 43(2): 622-628. |
| [13] | 刘宁, 爨晓丹, 李慧, 段希焱. 烯胺酮α-官能团化反应的研究进展[J]. 有机化学, 2023, 43(2): 602-621. |
| [14] | 沈梦涵, 李来强, 周泉, 王洁慧, 王磊. 可见光诱导下喹喔啉酮与吡咯衍生物的氧化偶联[J]. 有机化学, 2023, 43(2): 697-704. |
| [15] | 马彪, 章淼淼, 李占宇, 彭进松, 陈春霞. 无过渡金属催化的Suzuki-Type交叉偶联反应研究进展[J]. 有机化学, 2023, 43(2): 455-470. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||